2. 解放军东部战区73901部队, 上海 200439;
3. 第二军医大学长海医院临床实验中心, 上海 200433;
4. 第二军医大学长海医院烧伤科, 上海 200433
2. No. 73901 Troop of PLA Eastern Theater Command, Shanghai 200439, China;
3. Clinical Laboratory Center, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
4. Department of Burn Surgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
质粒转染对分子生物学和细胞生物学研究具有十分重要的意义,反转录病毒法、阳离子脂质体法和电穿孔转染法是目前最常用的3种质粒转染方法[1]。阳离子脂质体法对细胞毒性大,反转录病毒法需要考虑安全因素,而电穿孔转染法作为一种物理细胞转染方法,具有操作简单、转染效率高、可重复性好、适用谱广、作用机制相对比较清楚等优点,且在转染过程中无需激活细胞,在转染原代细胞及现有方法难以转染细胞系的转染方面具有优势[2-3]。
成纤维细胞由胚胎时期的间充质细胞分化而成,是机体疏松结缔组织的重要组成细胞,来源广泛,其分离、筛选和培养操作简单且技术成熟[4]。近年来随着细胞重编程研究的深入,成纤维细胞作为质粒转染的目标细胞,被越来越广泛地应用于诱导多能干细胞技术及基因功能方面的研究[5-6]。陈素珠等[7]通过优化电转染介质,使小鼠成纤维细胞NIH3T3细胞的电转染效率提高到21.2%。本研究拟对人原代成纤维细胞的电转染条件进一步优化,提高人原代成纤维细胞的电转染效率,为后续研究奠定基础。
1 材料和方法 1.1 电穿孔仪器与材料电穿孔仪为美国BTX公司的ECM830型细胞电穿孔仪,电转杯购于美国哈佛仪器公司(电极间距离为4 mm),电穿孔缓冲液为无钙、无镁的PBS(美国HyClone公司)。
1.2 质粒构建与细胞培养大肠杆菌DH5α和携带增强型绿色荧光蛋白(EGFP)基因的质粒pEGFP-N1购于和元生物(上海)股份有限公司。人原代成纤维细胞由第二军医大学长海医院烧伤研究所惠赠,常规培养于含10%胎牛血清(FBS,美国HyClone公司)的高糖DMEM培养液(美国Gibco公司)中,置于5% CO2、37 ℃细胞培养箱中培养,2~3 d换液1次,待细胞密度达到90%时采用胰酶消化法1:3传代,细胞培养至第5代进行电穿孔转染实验。
1.3 电穿孔转染人原代成纤维细胞在电穿孔转染前用0.25%胰酶消化,离心后吹打为单细胞悬液,用流式细胞仪(MACSQuant VYB,德国美天旎公司)计数并调节细胞密度为1×106/mL,将细胞悬液分别与浓度为5、10、20和30 μg/mL的质粒混合均匀,选择280、290、300、310、320、330 V脉冲分别进行转染,单次脉冲时间为20 ms,分别脉冲1~3次。电穿孔转染后将细胞吹打混匀,显微镜观察后置于37 ℃、5% CO2培养箱中培养,24 h后检测转染情况。
1.4 人原代成纤维细胞免疫荧光检测实验前预先铺细胞爬片,消化细胞后吹打至单细胞悬液,2×104/孔接种。贴壁24 h后取出爬片,PBS洗涤3次,4%多聚甲醛(美国Sigma公司)4 ℃固定30 min,PBS洗涤3次,1% Triton X-100(T9284,美国Sigma公司)室温穿膜30 min,3% FBS室温封闭30 min。分别4 ℃过夜标记1:100稀释的一抗[血管平滑肌肌动蛋白(α-SMA)抗体(ab5694,英国Abcam公司),细胞波形蛋白(vimentin)抗体(ab8978,英国Abcam公司)],PBS洗涤3次;室温标记二抗2 h,PBS洗涤3次;DAPI室温孵育5 min,封片,荧光显微镜下观察。
1.5 锥虫蓝染色检测细胞存活率胰酶消化细胞后,培养液重悬细胞悬液,用Countstar自动细胞计数仪(上海瑞钰科技有限公司)计数,取20 μL 5%锥虫蓝与20 μL细胞悬液混匀,加入Countstar专用计数板,插入计数仪中计数细胞并检测细胞存活率。
1.6 流式细胞术检测细胞转染效率消化细胞,吹打至单细胞悬液,PBS洗涤2次,调整细胞密度为106/mL,利用FITC通道检测细胞绿色荧光表达阳性率[8]。计算细胞转染效率:细胞转染效率(%)=绿色荧光阳性细胞数/总细胞数×100%[9]。
1.7 统计学处理每组实验在相同条件下重复4次。所得数据应用SPSS 17.0软件分析。数据以x±s表示,采用单因素方差分析(one-way ANOVA)进行组间比较。检验水准(α)为0.05。
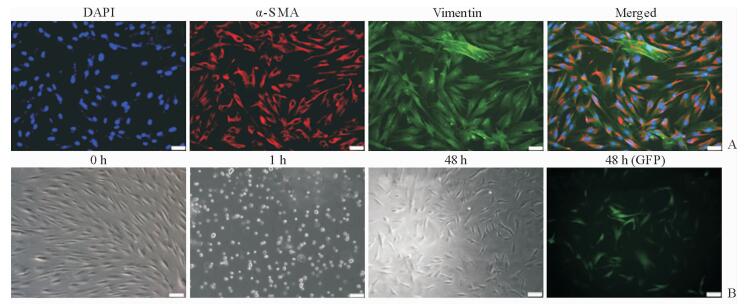
2 结果 2.1 人原代成纤维细胞鉴定及电转染前后形态对比免疫荧光检测结果显示人原代成纤维细胞α-SMA和vimentin表达呈双阳性,纯度大于95%(图 1A)。电转染前人原代成纤维细胞贴壁生长,呈长梭形,胞体平坦,体积较大,细胞核较大且呈椭圆形;电转染1 h后,细胞呈不规则形或椭圆形,悬浮于培养液中;48 h后细胞呈长梭形贴壁生长,荧光检测结果显示细胞呈绿色荧光(图 1B)。
|
图 1 人原代成纤维细胞的鉴定及电转染 Fig 1 Identification and electroporation transfection of human primary fibroblasts A: Identification of human primary fibroblasts with α-SMA and vimentin using immunofluorescent assay; B: Morphologic change of human primary fibroblasts before (0 h) and 1 h and 48 h after cell electroporation transfection, and GFP observation at 48 h after electroporation transfection. α-SMA: α-Smooth muscle actin; GFP: Green fluorescent protein. Scale bar=100 μm |
2.2 不同电压条件对细胞转染效率及存活率的影响
质粒浓度为20 μg/mL时,280、290、300、310、320 V电压条件下人原代成纤维细胞的转染效率逐渐升高(P<0.05),320 V和330 V电压条件下细胞的转染效率差异无统计学意义,见图 2A。而细胞存活率则随着脉冲电压的升高而逐渐降低,330 V电压脉冲下的细胞存活率由320 V电压条件下的(74.30±3.01)%降为(47.30±6.88)%,差异有统计学意义(P<0.05,图 2B)。

|
图 2 脉冲电压和质粒浓度对电转染效果的影响 Fig 2 Effect of pulse voltages and plasmid concentration on electroporation transfection A: Efficiency of electroporation transfection tested by flow cytometry with gradient pulsed voltages; B: Different cell survival rates with gradient pulsed voltages; C: Efficiency of electroporation transfection with gradient plasmid concentration. *P < 0.05. n=4, x±s |
2.3 电压恒定时不同质粒浓度对电穿孔转染效率的影响
在低电压(LV)模式下,脉冲电压固定在320 V时,人原代成纤维细胞的电转染效率随质粒浓度的增加而逐渐增加,质粒浓度为20 μg/mL时的电转染效率为(42.53±0.63)%,高于质粒浓度为10 μg/mL时的电转染效率[(26.90±1.35)%,P < 0.05],而20 μg/mL和30 μg/mL浓度时的电转染效率差异无统计学意义(图 2C)。
2.4 电压和质粒浓度固定时不同脉冲次数对电穿孔转染效率的影响在LV模式下,脉冲电压320 V、质粒浓度为20 μg/mL时,脉冲1次和2次的电转染效率分别为(42.53±0.63)%和(47.20±2.47)%,差异有统计学意义(P<0.05)。然而,脉冲1次的细胞存活率为(74.30±3.01)%,脉冲2次的细胞存活率降低为(43.05±2.06)%,差异也有统计学意义(P<0.05)。说明脉冲1次时具有较高的转染效率和更好的细胞存活率。
3 讨论成纤维细胞是人体皮肤的重要组成细胞,也是皮肤组织工程的种子细胞,具有来源广泛、获取容易、培养传代技术相对成熟等特点,对创面修复起到十分重要的作用[10]。近年随着细胞重编程技术的发展,人成纤维细胞被作为重要的基础细胞得到广泛应用[11-13]。
细胞电穿孔转染技术始于20世纪80年代中期[14]。电穿孔转染是一种在电击作用下,在细胞膜上短时间形成穿孔,将DNA等大分子在电泳力的作用下导入细胞并最终进入胞核的技术[15]。细胞电穿孔转染是一种高效、简便的基因转移系统,具有其他转移方法无可比拟的优越性,如操作简便、快捷、可重复性强、适用谱广等[16]。但是细胞电穿孔转染的转染效率却受到很多因素的影响,如脉冲介质、脉冲时间、脉冲电压、脉冲个数,甚至操作时的室内温度、湿度等都可能影响到细胞转染效率[17]。鉴于人成纤维细胞作为基础细胞被广泛应用于基因相关的基础研究,因此本研究对其电转染条件进行优化。
在电阻一定的时候,脉冲电压的大小决定了通过细胞及电转液的电流大小,对电转染效率和细胞存活率有着重要的作用。本研究发现在LV模式下,脉冲电压320 V和330 V时的电转染效率高于280~310 V时的细胞转染效率,而320 V条件下细胞存活率高于330 V的细胞存活率;同时,研究发现在脉冲1次、质粒浓度为20 μg/mL条件下,在保证细胞较高存活率的基础上能比较好地提高细胞转染效率。因此,我们认为在LV模式下,脉冲电压320 V、质粒浓度20 μg/mL、脉冲1次是比较理想的人原代成纤维细胞电穿孔转染的转染条件。另外,本研究还发现电穿孔转染过程中电转杯的使用次数需要严格按照说明书操作,一般情况下电转染2次就应该更换电转杯。
综上所述,本研究通过优化质粒浓度、脉冲电压和脉冲次数,在保证细胞较高存活率的前提下,提高了人原代成纤维细胞电穿孔转染效率,为后续基因转染相关的基础研究提供了相关依据。
| [1] | 芦小燕, 解慧琪, 李莉, 智伟, 陈晓禾, 邓力. 人成纤维细胞稳定转染的方法比较[J]. 四川大学学报(医学版), 2008, 39: 654–657. |
| [2] | HANZEL M, WINGATE R J, BUTTS T. Ex vivo culture of chick cerebellar slices and spatially targeted electroporation of granule cell precursors[J/OL]. J Vis Exp, 2015:e53421. doi:10.3791/53421. |
| [3] | MULLER R Y, HAMMOND M C, RIO D C, LEE Y J. An efficient method for electroporation of small interfering RNAs into ENCODE Project Tier 1 GM12878 and K562 cell lines[J]. J Biomol Tech, 2015, 26: 142–149. |
| [4] | 丁思加, 赵晨, 蒋超. 人皮肤成纤维细胞的分离和原代培养[J]. 江苏医药, 2015, 41: 2246–2248. |
| [5] | ZHENG Z, JIAN J, ZHANG X, ZARA J N, YIN W, CHIANG M, et al. Reprogramming of human fibroblasts into multipotent cells with a single ECM proteoglycan, fibromodulin[J]. Biomaterials, 2012, 33: 5821–5831. DOI: 10.1016/j.biomaterials.2012.04.049 |
| [6] | INAGAWA K, IEDA M. Direct reprogramming of mouse fibroblasts into cardiac myocytes[J]. J Cardiovasc Transl Res, 2013, 6: 37–45. DOI: 10.1007/s12265-012-9412-5 |
| [7] | 陈素珠, 卢文显, 刘红, 宋洋, 黄镇. 用于电转染NIH3T3细胞的两种电击介质的比较[J]. 福建师范大学学报(自然科学版), 2015, 1: 99–102. |
| [8] | ZHANG F, WANG X, QIU X, WANG J, FANG H, WANG Z, et al. The protective effect of esculentoside A on experimental acute liver injury in mice[J/OL]. PLoS One, 2014, 9:e113107. doi:10.1371/journal.pone.0113107. |
| [9] | 徐珊, 杜冲, 马艳民, 谢宏俊, 高杨, 石琦, 等. 人永生化表皮细胞HaCaT电转染条件的优化[J]. 西安交通大学学报(医学版), 2014, 4: 551–556. |
| [10] | LEE N M, ERISKEN C, ISKRATSCH T, SHEETZ M, LEVINE W N, LU H H. Polymer fiber-based models of connective tissue repair and healing[J]. Biomaterials, 2017, 112: 303–312. DOI: 10.1016/j.biomaterials.2016.10.013 |
| [11] | KELE M, DAY K, RÖNNHOLM H, SCHUSTER J, DAHL N, FALK A. Generation of human iPS cell line CTL07-Ⅱ from human fibroblasts, under defined and xeno-free conditions[J]. Stem Cell Res, 2016, 17: 474–478. DOI: 10.1016/j.scr.2016.09.028 |
| [12] | MATZ P, ADJAYE J. Episomal-based generation of an iPS cell line from human fetal foreskin fibroblasts[J]. Stem Cell Res, 2016, 16: 67–69. DOI: 10.1016/j.scr.2015.12.009 |
| [13] | CIEŚLAR-POBUDA A, RAFAT M, KNOFLACH V, SKONIECZNA M, HUDECKI A, MAŁECKI A, et al. Human induced pluripotent stem cell differentiation and direct transdifferentiation into corneal epithelial-like cells[J]. Oncotarget, 2016, 7: 42314–42329. DOI: 10.18632/oncotarget.v7i27 |
| [14] | CANATELLA P J, KARR J F, PETROS J A, PRAUSNITZ M R. Quantitative study of electroporation-mediated molecular uptake and cell viability[J]. Biophys J, 2001, 80: 755–764. DOI: 10.1016/S0006-3495(01)76055-9 |
| [15] | EKICI Y, TEZCANER T, AYDIN H O, BOYVAT F, MORAY G. Arterial complication of irreversible electroporation procedure for locally advanced pancreatic cancer[J]. World J Gastrointest Oncol, 2016, 8: 751–756. DOI: 10.4251/wjgo.v8.i10.751 |
| [16] | CHANG C C, WU M, YUAN F. Role of specific endocytic pathways in electrotransfection of cells[J]. Mol Ther Methods Clin Dev, 2014, 1: 14058. DOI: 10.1038/mtm.2014.58 |
| [17] | WEI Z, ZHAO D, LI X, WU M, WANG W, HUANG H, et al. A laminar flow electroporation system for efficient DNA and siRNA delivery[J]. Anal Chem, 2011, 83: 5881–5887. DOI: 10.1021/ac200625b |
 2017, Vol. 38
2017, Vol. 38


