2. 中国科学院北京转化医学研究院, 北京 100012
2. Beijing Institute of Translational Medicine, Chinese Academy of Sciences, Beijing 100012, China
皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL)是原发于皮肤的T淋巴细胞克隆性增殖所致的疾病,由一组临床表现、病程预后、治疗方法各异的疾病组成,近年来CTCL的发病率呈现快速增长的趋势[1]。Sézary综合征(Sézary syndrome)是一种侵袭性、白血病性的CTCL,其典型表现为皮肤的弥漫浸润、外周淋巴结肿大、剧烈瘙痒以及外周血中出现特征性的Sézary细胞(SS细胞)[2]。与大多数CTCL的缓慢进程不同,Sézary综合征的预后很差,5年生存率仅为15%~24%[3]。独立生长因子1(growth factor independence 1,GFI-1)是一种核锌指蛋白,在造血细胞和神经细胞的发生、发展过程中发挥重要的生物学功能[4]。GFI-1作为一种转录抑制子在造血细胞发展的多个阶段(例如从干细胞到前体细胞再到分化成熟的淋巴细胞和髓细胞)是必需的,其在T细胞的发展过程中尤其是辅助性T细胞2(helper T cell 2,Th2)的分化和功能执行中发挥重要的生物学作用[5]。本研究通过检测GFI-1基因在Sézary综合征患者和正常人外周血中的表达情况,以及观察干扰素α2b(interferon-α-2b, IFN-α2b)对GFI-1基因表达的影响,初步探讨GFI-1在Sézary综合征发生、发展中的作用。
1 材料和方法 1.1 材料Hut78细胞系(Sézary综合征外周血T细胞,ATCC号:TIB-161),Jurkat细胞系(人外周血白血病T细胞,ATCC号:TIB-152)。RPMI 1640培养液、胎牛血清(美国Gibco公司),IFN-α2b(北京凯因生物技术有限公司),cDNA合成试剂盒(美国Fermentas公司),FITC-Annexin Ⅴ凋亡检测试剂盒(美国CA公司),Power SYBR® Green PCR Master Mix试剂盒(美国ABI公司)。
收集7例Sézary综合征患者(1例来源于航空总医院,4例来源于郑州大学第一附属医院,2例来源于河南省肿瘤医院)外周血标本。所有患者均符合Sézary综合征的诊断标准:表现为红皮病、全身淋巴结肿大,外周血涂片SS细胞比例>5%;经流式细胞术检测示外周血细胞中有典型CD7抗原丢失。另外,选择10例正常人(来源于航空总医院)的外周血作为对照。本实验遵循《赫尔辛基宣言》,所有患者及正常对照者均签署了知情同意书。
1.2 细胞培养Hut78、Jurkat细胞使用含有10%胎牛血清和1%青、链霉素的RPMI 1640培养液在37 ℃、5% CO2孵育箱中培养传代,取对数生长期细胞进行后续实验。
1.3 外周血T细胞分离留取Sézary综合征患者和正常对照者的外周抗凝血各4 mL。用枪头将4 mL的抗凝血和4 mL的无菌PBS轻轻混匀。在15 mL离心管中分别加入3 mL Ficoll分离液,取上述混匀的血液各4 mL分别轻轻地加到2只已经加入Ficoll分离液的离心管上方(注意一定要缓慢加,不要剧烈摇晃)。把2管加好的液体放入离心机,400×g离心30~40 min。慢慢吸取上方的黄色血浆,弃去,然后轻轻地吸取中间的白色液体层(含有淋巴细胞、血小板和单核细胞)移到新的15 mL离心管中。每管(含中间白色液体层的离心管)加入8 mL PBS(不含钙和镁),100×g离心10 min。所得沉淀即为单核细胞,将细胞加入流式细胞仪中,分别分选出Sézary综合征患者外周血CD4+CD7-T细胞和正常对照者外周血CD4+T细胞,并进一步提取RNA。
1.4 qPCR检测GFI-1、细胞周期依赖性蛋白激酶抑制因子P21、Caspase-3和肿瘤坏死因子相关的凋亡诱导配体(TRAIL) mRNA的表达加入TRIzol试剂提取细胞的RNA, 然后反转录为cDNA。以cDNA为模板,加入相应的目的基因引物(表 1)进行qPCR扩增,以GAPDH作为内参。读取不同样本的Ct值,每个样本分别重复2次,取平均值为最终结果, 结果输出为:(目的基因Ct值-内参基因Ct值)/内参基因Ct值×104。以上结果重复3次,取平均数为目的基因mRNA的相对表达水平。
|
|
表 1 目的基因引物序列 Tab 1 Primer sequences of target genes |
1.5 蛋白质印迹法检测GFI-1的表达
离心弃上清,用PBS洗涤细胞2次,加入蛋白裂解液,混匀。4 ℃振荡孵育1 h,4 ℃ 18 000×g离心10 min。收集上清,采用BSA法蛋白定量试剂盒进行蛋白定量。取一定体积的总蛋白,加入5×蛋白电泳上样缓冲液,充分混匀后,水浴99 ℃变性5 min。加样孔注入等量总蛋白(20 μg)和5 μL marker,80 V恒压30 min,120 V恒压SDS-PAGE 90 min。200 mA 120 min将电泳条带电转印到PVDF膜上,5% BSA封闭1 h后,分别加入1:1 000稀释兔抗人GFI-1多克隆抗体(英国Abcam公司,货号:ab21061)、1:1 000稀释兔抗人GAPDH单克隆抗体(英国Abcam公司,货号:ab8245),4 ℃过夜。TBST洗涤后加入1:2 000辣根过氧化物酶标记的山羊抗兔二抗或山羊抗鼠二抗,室温孵育30 min,TBST漂洗,加入显色底物显色3 min。采用Image-Pro Plus图像分析软件分析蛋白条带的积分光密度值(平均光密度×面积),以靶蛋白积分光密度值/GAPDH积分光密度值的比值反映靶蛋白相对表达水平。
1.6 MTS法测定Hut78细胞的增殖情况取对数生长期Hut78细胞,以2×104/mL的密度接种于6孔板中。分别用0、3 000、5 000、10 000、20 000 U/mL的IFN-α2b处理Hut78细胞24、48、72 h。混匀细胞,取100 μL细胞混悬液至96孔板中,每个浓度、每个时间点设3复孔,每孔中加20 μL预先配好的MTS溶液,37 ℃孵箱中孵育2 h,使用分光光度仪测定490 nm处的光密度值。以上实验重复3次,取平均数。
1.7 流式细胞术测定Hut78细胞的凋亡情况取对数生长期Hut78细胞,接种于6孔板中。加入10 000 U/mL IFNα-2b培养Hut78细胞12、24 h。计数细胞,以冷的PBS清洗细胞2次,将细胞重新以1×106/mL的细胞密度悬浮在结合缓冲液中。将100 μL细胞悬液转移到5 mL培养管中,每管中加入5 μL PE偶联的AnnexinⅤ以及5 μL 7-AAD。混匀细胞避光孵育15 min。每管中加入400 μL结合缓冲液,在1 h内用流式细胞仪检测。以上实验重复3次。
1.8 统计学处理应用SPSS 11.0软件进行数据分析。计量资料采用x±s表示,多个样本的均数比较采用单因素方差分析(one-way ANOVA)或多因素方差分析。检验水准(α)为0.05。
2 结果 2.1 各组细胞中GFI-1 mRNA的表达如图 1所示,Sézary综合征患者外周血SS细胞中GFI-1 mRNA的表达较正常对照者外周血T细胞增加,差异有统计学意义(P<0.05)。Sézary综合征来源Hut78细胞中,GFI-1 mRNA也呈高表达,且与正常对照者外周血T细胞相比差异有统计学意义(P<0.05)。Jurkat细胞系中GFI-1 mRNA的表达也高于正常对照者外周血T细胞(P<0.05),但Sézary综合征患者外周血T细胞和Hut78细胞中GFI-1 mRNA的表达水平均高于Jurkat细胞(P<0.05)。

|
图 1 qPCR检测各组细胞中GFI-1 mRNA的表达 Fig 1 Expression of GFI-1 mRNA in four groups by qPCR GFI-1: Growth factor independence 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; SS: Sézary cells. *P < 0.05 vs normal T cells; △P < 0.05 vs Jurkat cells. x±s |
2.2 各组细胞中GFI-1蛋白的表达
如图 2所示,Sézary综合征患者SS细胞和Sézary综合征来源Hut78细胞中GFI-1蛋白的表达与正常对照者外周血T细胞和Jurkat细胞相比均增加,差异有统计学意义(P<0.05)。Jurkat细胞中GFI-1蛋白的表达高于正常对照者外周血T细胞,差异有统计学意义(P<0.05)。

|
图 2 蛋白质印迹法检测各组细胞中GFI-1蛋白的表达 Fig 2 Expression of GFI-1 protein in four groups by Western blotting GFI-1: Growth factor independence 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; SS: Sézary cells. *P < 0.05 vs normal T cells; △P < 0.05 vs Jurkat cells. n=3, x±s |
2.3 IFN-α2b抑制Hut78细胞的体外增殖
分别用3 000、5 000、10 000、20 000 U/mL的IFN-α2b处理Hut78细胞24、48、72 h后,MTS法检测细胞体外增殖情况,结果(图 3)显示:与对照组相比(未加IFN-α2b),各浓度处理组各处理时间点的细胞增殖能力均降低,差异均有统计学意义(P < 0.05)。
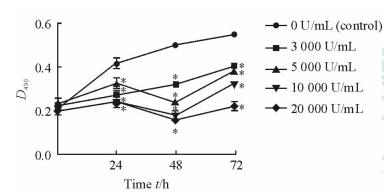
|
图 3 MTS法检测IFN-α2b对Hut78细胞增殖的影响 Fig 3 Effect of IFN-α2b on proliferation of Hut78 cells by MTS assay IFN-α2b: Interferon-α-2b. *P < 0.05 vs 0 U/mL of IFN-α2b treatment for the same time. n=3, x±s |
2.4 IFN-α2b对Hut78细胞GFI-1和细胞周期抑制与凋亡相关基因mRNA表达的影响
如图 4所示,Hut78细胞经10 000 U/mL IFN-α2b处理12 h和24 h后GFI-1 mRNA的表达均减少(P<0.05),而P21、TRAIL和Caspase-3 mRNA的表达均增加(P<0.05)。
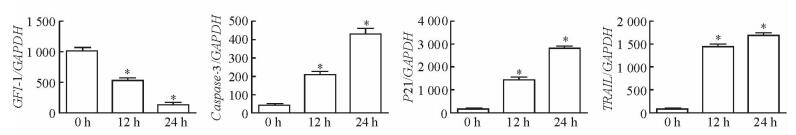
|
图 4 qPCR检测IFN-α2b对Hut78细胞GFI-1和细胞周期抑制与凋亡相关基因mRNA表达的影响 Fig 4 Effect of IFN-α2b on mRNA expression of GFI-1 and cell cycle inhibition-, apoptosis-associated genes in Hut78 cells by qPCR IFN-α2b: Interferon-α-2b; GFI-1: Growth factor independence 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; Caspase-3: Cysteinyl aspartate specific proteinase 3; P21: A cyclin-dependent kinase inhibitor; TRAIL: Tumor necrosis factor-related apoptosis-inducing ligand. *P < 0.05 vs 0 h. n=3, x±s |
2.5 IFN-α2b诱导Hut78细胞的凋亡
用10 000 U/mL IFN-α2b处理Hut78细胞12、24 h后,用流式细胞术测定细胞凋亡情况,结果(图 5)显示随IFN-α2b处理时间的延长Hut78细胞的凋亡数量增加,与空白对照组相比差异均有统计学意义(P<0.05)。
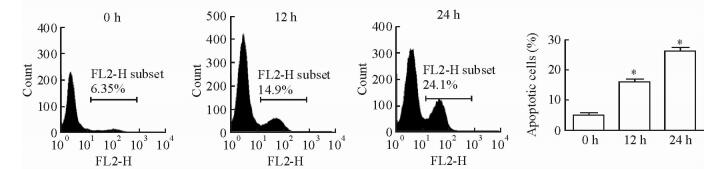
|
图 5 流式细胞术检测IFN-α2b对Hut78细胞凋亡的影响 Fig 5 Effect of IFN-α2b on apoptosis of Hut78 cells by flow cytometry IFN-α2b: Interferon-α-2b. *P < 0.05 vs 0 h. n=3, x±s |
3 讨论
Sézary综合征患者外周血的SS细胞具有很多特征性的生物学表现。它们来源于CD4+CD45RO+的成熟T细胞,具有脑回状的细胞核,主要表达以Th2为主的细胞因子,常常丢失细胞表面抗原CD7和CD26[6]。研究表明,导致Sézary综合征中肿瘤细胞聚集的主要原因是细胞对凋亡诱导的抵抗,而并不是细胞的增殖加速,尤其对活化诱导的细胞凋亡(activation-induced T cell death,AICD)的抵抗是SS细胞的特征性表现[7]。然而,人们对造成SS细胞这些特征性生物学表现的分子机制仍然了解很少。GFI-1是一种核锌指蛋白,在T淋巴细胞的发展过程中发挥重要的生物学作用,其表达异常有可能会导致T淋巴细胞在发育过程中出现肿瘤性增殖[8]。研究发现在T细胞的发育过程中,胸腺的T细胞前体内源性表达一定量的GFI-1,而成熟的外周T淋巴细胞则不表达GFI-1,但是抗原刺激以及ERK1/2的激活引起的T淋巴细胞激活可以导致外周成熟T淋巴细胞中GFI-1的表达上调,表明其在T淋巴细胞的活化过程中发挥重要作用[9]。GFI-1在血液系统肿瘤形成过程中可以发挥截然相反的作用,在小鼠模型中,GFI-1表达缺失可以导致小鼠髓系白血病的发生,而GFI-1过表达可以形成淋巴瘤,因此,依据细胞所处的不同环境,GFI-1既有肿瘤抑制作用又有肿瘤促进作用[10]。而本研究显示,Sézary综合征患者外周血的SS细胞中GFI-1 mRNA和蛋白的表达增加,并且用皮肤T淋巴细胞淋巴瘤的一线治疗药物IFN-α2b处理Sézary综合征来源细胞系Hut78细胞后,GFI-1 mRNA表达降低,同时细胞凋亡增加,细胞凋亡相关基因TRAIL和Caspase-3的mRNA表达增加,细胞周期抑制相关基因P21 mRNA表达也增加。
综上所述,本研究发现GFI-1在Sézary综合征患者外周血SS细胞中特异性表达升高,并且诱导细胞凋亡时GFI-1表达降低,表明GFI-1在Sézary综合征的发生和发展过程中发挥重要作用,为阐明Sézary综合征的发病机制提供了新的线索。
| [1] | SIDIROPOULOS K G, MARTINEZ-ESCALA M E, YELAMOS O, GUITART J, SIDIROPOULOS M. Primary cutaneous T-cell lymphomas:a review[J]. J Clin Pathol, 2015, 68: 1003–1010. DOI: 10.1136/jclinpath-2015-203133 |
| [2] | SDEVATA S, WILCOX R A. Cutaneous T-cell lymphoma:a review with a focus on targeted agents[J]. Am J Clin Dermatol, 2016, 17: 225–237. DOI: 10.1007/s40257-016-0177-5 |
| [3] | OLSEN E A, HODAK E, ANDERSON T, CARTER J B, HENDERSON M, COOPER K, et al. Guidelines for phototherapy of mycosis fungoides and Sézary syndrome:a consensus statement of the United States Cutaneous Lymphoma Consortium[J]. J Am Acad Dermatol, 2015, 74: 27–58. |
| [4] | MÖRÖY T, VASSEN L, WILKES B, KHANDANPOUR C. From cytopenia to leukemia:the role of Gfi-1 and Gfi-1b in blood formation[J]. Blood, 2015, 126: 2561–2569. DOI: 10.1182/blood-2015-06-655043 |
| [5] | CHIANG C, AYYANATHAN K. Snail/Gfi-1(SNAG) family zinc finger proteins in transcription regulation, chromatin dynamics, cell signaling, development, and disease[J]. Cytokine Growth Factor Rev, 2013, 24: 123–131. DOI: 10.1016/j.cytogfr.2012.09.002 |
| [6] | PRINCE H M, WHITTAKER S, HOPPE R T. How I treat mycosis fungoides and Sézary syndrome[J]. Blood, 2009, 114: 4337–4353. DOI: 10.1182/blood-2009-07-202895 |
| [7] | THONNART N, CAUDRON A, LEGAZ I, BAGOT M, BENSUSSAN A, MARIE-CARDINE A. KIR3DL2 is a coinhibitory receptor on Sézary syndrome malignant T cells that promotes resistance to activation-induced cell death[J]. Blood, 2014, 124: 3330–3332. DOI: 10.1182/blood-2014-09-598995 |
| [8] | THAMBYRAJAH R, PATEL R, MAZAN M, LIE-A-LING M, LILLY A, ELIADES A, et al. New insights into the regulation by RUNX1 and GFI-1(s) proteins of the endothelial to hematopoietic transition generating primordial hematopoietic cells[J]. Cell Cycle, 2016, 15: 2108–2114. DOI: 10.1080/15384101.2016.1203491 |
| [9] | SPOONER C J, LESCH J, YAN D, KHAN A A, ABBAS A, RAMIREZ-CARROZZI V, et al. Specification of type 2 innate lymphocytes by the transcriptional determinant Gfi-1[J]. Nat Immunol, 2013, 14: 1229–1236. DOI: 10.1038/ni.2743 |
| [10] | KAZANJIAN A, GROSS E A, GRIMES H L. The growth factor independence-1 transcription factor:New functions and new insights[J]. Crit Rev Oncol Hematol, 2006, 59: 85–97. DOI: 10.1016/j.critrevonc.2006.02.002 |
 2017, Vol. 38
2017, Vol. 38


