强直性脊柱炎(ankylosing spondyliyis, AS)是一种以骶髂关节炎、肌腱端炎和脊柱炎为特点的慢性炎性疾病[1],目前我国约有400万AS患者[2]。2014年由美国风湿病学会/美国脊柱炎协会/脊柱关节炎研究和治疗网络(ACR/SAA/SPARTAN)联合制定的中轴脊柱关节炎(axial-spondyloarthritis, ax-SpA)指南中将非甾类抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)列为AS的一线治疗药物,而对NSAIDs治疗效果不佳的患者则推荐使用肿瘤坏死因子α(tumor necrosis factor α, TNF-α)抑制剂[3]。除外周关节受累可以使用柳氮磺吡啶外,并不推荐使用甲氨蝶呤(methotrexate,MTX)、来氟米特等传统慢作用药物[3]。
TNF受体融合蛋白是一种通过DNA重组技术将人IgG1的Fc段和TNF的受体蛋白进行融合而形成的生物制剂[4],能有效抑制TNF引起的炎症反应。国外已有研究表明其长期应用治疗AS具有良好的疗效和安全性[5-6]。但就我国临床实际而言,TNF抑制剂价格昂贵,大多数患者难以承受长期使用所带来的经济负担[7]。
对类风湿关节炎(rheumatoid arthritis,RA)的治疗学研究表明,MTX作为治疗RA的一线药物,其对RA患者治疗效果不佳时联合使用TNF抑制剂的效果明显优于单独使用TNF抑制剂[8]。对AS的治疗亦已表明,持续使用NSAIDs治疗不仅可以有效控制疾病活动度,还可延缓骨赘的形成[9]。因此,对于NSAIDs治疗反应不佳的AS患者可考虑采用TNF抑制剂联合持续使用NSAIDs治疗,但在治疗时停用TNF抑制剂后疾病复发的情况及哪些因素在病情的复发中起主要作用尚不明确。本研究观察了NSAIDs治疗效果不佳的ax-SpA患者使用TNF抑制剂依那西普(etanercept, ETN)治疗12周并同时联合持续使用NSAIDs至48周时疾病的复发率,并对影响维持疾病缓解的因素进行分析和探讨。
1 资料和方法 1.1 研究对象纳入2012年1月至2014年6月第二军医大学长海医院风湿免疫科收治的NSAIDs治疗无效或效果不佳的150例ax-SpA患者。其中128例为符合1984年修订的AS纽约分类标准[10]的AS患者,22例为符合2010年强直性脊柱炎评估工作组和欧洲抗风湿病联盟(ASAS/EULAR)分类标准[11]的无放射学改变脊柱关节病(non-radiographic spondyloarthritis, nr-SpA)患者。研究过程中有16例患者因有生育要求退出,有9例失访。最后完成观察的病例数为125例,其中AS患者111例、nr-SpA患者14例。所有患者均签署知情同意书。
1.2 治疗方法所有患者均在第1~12周接受ETN(商品名:恩利;辉瑞公司;批准文号:进口药品注册证号S20120006)治疗,50 mg/周,每周1次,皮下注射。随后每12周随访1次。对治疗效果不佳的患者继续保留使用NSAIDs,且不改变种类和剂量。研究中使用双氯芬酸钠的患者79例,剂量为75 mg/d;使用塞来昔布的患者46例,剂量为200 mg/d。随访期间所有患者继续维持原有NSAIDs,但不使用任何糖皮质激素、改善病情抗风湿药(DMARD)以及细胞毒药物。
1.3 疗效评价观察期为0~48周。(1)基线期(第0周)记录患者年龄、性别等一般情况及病程、骶髂关节炎X线分级、脊柱椎体骨赘形成例数;(2)第0、12、24、36、48周观察患者的Bath AS疾病活动指数(BASDAI)[12]、Bath AS功能指数(BASFI)[13]及红细胞沉降率(erythrocyte sedimentation rate,ESR)、C-反应蛋白(C-reactive protein,CRP);(3)无复发的患者在第48周结束观察,复发患者则在复发时结束观察,记录患者用药时长、达到临床缓解的时间、复发时间、缓解维持的时间;(4)记录随访过程中的所有不良反应。临床缓解的定义为:BASDAI≤4分、BASFI≤2分、CRP≤10 mg/L且ESR≤15 mm/1 h (男性)或20 mm/1 h (女性)[14];复发的定义为:BASDAI>4分、BASFI>2分、CRP>10 mg/L或ESR>15 mm/1 h(男性)或20 mm/1 h(女性)。
1.4 统计学处理应用SPSS 21.0软件进行数据分析。计量资料以x±s表示,两组间比较采用两独立样本的方差分析;计数资料计算构成比,两组间比较采用非参数检验(Mann-Whitney U检验)。采用四格表χ2检验计算病例-对照研究的比值比(OR),采用二元logistic回归模型和Cox生存分析模型研究影响两组患者复发及维持缓解时间的危险因素。检验水准(α)为0.05。
2 结果 2.1 人口学特征125例ax-SpA患者的平均年龄为(28.1±8.8)岁,病程为(4.9±4.5)年,以男性为主(101/125,80.8%)。ETN治疗前28例(22.4%)患者已有骨赘形成;骶髂关节炎X线分级为3级者最为多见,1、2、3、4级患者所占百分比分别为0(0/125)、22.4%(28/125)、46.4%(58/125)及20.0%(25/125),另有14例(11.2%)因无相关资料而无法分级。患者的基线BASDAI、BASFI、CRP及ESR分别为5.9±1.3、3.6±1.7、(38.1±37.3)mg/L及(42.5±23.2)mm/1 h。
2.2 疗效与不良反应经12周的ETN治疗后,120例(96.0%)患者可达到临床缓解。0~12周(ETN治疗期)患者的BASDAI、BASFI、CRP及ESR下降最快,与基线值相比其下降率分别为44.1%、32.4%、77.8%、78.8%(P<0.05,图 1);随后下降趋于平缓,第12~48周(NSAIDs维持阶段)患者的BASDAI、BASFI、CRP及ESR下降率分别为22.9%、26.6%、72.0%、45.7%(图 1)。治疗期间有3例患者发生轻度不良反应,分别为转氨酶升高、血小板减少及甲状腺功能减退,但无法判定上述不良事件与用药相关。在0~48周的观察期中,29例(23.2%)患者出现复发,临床缓解维持时间平均为(36.8±12.3)周。
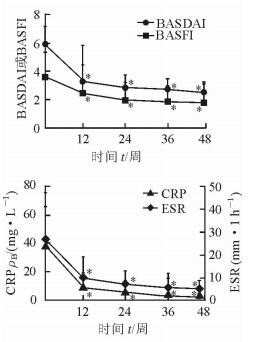
|
图 1 依那西普治疗12周后患者BASDAI、BASFI、CRP及ESR的变化 BASDAI: Bath强直性脊柱炎病情活动指数; BASFI: Bath强直性脊柱炎功能指数; CRP: C-反应蛋白; ESR:红细胞沉降率. *P<0.05与0周时比较. n=125,x±s |
2.3 复发危险因素分析
ENT治疗12周后,120例(96.0%)患者达到临床缓解;观察期内所有患者均达到过临床缓解。随访至第24周,复发率为13.6%(17/125),至第36周为20.8%(26/125),至48周为23.2%(29/125)。二元logistic回归模型分析发现,骨赘形成是ETN停药后复发的危险因素;进一步采用χ2检验发现,ETN用药前已有骨赘形成患者的复发风险比尚无骨赘形成的患者高(OR=70, P<0.001);而年龄、性别、病程、达临床缓解所用时间、是否发生不良反应、基线BASDAI、基线BASFI、基线CRP、基线ESR、骶髂关节破坏等因素与ETN停药后复发无相关性(表 1)。
|
|
表 1 停用依那西普后ax-SpA复发的危险因素(二元logistic回归分析) |
Cox生存模型(图 2)分析发现,骶髂关节炎X线分级越高,停用ETN后维持缓解的时间越短(排除14例无法分级的患者)。第48周时,骶髂关节炎X线分级2、3、4级的患者复发率分别为3.6%、15.5%、76.0%。此外,该模型同样发现骨赘形成能够影响ax-SpA患者停用ETN后维持缓解期的长短(OR=8.77,P=0.006)。

|
图 2 不同骶髂关节炎X线分级的患者在0~48周随访期间的无复发生存曲线 |
3 讨论
本研究中125例ax-SpA患者以青年男性为主,ETN治疗前22.4%(28例)的患者已有骨赘形成,骶髂关节炎X线分级为3级者最为多见(58例,46.4%),均与既往研究一致[15-16]。国外有研究提示,临床部分缓解和撤药时CRP正常对于AS患者撤药后长期维持缓解具有良好的预测意义[17]。而国内的一项研究则表明,疾病活动度、炎症指标和髋关节受累是AS患者复发的危险因素[18]。本研究通过二元logistic回归模型分析发现,骨赘形成可能是高复发率的危险因素,年龄、性别、病程、基线BASDAI、基线BASFI、基线CRP、基线ESR等因素则与复发无相关性,与既往研究并不一致的原因可能是与研究纳入标准及设计方案的不同有关。此外,本研究通过Cox生存模型分析发现,骶髂关节炎X线分级越高,缓解期维持时间越短;且在该模型下,同样发现骨赘形成可能是维持缓解的重要影响因素(OR=8.77,P=0.006)。骨赘形成是脊柱关节炎的典型特征,表明脊柱关节炎在炎症环境下不仅存在破骨活动,成骨活性也被大大激活,因此在临床治疗中可能需要适当延长ETN的使用时间以防疾病复发。骶髂关节炎X线分级可体现疾病的进展情况,分级高表示存在关节融合、强直等表现,且疾病已进展到中晚期;高X线分级患者短期使用ETN复发率高,因此在撤药过程中需要更加谨慎。
ETN是经典的TNF-α受体融合蛋白,属于TNF抑制剂,其疗效和安全性已得到临床试验证实[15-16]。与其他TNF抑制剂相比,ETN的半衰期短(5 d)、起效迅速(2~4周)[19],也不易产生抗药抗体[20]。当传统NSAIDs治疗无法控制病情时,ETN是重度活动性AS患者很好的选择之一。本研究发现,ETN可以迅速缓解AS患者的症状,12周内96.0%的患者能达到缓解,观察期内所有患者均达到临床缓解。BASDAI、BASFI、CRP及ESR在0~12周下降迅速,且在第12~48周仍保持继续下降的趋势,说明在保留NSAIDs的情况下ETN可使大部分患者快速达到缓解并维持。在安全性方面,ETN最常见的不良反应为注射部位反应(10%)和上呼吸道感染(14%),很少发生严重不良反应(4%)[21]。本研究中仅有3例出现轻度不良反应,分别为转氨酶升高、血小板减少及甲状腺功能减退,且无法判定是否与ETN治疗相关,初步表明ETN联合应用NSAIDs治疗是安全有效的。
TNF抑制剂对于ax-SpA而言有效却昂贵,很多患者没有长期使用的条件,如何撤药成为了困扰学者们的难题,在临床探索性撤药过程中不少患者遭遇了疾病复发,使得后续治疗方案的制定更加棘手。德国一项研究表明,ETN治疗1年后撤药,69%的AS患者在第2年内复发,与柳氮磺吡啶治疗的复发率(75%)相比没有明显优势[22]。此外,英夫利昔单抗、阿达木单抗等单抗类TNF抑制剂停药1年后的复发率也很高,可分别达97.6%和83%[17, 23]。本研究使用短期(12周)ETN治疗联合持续使用NSAIDs的方法,发现患者在第24、36、48周的复发率分别为13.6%(17/125)、20.8%(26/125)、23.2%(29/125),低于国外相关研究,推测可能与联用NSAIDs有关。NSAIDs是ax-SpA治疗的一线药物,有助于预防疾病复发。Cochrane系统回顾也表明,持续使用NSAIDs在控制疾病活动度的同时还可能延缓脊柱的影像学进展[24]。NSAIDs的作用靶点与TNF抑制剂不同,可能在维持ETN所达到的临床缓解、防止病情复发时同样发挥一定作用。此外,本研究表明骨赘形成是ax-SpA复发的危险因素,提示联用NSAIDs可能在降低复发风险上具有一定的优势。
综上所述,TNF抑制剂联合NSAIDs治疗ax-SpA的复发率低、不良反应少,可考虑作为临床用药推广应用,但具体使用价值尚待进一步研究。本研究人群样本量较小、观察时间较短,因此还需进一步的研究加以验证。
| [1] | BURGOS-VARGAS R. Spondyloarthritis:from undifferentiated SpA to ankylosing spondylitis[J]. Nat Rev Rheumatol, 2013, 9: 639–641. DOI: 10.1038/nrrheum.2013.146 |
| [2] | RONG J, JIERUO G. Spondyloarthritis in China[J]. Curr Opin Rheumatol, 2013, 25: 460–467. DOI: 10.1097/BOR.0b013e3283621b8c |
| [3] | WARD M M. Update on the American College of Rheumatology/Spondyloarthritis Research and Treatment Network/Spondylitis Association of America Axial Spondyloarhtritis Treatment Guidelines Project[J]. Clin Rheumatol, 2014, 33: 739–740. DOI: 10.1007/s10067-014-2660-9 |
| [4] | SCOTT L J. Etanercept:a review of its use in autoimmune inflammatory diseases[J]. Drugs, 2014, 74: 1379–1410. DOI: 10.1007/s40265-014-0258-9 |
| [5] | ESCUDERO-VILAPLANA V, RAMÍREZ-HERRÁIZ E, ALAÑÍN-PLAZA E, TROVATO-LÍPEZ N, GARCÍA-VICUÑA R, CARREÑO-PÉREZ L, et al. Efficiency of adalimumab, etanercept and infliximab in ankylosing spondylitis in clinical practice[J]. Int J Clin Pharm, 2015, 37: 808–814. DOI: 10.1007/s11096-015-0124-1 |
| [6] | MAXWELL L J, ZOCHLING J, BOONEN A, SINGH J A, VERAS M M, TANJONG GHOGOMU E, et al. TNF-α inhibitors for ankylosing spondylitis[J/CD]. Cochrane Database Syst Rev, 2015, 18:CD005468. doi:10.1002/14651858.CD005468.pub2. |
| [7] | GAUJOUX-VIALA C, FAUTREL B. Cost effectiveness of therapeutic interventions in ankylosing spondylitis:a critical and systematic review[J]. Pharmacoeconomics, 2012, 30: 1145–1156. DOI: 10.2165/11596490-000000000-00000 |
| [8] | SMOLEN J S, LANDEWÉ R, BIJLSMA J, BURMESTER G, CHATZIDIONYSIOU K, DOUGADOS M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs:2016 update[J]. Ann Rheum Dis, 2017, 76: 960–977. DOI: 10.1136/annrheumdis-2016-210715 |
| [9] | SIEPER J, PODDUBNYY D. Inflammation, new bone formation and treatment options in axial spondyloarthritis[J]. Ann Rheum Dis, 2014, 73: 1439–1441. DOI: 10.1136/annrheumdis-2014-205464 |
| [10] | VAN DER LINDEN S, VALKENBURG H A, CATS A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria[J]. Arthritis Rheum, 1984, 27: 361–368. DOI: 10.1002/(ISSN)1529-0131 |
| [11] | RUDWALEIT M, VAN DER HEIJDE D, LANDEWÉ R, AKKOC N, BRANDT J, CHOU C T, et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general[J]. Ann Rheum Dis, 2011, 70: 25–31. DOI: 10.1136/ard.2010.133645 |
| [12] | GARRETT S, JENKINSON T, KENNEDY L G, WHITELOCK H, GAISFORD P, CALIN A. A new approach to defining disease status in ankylosing spondylitis:the Bath Ankylosing Spondylitis Disease Activity Index[J]. J Rheumatol, 1994, 21: 2286–2291. |
| [13] | CALIN A, GARRETT S, WHITELOCK H, KENNEDY L G, O'HEA J, MALLORIE P, et al. A new approach to defining functional ability in ankylosing spondylitis:the development of the Bath Ankylosing Spondylitis Functional Index[J]. J Rheumatol, 1994, 21: 2281–2285. |
| [14] | ANDERSON J J, BARON G, VAN DER HEIJDE D, FELSON D T, DOUGADOS M. Ankylosing spondylitis assessment group preliminary definition of short-term improvement in ankylosing spondylitis[J]. Arthritis Rheum, 2001, 44: 1876–1886. DOI: 10.1002/(ISSN)1529-0131 |
| [15] | NAVARRO-SARABIA F, FERNÁNDEZ-SUEIRO J L, TORRE-ALONSO J C, GRATACOS J, QUEIRO R, GONZALEZ C, et al. High-dose etanercept in ankylosing spondylitis:results of a 12-week randomized, double blind, controlled multicentre study (LOADET study)[J]. Rheumatology(Oxford), 2011, 50: 1828–1837. DOI: 10.1093/rheumatology/ker083 |
| [16] | BRANDT J, KHARIOUZOV A, LISTING J, HAIBEL H, SÖRENSEN H, GRASSNICKEL L, et al. Six-month results of a double-blind, placebo-controlled trial of etanercept treatment in patients with active ankylosing spondylitis[J]. Arthritis Rheum, 2003, 48: 1667–1675. DOI: 10.1002/art.v48:6 |
| [17] | BARALIAKOS X, LISTING J, BRANDT J, ZINK A, ALTEN R, BURMESTER G, et al. Clinical response to discontinuation of anti-TNF therapy in patients with ankylosing spondylitis after 3 years of continuous treatment with infliximab[J]. Arthritis Res Ther, 2005, 7: R439–R444. DOI: 10.1186/ar1693 |
| [18] | 谢红伟, 李娟, 吕卓, 高国华. 停用依那西普后强直性脊柱炎病情复发相关因素分析及骨灵汤对其病情复发的影响[J]. 热带医学杂志, 2010, 10: 637–639. |
| [19] | JINESH S. Pharmaceutical aspects of anti-inflammatory TNF-blocking drugs[J]. Inflammopharmacology, 2015, 23: 71–77. DOI: 10.1007/s10787-015-0229-0 |
| [20] | VINCENT F B, MORAND E F, MURPHY K, MACKAY F, MARIETTE X, MARCELLI C. Antidrug antibodies (ADAb) to tumour necrosis factor (TNF)-specific neutralising agents in chronic inflammatory diseases:a real issue, a clinical perspective[J]. Ann Rheum Dis, 2013, 72: 165–178. DOI: 10.1136/annrheumdis-2012-202545 |
| [21] | KERENSKY T A, GOTTLIEB A B, YANIV S, AU S C. Etanercept:efficacy and safety for approved indications[J]. Expert Opin Drug Saf, 2012, 11: 121–139. DOI: 10.1517/14740338.2012.633509 |
| [22] | SONG I H, ALTHOFF C E, HAIBEL H, HERMANN K G, PODDUBNYY D, LISTING J, et al. Frequency and duration of drug-free remission after 1 year of treatment with etanercept versus sulfasalazine in early axial spondyloarthritis:2 year data of the ESTHER trial[J]. Ann Rheum Dis, 2012, 71: 1212–1215. DOI: 10.1136/annrheumdis-2011-201010 |
| [23] | HAIBEL H, RUDWALEIT M, LISTING J, HELDMANN F, WONG R L, KUPPER H, et al. Efficacy of adalimumab in the treatment of axial spondylarthritis without radiographically defined sacroiliitis:results of a twelve-week randomized, double-blind, placebo-controlled trial followed by an open-label extension up to week fifty-two[J]. Arthritis Rheum, 2008, 58: 1981–1991. DOI: 10.1002/art.v58:7 |
| [24] | KROON F P, VAN DER BURG L R, RAMIRO S, LANDEWÉ R B, BUCHBINDER R, FALZON L, et al. Non-steroidal anti-inflammatory drugs (NSAIDs) for axial spondyloarthritis (ankylosing spondylitis and non-radiographic axial spondyloarthritis)[J/CD]. Cochrane Database Syst Rev, 2015, 7:CD010952. doi:10.1002/14651858.CD010952.pub2. |
 2017, Vol. 38
2017, Vol. 38


