目前袖状胃切除术因其良好的减重和糖尿病治疗效果在临床上得到了广泛应用[1]。研究认为袖状胃切除术后胃饥饿素(ghrelin)的下降可能是糖尿病缓解的重要机制之一[2]。胃饥饿素在生物体内有2种形式:辛酰化胃饥饿素(AG)和非辛酰化胃饥饿素(UAG)。目前对胃饥饿素的水平在糖耐量异常或糖尿病动物中的变化存在较大争议[3-5],而且关于袖状胃切除术后大鼠胃饥饿素变化与胰岛素抵抗状态改变关系的研究较少。在本实验中我们通过高脂高糖饲料喂养SD大鼠构建糖耐量异常肥胖大鼠模型,用稳态模型法评估大鼠糖耐量状态,用酶联免疫吸附实验(ELISA)检测大鼠空腹胰岛素(FINS)、AG、总胃饥饿素(TG)指标并计算AG/TG比值,探究大鼠术后AG、TG、AG/TG的变化以及糖尿病缓解情况,解释袖状胃切除术后胃饥饿素变化与糖耐量异常缓解的关系。
1 材料和方法 1.1 实验动物及材料健康的SPF级7~8周龄雄性SD大鼠25只,体质量159~208 g,购于第二军医大学实验动物中心[动物生产许可证号:SCXK(沪)2013-0016]。大鼠自由饮水,以普通饲料(第二军医大学实验动物中心提供)喂养1周后开始实验。研究所用高脂高糖饲料由50%普通饲料、25%熟猪油、20%蔗糖、5%淀粉构成。ELISA检测试剂盒购于美国Sigma公司。
1.2 实验分组及处理给予大鼠高脂高糖饲料喂养8个月后,通过稳态模型评估大鼠胰岛素抵抗情况,以胰岛素抵抗指数(HOMA-IR) 2.60作为分界值,共建成糖耐量受损肥胖大鼠模型24只。将24只大鼠随机分为手术组(n=14)和假手术组(n=10),手术组行袖状胃切除术,假手术组行开腹手术,两组手术时间及腹部切口大小基本一致。术后两组大鼠分别禁食禁水2 d,每天皮下注射葡萄糖生理盐水40 mL/只,之后恢复普通饲料喂养。
1.3 取材及生化指标检测分别在建模前、建模后、术后1个月和术后2个月时取大鼠尾静脉血测空腹血糖(FBG),取眶静脉血测量血清FINS、AG、TG (UAG+AG)。根据公式计算HOMA-IR:HOMA-IR=(FBG×FINS)/22.5。
1.4 统计学处理应用SPSS 19.0软件进行统计分析。计量数据用x±s表示,组间均数比较采用Student t检验;相关性分析采用直线回归分析。检验水准(α)为0.05。
2 结果 2.1 葡萄糖代谢的变化由表 1可见,与建模前比较,建模后大鼠体质量明显增加(P<0.01),FBG水平无明显变化,而FINS水平和HOMA-IR升高(P<0.01)。袖状胃切除术后手术组大鼠体质量、FINS水平和HOMA-IR较假手术组下降(P<0.01)。
|
|
表 1 各指标在不同时间点的变化 |
2.2 胃饥饿素的改变
与建模前比较,建模后大鼠AG增加、TG下降(P<0.01);袖状胃切除术后手术组AG、TG在第1个月和第2个月时均低于假手术组(P<0.01)。建模后AG/TG比值升高,袖状胃切除术后手术组AG/TG比值较假手术组下降(P<0.01)。见表 1。
2.3 相关性分析相关性分析表明,经过长时间高脂高糖饲料喂养后,大鼠AG与HOMA-IR之间存在正相关关系(r=0.707, P<0.01),而TG与HOMA-IR之间无相关关系。见图 1。
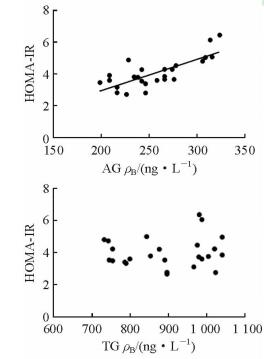
|
图 1 AG、TG与HOMA-IR的相关性分析 AG:辛酰化胃饥饿素;TG:总胃饥饿素;HHOMA-IR:胰岛素抵抗指数 |
3 讨论
研究表明AG可以通过生长激素促分泌素受体(GHS-R)促使大鼠产生胰岛素抵抗状态,而敲除GHS-R的小鼠经过高脂高糖饲料喂养后胰岛素抵抗情况与野生组相比明显下降[6]。AG在内脏脂肪中促进脂肪沉积,抑制脂肪分解,对于高脂高糖饮食后大鼠肥胖的形成有一定促进作用[7]。本实验中,大鼠经过高脂高糖饲料喂养后HOMA-IR增高,同时AG也增高,相关性分析表明两者存在线性相关关系,也支持该理论。另有一项研究表明,肥胖小鼠模型中产生了明显外周胃饥饿素抵抗,使胃饥饿素与饮食有关的周期性相关变化减弱,可能对于胰岛素抵抗以及糖尿病的发展也有促进作用[8]。本实验中建模后的大鼠可能也存在胃饥饿素抵抗:TG下降明显,AG增高,AG/TG比值也增高,AG相对过剩。相关性分析表明AG与大鼠胰岛素抵抗明显相关,而TG与胰岛素抵抗并无关系。外周循环中AG/TG的比值反映了胃饥饿素酰基转移酶(GOAT)活性,在高脂高糖饲料喂养后大鼠AG/TG比值增高,袖状胃切除术后AG/TG比值下降结合大鼠胰岛素敏感性变化说明GOAT可能也参与糖代谢的调节。
本研究中,袖状胃切除术后大鼠HOMA-IR下降,胰岛分泌减少,可能与许多因素有关,比如体质量下降、进食减少等。但是研究表明袖状胃切除术后缓解糖代谢改善发生于术后早期,此时尚无明显的体质量下降[2]。袖状胃切除术后胃饥饿素的下降可能在改善糖代谢中起到重要作用[9],如前所述,胃饥饿素,特别是AG增加胰岛素抵抗,促进糖尿病发病[10],袖状胃切除术切除大部分胃组织,使AG、TG下降,AG/TG比值都有一定程度的下降。其中AG作为胃饥饿素的活性形式,是胃饥饿素经过GOAT转化形成的,在袖状胃切除术后,胃饥饿素特别是AG始终处于较低水平,可能通过“超负抑制”来抑制GOAT的活性,降低AG以及AG/TG的值来缓解胰岛素抵抗状态[11]。这对于患者术后食欲下降以及2型糖尿病的改善有重要意义。
袖状胃切除术缓解肥胖和糖尿病与多种因素有关,胃饥饿素在其中扮演的角色目前也有许多争议,所以相关机制还值得我们进一步研究,为袖状胃切除术能够在临床上有更广泛的应用打下基础。
| [1] | ABBATINI F, RIZZELLO M, CASELLA G, ALESSANDRI G, CAPOCCIA D, LEONETTI F, et al. Long-term effects of laparoscopic sleeve gastrectomy, gastric bypass, and adjustable gastric banding on type 2 diabetes[J]. Surg Endosc, 2010, 24: 1005–1010. DOI: 10.1007/s00464-009-0715-9 |
| [2] | PETERLI R, WÖLNERHANSSEN B, PETERS T, DEVAUX N, KERN B, CHRISTOFFEL-COURTIN C, et al. Improvement in glucose metabolism after bariatric surgery:comparison of laparoscopic Roux-en-Y gastric bypass and laparoscopic sleeve gastrectomy:a prospective randomized trial[J]. Ann Surg, 2009, 250: 234–241. DOI: 10.1097/SLA.0b013e3181ae32e3 |
| [3] | MURAKAMI N, HAYASHIDA T, KUROIWA T, NAKAHARA K, IDA T, MONDAL M S, et al. Role for central ghrelin in food intake and secretion profile of stomach ghrelin in rats[J]. J Endocrinol, 2002, 174: 283–288. DOI: 10.1677/joe.0.1740283 |
| [4] | McLAUGHLIN T, ABBASI F, LAMENDOLA C, FRAYO R S, CUMMINGS D E. Plasma ghrelin concentrations are decreased in insulin-resistant obese adults relative to equally obese insulin-sensitive controls[J]. J Clin Endocrinol Metab, 2004, 89: 1630–1635. DOI: 10.1210/jc.2003-031572 |
| [5] | ARIYASU H, TAKAYA K, HOSODA H, IWAKURA H, EBIHARA K, MORI K, et al. Delayed short-term secretory regulation of ghrelin in obese animals:evidenced by a specific RIA for the active form of ghrelin[J]. Endocrinology, 2002, 143: 3341–3350. DOI: 10.1210/en.2002-220225 |
| [6] | LIN L, SAHA P K, MA X, HENSHAW I O, SHAO L, CHANG B H, et al. Ablation of ghrelin receptor reduces adiposity and improves insulin sensitivity during aging by regulating fat metabolism in white and brown adipose tissues[J]. Aging Cell, 2011, 10: 996–1010. DOI: 10.1111/acel.2011.10.issue-6 |
| [7] | DAVIES J S, KOTOKORPI P, ECCLES S R, BARNES S K, TOKARCZUK P F, ALLEN S K, et al. Ghrelin induces abdominal obesity via GHS-R-dependent lipid retention[J]. Mol Endocrinol, 2009, 23: 914–924. DOI: 10.1210/me.2008-0432 |
| [8] | NAZNIN F, TOSHINAI K, WAISE T M, NAMKOONG C, MD MOIN A S, SAKODA H, et al. Diet-induced obesity causes peripheral and central ghrelin resistance by promoting inflammation[J]. J Endocrinol, 2015, 226: 81–92. DOI: 10.1530/JOE-15-0139 |
| [9] | KADERA B E, PORTENIER D D, YURCISIN B M, DEMARIA E J, GADDOR M M, JAIN-SPANGLER K. Evidence for a metabolic mechanism in the improvement of type 2 diabetes after sleeve gastrectomy in a rodent model[J]. Surg Obes Relat Dis, 2013, 9: 447–452. DOI: 10.1016/j.soard.2012.12.007 |
| [10] | PULKKINEN L, UKKOLA O, KOLEHMAINEN M, UUSITUPA M. Ghrelin in diabetes and metabolic syndrome[J/OL]. Int J Pept, 2010, 2010. pii:248948. doi:10.1155/2010/248948. |
| [11] | CUMMINGS D E, OVERDUIN J, SHANNON M H, FOSTER-SCHUBERT K E. 2004 ABS Consensus Conference. Hormonal mechanisms of weight loss and diabetes resolution after bariatric surgery[J]. Surg Obes Relat Dis, 2005, 1: 358–368. DOI: 10.1016/j.soard.2005.03.208 |
 2017, Vol. 38
2017, Vol. 38


