2. 上海海洋大学食品学院海洋生物制药研究室, 上海 201306;
3. 解放军85医院口腔科, 上海 200052;
4. 第二军医大学药学院海洋药物研究中心, 上海 200433
2. Laboratory of Marine Biopharmaceutical Research, Food College, Shanghai Ocean University, Shanghai 201306, China;
3. Department of Stomatology, No. 85 Hospital of PLA, Shanghai 200052, China;
4. Research Center for Marine Drugs, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
引导骨再生(guided bone regeneration,GBR)是利用外科手术的方法在骨组织和上皮之间放置屏障膜,根据不同组织细胞向创口生长或移动的速度差异来选择性地阻挡上皮和成纤维细胞进入拟成骨的空间的一种技术[1]。其中屏障膜起到机械屏障、空间保护以及组织工程支架等作用,是该技术的关键。目前临床上常用的屏障膜种类繁多,主要分为不可吸收性膜和可吸收性膜两种。前者主要包括聚四氟乙烯膜、纯钛膜、多聚乙醛膜等,它们最大的缺点就是需要二次手术取出,增加了感染的风险;后者有胶原膜、聚羟基丁酸酯膜、高分子聚合物膜及载有生长因子的复合型膜等[2]。在可吸收性膜中,胶原膜作为应用最为广泛的生物材料之一,已被证实具有良好的生物相容性,植入体内后可形成纤维网状结构,该结构不仅有利于再生细胞的附着,而且还能抑制顶部上皮细胞的迁移,同时还具有一定的凝血作用,能促进组织的愈合[3]。但其作为组织工程再生材料,具有较低的机械强度以及较快的降解率等缺点[4]。
目前,国外应用最多的胶原膜为商品化的Bio-Gide膜,该膜组织相容性好,抗原性低,韧性强、易于操作,引导组织再生能力强,其主要成分为猪的Ⅰ型和Ⅲ型胶原蛋白[5]。但由于欧洲疯牛病、口蹄疫和禽流感等疾病的发生,人们对陆生哺乳动物胶原蛋白及其制品的安全性产生了质疑;另外,某些宗教地区的信仰问题也使陆生哺乳动物胶原蛋白的使用受到了限制[6]。基于此,水生生物便被考虑作为其重要的替代来源[7]。巴沙鱼(Pangasisus haniltoa)是一种东南亚特产淡水鱼类,原产于越南湄公河三角洲和泰国湄南河流域,资源丰富,加工过程中产生的下脚料如鱼皮、鱼肚、鱼鳍等数量巨大。本研究以巴沙鱼皮为原料制备膜状支架材料,并对其物理性能和降解率进行分析,探索巴沙鱼是否可以取代陆生哺乳动物成为胶原材料的合适来源。
1 材料和方法 1.1 主要材料、试剂和仪器市场采购的新鲜速冻巴沙鱼皮(南京味都食品有限公司)。Bio-Gide膜为瑞士Geistlich公司产品。硫酸铜、硫酸钾、浓硫酸、硼酸吸收液、甲基红-溴甲酚绿混合指示剂、0.1 mol/L的标准盐酸溶液、N-羟基琥珀酰亚胺(NHS)、无水乙醇、磷酸盐缓冲液(0.1 mol/L,pH 7.4;江苏强盛功能化工有限公司)。高效液相色谱(high performance liquid chromatography,HPLC)仪(LC-20A, SHIMADZU)、消化炉(X12A型,上海晟声自动化分析仪器有限公司)、半自动凯氏定氮仪(K1301,上海晟声自动化分析仪器有限公司)、万能材料试验机(Instron-5566,Instron)、数显黏度计(DV-Ⅱ+Pro,Brookfield)、低温冷却液循环泵(DLSB-30/10,上海吉众仪器有限公司)、恒温震荡箱(上海智城分析仪器制造有限公司)、电子显微镜(Carl Zeiss)。
1.2 材料的制备速冻巴沙鱼皮在常温下解冻后洗净风干至恒质量,称量后依次用0.1%的NaOH溶液和3%的H2O2溶液浸泡,用于脱色脱脂及去除部分杂蛋白。首次浸泡5 h,待H2O2几乎全被还原,取出鱼皮洗净,更换溶液继续浸泡,24 h后取出。取出后,先用自来水冲洗至中性,沥干水分,用适量洗洁精揉搓,再用自来水清洗。此过程重复5次。最后一次用自来水彻底冲洗干净。配置脱色液(甲醇:乙酸:水=250: 80: 670,体积比)再次进行脱脂、去杂蛋白处理。鱼皮置于脱色液中浸泡24 h后取出,冲洗至中性。沥干水分,用适量洗洁精清洗5次,再用蒸馏水清洗3次,清洗完毕后置于蒸馏水中浸泡12 h,以去除鱼皮中残留其他物质。整个过程重复3次。最后将鱼皮取出,沥干水分,铺盘冷冻干燥成膜,备用。
巴沙鱼皮胶原支架材料的热交联方法如下:将上述制备好的巴沙鱼胶原支架材料放置于真空干燥箱中,设置干燥箱温度为110 ℃,72 h后取出,即可完成交联。
1.3 材料的表征 1.3.1 粗蛋白含量的测定利用常量蒸馏凯氏定氮法(GB/T6432-94)对该材料进行粗蛋白含量的测定,即在有催化剂的条件下,用浓硫酸消化巴沙鱼胶原支架材料样品,将有机氮都转变成无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气蒸馏出来并用过量的硼酸液吸收,最后以0.05 mol/L的标准盐酸溶液进行滴定,滴定终点为溶液由蓝绿色变为灰红色。最终粗蛋白质含量按下式计算:粗蛋白质(%)=(V1-V0)×C×0.014 0×6.25×100/M,式中,V1为滴定试样时消耗的标准盐酸体积(mL),V0为滴定空白时消耗的标准盐酸体积(mL),C为标准盐酸溶液摩尔浓度(mol/L),M为试样的绝干物质质量(g),0.014 0为每毫克当量氮的克数,6.25为氮和蛋白质的换算系数。
1.3.2 氨基酸成分测定以异硫氰酸苯酯(PITC)为衍生剂,采用HPLC柱前衍生法对氨基酸组成进行分析[8]。取一定量的巴沙鱼皮胶原蛋白样品,转移至水解管中,加入1 mL 6 mol/L的盐酸,充入N2真空封管。于110 ℃条件下水解反应24 h。水解完全后,将溶液移至EP管中,抽真空浓缩至干。样品复溶后加入PITC衍生剂进行衍生反应,将衍生后的样品通过HPLC仪进行检测分析。
1.3.3 电镜观察将膜样品固定在导电胶上,表面喷金,利用电子显微镜观察其表面形态。
1.3.4 厚度、密度及孔隙率的测定利用游标卡尺测量胶原蛋白支架材料的厚度。采用液体置换法[9]测定聚合物的密度和孔隙率,具体方法如下:用无水乙醇作为置换液,将样品膜(质量记为W)浸没在装有乙醇(体积记为V1)的量筒中,置于超声震荡箱中震荡,使得乙醇全部进入孔隙中,直到膜表面没有气泡逸出(此时体积记为V2)。V2-V1即为膜材料的体积。将膜材料取出,记录剩余乙醇体积为V3,V1-V3即为膜孔隙的体积。膜材料+孔隙的总体积(V)=(V2-V1)+(V1-V3)=V2-V3,膜的密度(d)=W/(V2-V3),膜的孔隙率(e)=(V1-V3)/(V2-V3)×100%。测量分别重复3次,记录其平均值。
1.4 材料的机械性能测定将膜裁剪成一定大小的长条状,利用万能材料试验机测定材料的抗拉强度。以0.1 mm/s的速度进行拉伸,直至样品被破坏,记录此时的拉力大小。
1.5 材料的变性温度测定用酶提取胶原蛋白法从巴沙鱼皮中提取胶原蛋白,配制成6 mg/mL的溶液,用数显黏度计测定黏度值。测试时选用63号转子,转速为30 r/min。用低温冷却液循环泵控制温度依次从12 ℃上升至38 ℃,每上升2 ℃保持30 min并记数。胶原溶液相对黏度的计算公式[10]为:相对黏度值=[ηsp(T)-ηsp(40 ℃)]/[ηsp(12 ℃)-ηsp(40 ℃)],式中ηsp(T)代表某一温度下的黏度值。以温度为横坐标、相对黏度为纵坐标作图,绘制热变性温度曲线图。相对黏度值为0.5时所对应的温度即为其热变性温度。
1.6 材料的体外降解实验将材料(质量记为M0)置于37 ℃的磷酸盐缓冲液(0.1 mol/L,pH 7.4)中,确保整个胶原膜材料完全浸入,并置于37 ℃的恒温震荡箱中。在预定的时间回收样品,用蒸馏水洗净并冻干(-50 ℃,24 h),测定材料的吸水率、失重率和缓冲液的pH值。
吸水率:分别在1、8、24和48 h时将材料取出,用滤纸吸去表面水分,电子天平称其湿润状态下质量,记为M1。按如下公式计算:吸水率(%)=(M1-M0)/M0×100%。
失重率:在7、14、21和28 d时取出材料,在冻干机中冻干,电子天平称其质量,记为M2。失重率按如下公式计算:失重率(%)=(M0-M2)/M0×100%。
缓冲液pH值:在体外降解实验期间利用电子pH计测量缓冲液的pH值,测试期间不更换容器内液体。
1.7 统计学处理采用SPSS 21.0软件进行统计学分析,数据以x±s表示,组间比较采用方差分析或两独立样本均数比较的t检验。检验水准(α)为0.05。
2 结果 2.1 材料的蛋白含量和氨基酸组成经半微量凯氏定氮法测得巴沙鱼胶原支架材料的粗蛋白含量为(95.15±1.57)%。巴沙鱼皮胶原氨基酸成分中,甘氨酸的含量最高,占所有氨基酸成分的40.34%;脯氨酸和羟脯氨酸作为胶原蛋白的特征氨基酸,含量也较高,分别占15.74%和10.66%(表 1)。
|
|
表 1 巴沙鱼皮胶原蛋白支架材料的氨基酸成分 Tab 1 Amino acid of the collagen scaffoldmaterial from Basa fish skin |
2.2 材料的胶原膜结构特征
扫描电镜照片显示,该胶原蛋白支架材料的一面较为粗糙,可见多孔结构,孔径大小不一,孔与孔之间相互通连,分布较为均匀;另一面则比较光滑,孔隙致密(图 1)。利用游标卡尺,经过5次重复测量,测得该胶原蛋白支架材料的厚度为(0.66±0.10) mm。利用液体置换法,经5次重复测量,测得孔隙率为(55.50±1.94)%。
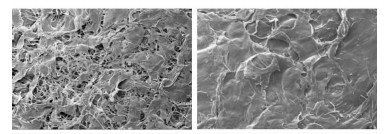
|
图 1 巴沙鱼皮胶原膜2个面的扫描电镜图片 Fig 1 SEM photographs of the two sides ofthe collagen membrane from Basa fish skin Original magnification: ×200 |
2.3 材料的机械强度
未经热交联处理的巴沙鱼胶原材料的抗拉强度为(10.03±0.96) MPa;经热交联处理后,强度可升高至(18.83±0.96) MPa,与未经处理的材料相比差异有统计学意义(P < 0.05)。
2.4 材料的变性温度蛋白质变性会引起其黏度改变, 在某一温度范围内, 其黏度值变化迅速,形成明显拐点,这一范围中间值即为蛋白变性温度。对未经热交联处理的巴沙鱼胶原支架材料测定,当温度升高至33 ℃时,黏度值变小明显,在33~35 ℃之间黏度值的变化形成了一个拐点,因此我们可以得出其变性温度约为34 ℃。同样的方法,测得经热交联处理后的巴沙鱼胶原蛋白支架材料的变性温度为35 ℃(图 2A),比未经热交联处理的材料略有升高。

|
图 2 巴沙鱼胶原支架材料黏度变化及体外降解情况 Fig 2 Changes of viscosity and in vitro degradation of the collagen scaffold material from Basa fish skin A: Changes of the viscosity; B: Changes of the water absorption; C: Changes of the weight loss rate; D: Changes of the pH value of buffer. *P < 0.05 vs Bio-Gide collagen membrane; △P < 0.05 vs untreated material. n=3, x±s |
2.5 材料的降解率
测定未经热交联的巴沙鱼皮胶原膜和Bio-Gide胶原膜的吸水率,结果发现在每个时间节点下,巴沙鱼皮胶原膜的吸水率都比Bio-Gide胶原膜高(P < 0.05),约为其2倍(图 2B)。记录经过热交联处理和未经热交联处理的巴沙鱼胶原支架材料在降解过程中的失重情况和缓冲液pH变化值,可见未经交联的样品降解速率较快,7 d时失重率已经达到(83.37±4.66)%,2周左右便可全部降解完;经热交联处理过的样品降解速率减缓,7 d时的失重率为(13.49±2.46)%,此后大致以匀速降解,28 d时失重率达到(80.22±2.49)%(图 2C)。两种样品降解过程中缓冲液的pH均呈下降趋势,28 d时热交联处理过的材料pH降为6.67±0.05,未经交联处理的材料pH降至5.81±0.23,7~28 d两种材料间pH值差异有统计学意义(P < 0.05,图 2D)。
3 讨论本研究利用巴沙鱼皮制备了一种膜状支架材料。测得该材料中的粗蛋白含量为(95.15±1.57)%,纯度较高。氨基酸成分的检测结果显示,该胶原蛋白材料的甘氨酸占比最高,与陆生哺乳动物[11-15]类似。另外巴沙鱼皮胶原蛋白的羟脯氨酸和脯氨酸含量之和为26.40%,有文献报道小牛的脯氨酸和羟脯氨酸总量为23.2%,而鳕鱼皮只有15.5%[16]。羟脯氨酸和脯氨酸作为胶原蛋白的特征氨基酸,其含量高说明巴沙鱼皮可作为优质的胶原蛋白来源;同时,羟脯氨酸的含量越高,胶原的三螺旋结构越稳定,表明胶原的稳定性越好。
由扫描电镜结果可知,该膜材料呈双层结构,其中一面粗糙,可见多孔样结构,孔与孔之间相互通连,孔隙率为(55.50±1.94)%。孔隙结构可增大支架材料的表面积,并可在一定程度上阻止软组织长入骨组织,起到物理屏障作用。同时由于孔隙间彼此相通,有利于局部血液循环,为细胞在其表面黏附和生长提供良好的条件,为骨缺损部位细胞生长提供营养和适宜的环境。研究表明,孔径的大小决定了细胞植入的效率[17]。因此,当材料具备相互通连的孔隙结构,且具有一定孔隙率时,可与宿主组织产生理想的交互作用[18]。该材料的另一面致密,无明显的孔隙,在应用于GBR中时,该面与皮肤等软组织接触,可有效防止结缔组织等过快长入骨缺损区域。Bio-Gide生物膜厚约2 mm,吸水膨胀后迅速变软,空间维持能力较差,常并发局部黏膜瓣裂开、早期暴露等现象,易发生感染,影响植骨区骨生成量,甚至导致骨吸收[19]。我们制备的巴沙鱼皮支架材料厚(0.66±0.10) mm,厚薄均匀,吸水膨胀变形程度小,且具有较高的机械强度,经热交联处理后抗拉强度可达(18.83±0.96) MPa,遇水未见明显变软,说明其空间维持能力较好。
该支架材料的变性温度为34 ℃,经过热交联后为35 ℃,略有升高。张玲等[20]报道猪皮胶原热变性温度为38 ℃,陆生哺乳动物由于生存环境温度差较大,致使其胶原的耐受温度更强。而鱼类胶原的变性温度普遍相对较低(低于37 ℃),胡建平等[21]曾报道鲢鱼、鲫鱼、草鱼、鲤鱼鱼鳞胶原的变性温度分别为26、23、22、24 ℃,与本研究中所探究的巴沙鱼皮胶原蛋白的变性温度相比要低很多。环境的pH也是影响材料变性与否的重要因素,过酸或过碱的环境均会导致材料的变性。本实验发现在材料降解过程中,缓冲液的pH值均匀缓慢降低,并最终趋于稳定。热交联过的材料缓冲液pH值稳定在6.7左右,并未出现明显的变性。
该支架材料的吸水率较Bio-Gide胶原膜高,约为其2倍,且肉眼观察吸水膨胀程度极小。较高的吸水率进一步说明孔隙之间的通连性好,在GBR过程中可满足血液等营养物质的交换以及代谢产物的运输等需要。
可吸收支架材料应设计成与周围组织整合后可被再生的细胞外基质所完全替代,这样可避免二次取出的风险[22]。因此,在引导骨组织再生支架材料的设计中,具有合适的降解率是一项重要的因素[23]。理想情况下,支架材料应具有与骨组织生成速率相匹配的降解率,并能在3个月左右逐渐被新骨所取代[24]。本实验测得的未经热交联处理的巴沙鱼皮胶原支架材料2周内即可完全降解,而经过热交联处理后的材料可维持1个月以上。有文献报道一种用热带淡水鱼鱼鳞所制成的胶原支架材料4 d即可完全降解[25]。Bio-Gide膜的降解率通常为4~6个月[19]。生物膜降解速率过快会导致膜结构破坏,其力学性能下降导致骨缺损处空间维持能力下降,同时大量的降解产物快速进入机体,会对骨组织的再生造成不利的影响;如果生物膜降解速率过慢,材料长期置于体内会引起机体的不良反应。对于引导骨组织再生支架材料的降解速率,目前大多数学者认为其在体内存留的时间应与骨再生修复的时间相一致,至少维持3个月以上。Hutmacher等[26]认为,在创口愈合早期生物膜必须保持其结构的完整性。Carpio等[27]认为骨细胞增殖、分化及上皮细胞成熟,需要生物膜的结构完整性至少维持6周以上。因此就巴沙鱼皮材料降解性方面有待继续研究。
综合以上实验结果可以得出,巴沙鱼胶原支架材料可能具备良好的物理屏障作用,同时具有良好的理化性能和良好的空间维持能力。但该胶原支架材料存在体外降解速率较快的缺点,4周时的降解失重率过高,降解时间明显短于组织再生的时间,这些问题尚有待进一步研究。
| [1] | BUSER D, DULA K, BELSER U, HIRT H P, BERTHOLD H. Localized ridge augmentation using guided bone regeneration. 1. Surgical procedure in themaxilla[J]. Int J Periodontics Restorative Dent, 1993, 13: 29–45. |
| [2] | WON J Y, PARK C Y, BAE J H, AHN G, KIM C, LIM D H, et al. Evaluation of 3D printed PCL/PLGA/β-TCP versus collagen membranes for guided bone regeneration in a beagle implant model[J]. Biomed Mater, 2016, 11: 055013. DOI: 10.1088/1748-6041/11/5/055013 |
| [3] | ZEUGOLISA D I, PAUL R G, ATTENBURROWD G. The influence of a natural cross-linking agent (Myrica rubra) on the properties of extruded collagen fibres for tissue engineering applications[J]. Mater Sci Eng C, 2010, 30: 190–195. DOI: 10.1016/j.msec.2009.09.017 |
| [4] | KOIDE T, TAKAHARA Y, ASADA S, NAGATA K. Xaa-Arg-Gly triplets in the collagen triple helix are dominant binding sites for the molecular chaperone HSP47[J]. J Biol Chem, 2002, 277: 6178–6182. DOI: 10.1074/jbc.M106497200 |
| [5] | SILVA E C, OMONTE S V, MARTINS A G, DE CASTRO H H, GOMES H E, ZENÓBIO É G, et al. Hyaluronic acid on collagen membranes:an experimental study in rats[J]. Arch Oral Biol, 2017, 73: 214–222. DOI: 10.1016/j.archoralbio.2016.10.016 |
| [6] | PAL G K, SURESH P V. Microbial collagenases:challenges and prospects in production and potential applications in food and nutrition[J]. RSC Adv, 2016, 6: 33763–33780. DOI: 10.1039/C5RA23316J |
| [7] | PAL G K, SURESH P V. Sustainable valorisation of seafood by-products:recovery of collagen and development of collagen-based novel functional food ingredients[J]. Innov Food Sci Emerg Technol, 2016, 37: 201–215. DOI: 10.1016/j.ifset.2016.03.015 |
| [8] | 李爽, 陈启, 蔡明明, 任一平. 液相色谱法与氨基酸分析仪法测定人乳中水解氨基酸的比较研究[J]. 食品安全质量检测学报, 2014, 5: 2073–2079. |
| [9] | WAN Y, CAO X, WU Q, ZHANG S, WANG S. Preparation and mechanical properties of poly (chitosan-g-DL-lactic acid) fibrous mesh scaffolds[J]. Polym Adv Technol, 2007, 19: 114–123. |
| [10] | VEERURAJ A, ARUMUGAM M, AJITHKUMAR T, BALASUBRAMANIAN T. Isolation and characterization of drug delivering potential of type-Ⅰ collagen from eel fish Evenchelys macrura[J]. J Mater Sci Mater Med, 2012, 23: 1729–1738. DOI: 10.1007/s10856-012-4650-2 |
| [11] | KIMURA S. Vertebrate skin type Ⅰ collagen:comparison of bony fishes with lamprey and calf[J]. Comp Biochem Physiol B, 1983, 74: 525–528. DOI: 10.1016/0300-9629(83)90542-X |
| [12] | KIMURA S, ZHU X P, MATSUI R, SHIJOH M, TAKAMIZAWA S. Characterization of fish muscle type Ⅰ collagen[J]. J Food Sci, 1988, 53: 1315–1318. DOI: 10.1111/jfds.1988.53.issue-5 |
| [13] | NAGAI T, YAMASHITA E, TANIGUCHI K, KANAMORI N, SUZUKI N. Isolation and characterisation of collagen from the outer skin waste material of cuttlefish (Sepia lycidas)[J]. Food Chem, 2001, 72: 425–429. DOI: 10.1016/S0308-8146(00)00249-1 |
| [14] | NAGAI N, YUNOKI S, SUZUKI T, SAKATA M, TAJIMA K, MUNEKATA M. Application of cross-linked salmon atelocollagen to the scaffold of human periodontal ligament cells[J]. J Biosci Bioeng, 2004, 97: 389–394. DOI: 10.1016/S1389-1723(04)70224-8 |
| [15] | BAE I, OSATOMI K, YOSHIDA A, OSAKO K, YAMAGUCHI A, HARA K. Biochemical properties of acid-soluble collagens extracted from the skins of underutilized fishes[J]. Food Chem, 2008, 108: 49–54. DOI: 10.1016/j.foodchem.2007.10.039 |
| [16] | 李卫林, 曹健, 汤克勇, 左锦静, 王岩. 胶原蛋白结构和稳定性关系研究[J]. 中国皮革, 2005, 34: 14–16. |
| [17] | O'BRIEN F J, HARLEY B A, YANNAS I V, GIBSON L J. The effect of pore size on cell adhesion in collagen-GAG scaffolds[J]. Biomaterials, 2005, 26: 433–441. DOI: 10.1016/j.biomaterials.2004.02.052 |
| [18] | FREYMAN T M, YANNAS I V, GIBSON L J. Cellular materials as porous scaffolds for tissue engineering[J]. Prog Mater Sci, 2001, 46(3/4): 273–282. |
| [19] | LEKOVIC V, CAMARGO P M, WEINLAENDER M, VASILIC N, ALEKSIC Z, KENNEY E B. Effectiveness of a combination of platelet-rich plasma, bovine porous bone mineral and guided tissue regeneration in the treatment of mandibular grade Ⅱ molar furcations in humans[J]. J Clin Periodontol, 2003, 30: 746–751. DOI: 10.1034/j.1600-051X.2003.00368.x |
| [20] | 张玲, 芮汉明, 张立彦. 酶法提取猪皮胶原及产物性质分析[J]. 食品科学, 2013, 34: 123–127. |
| [21] | 胡建平. 不同鱼鳞胶原蛋白黏度特性研究[J]. 食品工业科技, 2010, 31: 135–139. |
| [22] | SUNG H J, MEREDITH C, JOHNSON C, GALIS Z S. The effect of scaffold degradation rate on three-dimensional cell growth and angiogenesis[J]. Biomaterials, 2004, 25: 5735–5742. DOI: 10.1016/j.biomaterials.2004.01.066 |
| [23] | LIU Y S, HUANG Q L, KIENZLE A, MÜLLER W E, FENG Q L. In vitro degradation of porous PLLA/pearl powder composite scaffolds[J]. Mater Sci Eng C Mater Biol Appl, 2014, 38: 227–234. DOI: 10.1016/j.msec.2014.02.007 |
| [24] | JIANG T, NUKAVARAPU S P, DENG M, JABBARZADEH E, KOFRON M D, DOTY S B, et al. Chitosan-poly (lactide-co-glycolide) microsphere-based scaffolds for bone tissue engineering:in vitro degradation and in vivo bone regeneration studies[J]. Acta Biomater, 2010, 6: 3457–3570. DOI: 10.1016/j.actbio.2010.03.023 |
| [25] | PATI F, DATTA P, ADHIKARI B, DHARA S, GHOSH K, DAS MOHAPATRA P K. Collagen scaffolds derived from fresh water fish origin and their biocompatibility[J]. J Biomed Mater Res A, 2012, 100: 1068–1079. |
| [26] | HUTMACHER D, HÜRZELER M B, SCHLIEPHAKE H. A review of material properties of biodegradable and bioresorbable polymers and devices for GTR and GBR applications[J]. Int J Oral Maxillofac Implants, 1996, 11: 667–678. |
| [27] | CARPIO L, LOZA J, LYNCH S, GENCO R. Guided bone regeneration around endosseous implants with anorganic bovine bone mineral. A randomized controlled trial comparing bioabsorbable versus non-resorbable barriers[J]. J Periodontol, 2000, 71: 1743–1749. DOI: 10.1902/jop.2000.71.11.1743 |
 2017, Vol. 38
2017, Vol. 38


