国际尿控协会将膀胱过度活动症(overactive bladder, OAB)定义为尿频、尿急、夜尿伴或不伴有急迫性尿失禁[1]。据统计,在美国和欧洲大约有16%的成年人受到不同程度的OAB症状困扰,其中男性和女性的发病率基本相当[2-3]。OAB患者尿动力学参数改变的典型表现为储尿期逼尿肌的不自主收缩并可伴有尿失禁的发生,部分患者排尿后残余尿量增多[4-5]。
OAB的发病机制目前尚无定论,治疗上缺乏理想的针对病因且不良反应小的药物疗法。研究表明,组胺通过H1型受体调节骶髓兴奋性的谷氨酰胺信号,从而影响膀胱与尿道的功能[6-7]。另有研究表明,5-羟色胺作用于交感和副交感神经系统,可成为一种调控膀胱功能的潜在药物[8]。因此,本研究通过制备膀胱出口不全梗阻(partial bladder outlet obstruction, PBOO)大鼠模型,模拟临床OAB患者的病理生理学改变,通过组胺、5-羟色胺的单独用药及联合用药观察药物对OAB大鼠膀胱储尿及排尿功能的影响,为临床治疗提供新的思路。
1 材料和方法 1.1 实验动物分组与处理随机选取50只鼠龄近似(约12周)的雌性SD大鼠(Harlan),体质量200~250 g,予以PBOO手术或假手术处理。接受PBOO手术的大鼠在术后随机分为4个治疗组,每组10只:2 μg组胺(10 μg/mL)组、1.1 μg 5-羟色胺(5.5 μg/mL)组、2 μg组胺与1.1 μg 5-羟色胺联合用药组,以及模型对照组。接受假手术的10只大鼠给予生理盐水治疗。所有治疗均开始于术后第10天,并持续7 d。通过耻骨上膀胱造瘘置管法检测清醒状态下的大鼠膀胱储尿与排尿功能,完毕后收取膀胱逼尿肌组织进行形态学观察。所有实验动物的使用及操作均通过实验动物保护伦理委员会的批准。
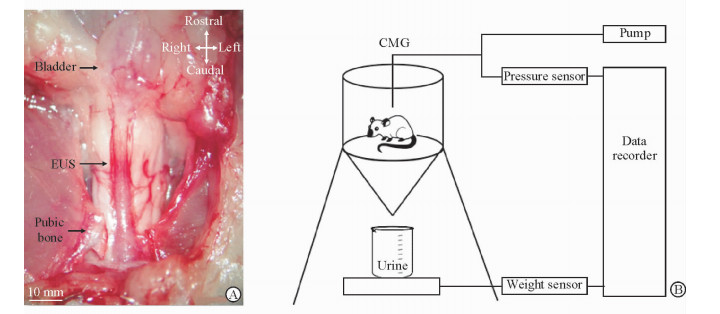
1.2 PBOO手术方法PBOO手术方法与文献[9]报道相似。首先,吸入2%异氟烷使大鼠处于全麻状态,取平卧位后,用胶带将其固定于手术操作台上。消毒铺单后,用手术刀片在大鼠的下腹部做一长约1~1.5 cm的纵行正中切口,逐层分离并切开皮下组织、肌肉及腹膜,暴露膀胱后,小心分离出膀胱颈部和近端尿道(图 1A)。然后将一金属小棒(直径约1.2 mm)平行放置于尿道一侧,并用4-0不可吸收缝线同时结扎近端尿道与金属棒。扎紧后抽出小棒,使缝线不能完全封闭近端尿道腔隙,最后用4-0丝线逐层缝合腹膜、肌肉与皮肤。术后皮下注射丁丙诺啡(0.1 mg/kg)缓解疼痛。假手术组大鼠则仅暴露膀胱与膀胱颈,不结扎尿道。
|
图 1 动物模型建立中的手术照片(A)与清醒状态下大鼠膀胱内压力测定场景示意图(B) Fig 1 Surgical picture during animal model development (A) and schematic of conscious cystometry recording (B) in rats A: Surgical picture demonstrating rat lower urinary tract anatomy with a dissected pubic symphysis; B: Schematic of cystometry acquisition including a pump, pressure sensor, weight sensor and data recorder. EUS: External urethral sphincter; CMG: Cystometrography |
1.3 给药方法
组胺(7099ED, Hollister-Stier)、5-羟色胺(H9523, Sigma-Aldrich)及生理盐水均保存于4 ℃, 使用前取出。对各组大鼠的治疗均开始于PBOO术后第10天,每天2次,背部皮下注射0.2 mL药物或生理盐水,并持续7 d。
1.4 耻骨上膀胱造瘘置管法[10]在治疗开始后第5天(PBOO术后第15天)对每只大鼠行耻骨上膀胱造瘘及置管术。使大鼠吸入2%异氟烷完全麻醉,消毒铺单后,用手术刀片在大鼠中下腹部做一长1 cm的纵行正中切口,逐层分离并暴露膀胱。用显微解剖剪刀在膀胱的顶壁剪开一0.2 cm的缺口,置入聚乙烯导管(PE-50)。然后用4-0丝线进行荷包缝合固定导管并封闭缺口。导管的另一头经皮下隧道从大鼠背部穿出,并缝合固定。最后,逐层缝合大鼠腹部切口,并予以皮下注射丁丙诺啡(0.1 mg/kg)缓解疼痛。
1.5 清醒状态下的大鼠膀胱内压力测定连续治疗后第7天(PBOO术后第17天)对大鼠进行清醒状态下的膀胱压力测定。将大鼠置于透明的塑料笼中,其背部的膀胱置管连接至1个压力传感器(PT300, Grass Instruments)和1个恒定注射泵(KDS200, KD Scientific)上,膀胱的灌注速度均为5 mL/h (图 1B)。大鼠排出的尿液顺鼠笼壁流入漏斗形底部的收集瓶内,通过瓶下方的重力传感器(FT10, Grass Instruments)可精确测量排出的尿液量。大鼠每次排尿后膀胱内的残余尿量可通过膀胱内的导管引出并进行测量。膀胱内压力及尿量的测量均可通过生物信号放大设备(Dash 8X, Astro-Med)予以准确记录。每只大鼠观察至少3个排尿周期,需记录的参数包括储尿期逼尿肌不稳定收缩的出现频率、幅度,排尿时的逼尿肌压、排尿量、排尿间隔时间,最大膀胱容量及残余尿量。
1.6 膀胱的组织学检查膀胱测压结束后,用断颈法处死大鼠,收取膀胱并称质量。将组织浸泡于10%多聚甲醛溶液中,4 ℃保存过夜后进行石蜡包埋。用切片机沿膀胱的纵轴将其切为5 μm厚的组织片,并附着于载玻片上,用Masson三色染色法显示膀胱肌肉及结缔组织,光学显微镜观察肌肉及结缔组织的形态改变。
1.7 统计学处理为保证实验的严谨性,避免偏倚,研究人员从实验分组开始直至最后数据分析均未被告知各组的治疗类型。采用SigmaPlot 12.0软件进行统计学分析,实验数据均以x±sx表示。组间比较采用单因素方差分析和Tukey事后多重比较。检验水准(α)为0.05。
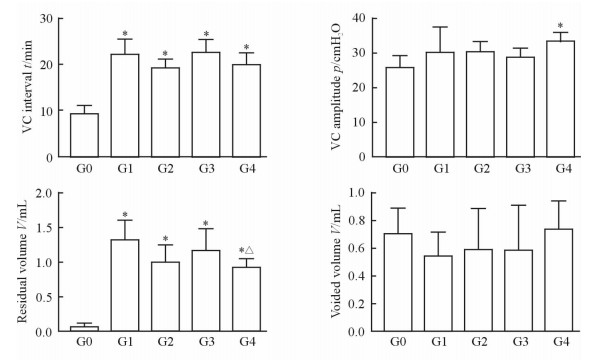
2 结果 2.1 各组大鼠膀胱储尿期相关指标的比较各组大鼠膀胱储尿期相关指标的比较结果(图 2)显示,与假手术组相比,模型对照组、组胺治疗组、5-羟色胺治疗组及组胺与5-羟色胺联合用药组的逼尿肌不稳定收缩的出现频率、振幅及膀胱的最大容量均提升(P < 0.05)。其中,组胺与5-羟色胺联合用药组的不稳定收缩振幅较模型对照组降低(P < 0.05),说明该治疗有助于降低大鼠逼尿肌在储尿期的兴奋性。
|
图 2 各组大鼠膀胱储尿期相关指标比较 Fig 2 Comparison of the parameters during bladder storage phase among groups G0: Sham group; G1: PBOO+normal saline group; G2: PBOO+serotonin group; G3: PBOO+histamine group; G4: PBOO+combination group. NVC: Non-voiding contraction; PBOO: Partial bladder outlet obstruction. 1 cmH2O=0.098 kPa. *P < 0.05 vs G0; △P < 0.05 vs G1. n=10, x±sx |
2.2 各组大鼠膀胱排尿期相关指标的比较
各组大鼠膀胱排尿期相关指标的比较结果(图 3)显示,与假手术组相比,模型对照组、组胺治疗组、5-羟色胺治疗组及组胺与5-羟色胺联合用药组大鼠的排尿间隔时间及残余尿量均增加(P < 0.05)。仅组胺与5-羟色胺联合用药组大鼠的排尿收缩振幅较假手术组升高(P < 0.05),其残余尿量较模型对照组降低(P < 0.05),结果表明该治疗有助于大鼠排尿期逼尿肌的收缩,利于膀胱的有效排空。

|
图 3 各组大鼠膀胱排尿期相关指标比较 Fig 3 Comparison of the parameters during voiding phase among groups G0: Sham group; G1: PBOO+normal saline group; G2: PBOO+serotonin group; G3: PBOO+histamine group; G4: PBOO+combination group. VC: Voiding contraction; PBOO: Partial bladder outlet obstruction. 1 cmH2O=0.098 kPa. *P < 0.05 vs G0; △P < 0.05 vs G1. n=10, x±sx |
2.3 各组大鼠膀胱质量比较
与假手术组[(0.28±0.02) g]比较,模型对照组[(0.72±0.03) g]、组胺治疗组[(0.76±0.05) g]、5-羟色胺治疗组[(0.70±0.02) g]及组胺与5-羟色胺联合用药组[(0.75±0.02) g]的膀胱质量均增加(P < 0.05)。
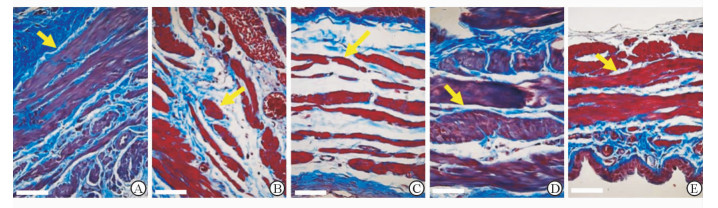
2.4 大鼠膀胱组织Masson三色染色结果膀胱组织的Masson三色染色(图 4)提示假手术组大鼠具有正常的逼尿肌形态,表现为肌纤维连续且排列紧密,而在模型对照处理组中逼尿肌肌纤维连续性中断,且排列较紊乱,并伴有胶原纤维组织浸润。在单用5-羟色胺治疗后,逼尿肌依然可见明显的断裂,且肌纤维萎缩明显,其形态更接近于模型对照组。而经过组胺或组胺与5-羟色胺联合治疗后,逼尿肌肌纤维增生显著,排布紧密且完整性明显提高。
|
图 4 各组大鼠膀胱逼尿肌的Masson三色染色结果 Fig 4 Masson trichrome staining of the detrusor muscle of rats in different groups A: Sham group; B: PBOO+normal saline group; C: PBOO+serotonin group; D: PBOO+histamine group; E: PBOO+combination group; PBOO: Partial bladder outlet obstruction. Yellow arrows indicate the smooth muscle tissue. The bar represents 50 μm |
3 讨论
OAB是泌尿外科的常见病症之一,不同程度地影响着患者的生活质量,严重者还可合并精神心理异常[2-3]。非神经损伤相关的原发性OAB的发病机制尚不明确,可能与储尿期膀胱逼尿肌传入神经兴奋性异常升高有关,同时还有嘌呤能受体、谷氨酰胺及神经营养因子等物质的参与[11]。
当前临床药物治疗主要采用的是抗毒蕈碱药物,它能抑制膀胱逼尿肌的M受体,降低膀胱兴奋性,从而缓解患者的症状。抗毒蕈碱药物在OAB的治疗中虽取得了较为理想的疗效,但其机制实为对症治疗,而并未针对疾病原因本身,且一部分由于药物的不良反应的影响而无法长期坚持服药,这也是治疗失败的主要原因[12]。骶神经电调控是顽固性OAB患者的可选治疗方法,虽然在国外已得到了广泛应用,但由于它是有创治疗,且价格昂贵,因而在国内尚未普及。
为研究OAB的发病机制及探索新型治疗方法,现有文献已经报道了多种可模拟出OAB患者临床症状的动物模型,主要方法有人为增加膀胱传入神经敏感性、外界炎症刺激及PBOO手术干预等[9, 13]。其中,前两种干预方法更多地被用于研究膀胱疼痛综合征和间质性膀胱炎的发病机制。而PBOO手术干预法更能模拟出原发性OAB患者的症状及病理生理学改变[14],因而本研究选用PBOO手术制备动物模型。
首先,本研究中模型对照组大鼠的逼尿肌不稳定收缩频率、振幅及残余尿量较假手术组均有提升,表明该动物模型能有效地模拟出OAB患者的尿动力学改变,进而说明建模成功。在采用组胺、5-羟色胺或两者联合的治疗中,我们发现联合运用低剂量的组胺与5-羟色胺,一方面可降低储尿期逼尿肌不稳定收缩的振幅,说明该治疗有助于改善膀胱的储尿功能;另一方面,联合用药还可提高排尿时逼尿肌收缩的振幅及减少残余尿量,表明膀胱的排尿功能也得到了改善。尽管如此,组胺与5-羟色胺联合用药组不稳定收缩的振幅及残余尿量与假手术组相比差异仍有统计学意义,其原因可能是本研究所采用的治疗时间较短,其余一些指标恢复所需要的时间更长。在组织学研究中,我们还发现组胺治疗组和组胺与5-羟色胺联合用药组大鼠的逼尿肌形态得到了显著改善,说明该治疗还有助于肌肉细胞的分化与增殖。
现有研究表明,组胺H1型受体表达于膀胱平滑肌细胞中,且刺激该受体可引发肌肉的收缩,而这一作用又可被H1受体阻断剂所消除,这些证据表明组胺可影响膀胱及近端尿道肌肉的收缩力[15]。在离体培养的膀胱逼尿肌细胞中,刺激H1和H3型组胺受体可调节1, 4, 5-三磷酸肌醇和N型钙离子通道,引发钙离子的释放[7]。此外,作为一种重要的神经递质,组胺还可激活兴奋性的谷氨酰胺信号通路,调节交感与副交感神经的兴奋性,从而在脊髓水平调节下尿路功能[6-7, 16-17]。不仅如此,组胺可通过刺激成纤维细胞而增加胶原蛋白的产生[18],这也可以解释在本研究中单用组胺治疗组的膀胱逼尿肌肌肉纤维恢复优于模型对照组与单用5-羟色胺治疗组。
在与下尿路功能调节相关的神经通路中已发现了多种5-羟色胺受体亚型,并可作为潜在的药物治疗靶点[19]。度洛西丁是一种高选择性5-羟色胺重吸收抑制剂,在欧洲已被批准用来治疗压力性尿失禁及混合性尿失禁,且取得了较为满意的疗效。其作用机制是通过抑制5-羟色胺的重吸收,减弱膀胱副交感神经节前纤维传入神经的兴奋性,从而抑制膀胱的收缩,提高膀胱的储尿能力[20]。若阻断离子通道型谷氨酰胺受体,则可以消除度洛西丁的药物作用,说明5-羟色胺需通过兴奋性的谷氨酰胺受体发挥作用[21]。
尽管组胺和5-羟色胺都影响着下尿路的功能调节,但两者联合应用可获得更显著疗效的作用机制尚不明确。有研究运用片段筛选药物的方法,发现组胺H4型受体与5-羟色胺5-HT3A型受体在功能和形态上存在重叠,说明两者可能成为药物治疗的共同作用靶点,并存在受体之间的协同效应[22]。联合用药的药理学机制有待于进一步探索。
虽然有研究认为全身性应用组胺和(或)5-羟色胺会引发一系列危及生命的不良反应,如血清素综合征,但这一现象与使用的药物剂量密切相关[23]。本实验给予的药物剂量低,且没有发现任何与治疗药物相关的不良反应。可以看出,在这种动物模型中使用低剂量的组胺和(或)5-羟色胺既可达到治疗的目的,也可维持安全性。
本实验存在的主要缺陷是PBOO动物模型虽然能模拟出临床OAB患者的症状,但究其本质是啮齿类动物,与人类尚存在一定的差异。大鼠在日常绝大多数为四足爬行,膀胱和尿道平行于地面,而人类是直立行走,膀胱和尿道与地面垂直,因此产生的尿液还会受到重力的作用。尽管如此,该动物模型在OAB的研究中得到了认可和广泛的运用,且本研究所采用尿动力学指标能客观反映膀胱的储尿和排尿功能。
综上所述,对OAB大鼠联合应用低剂量的组胺与5-羟色胺,可安全、有效地改善储尿期膀胱功能的稳定性,并提高膀胱的排空效率,组织学依据也提示该治疗有助于逼尿肌形态学的改善。因此,本研究结果可为临床OAB治疗提供一种新的思路,但其治疗机制尚不明确,有待进一步研究。
| [1] | ABRAMS P, CARDOZO L, FALL M, GRIFFITHS D, ROSIER P, ULMSTEN U, et al. The standardisation of terminology in lower urinary tract function:report from the standardisation sub-committee of the International Continence Society[J]. Urology, 2003, 61: 37–49. DOI: 10.1016/S0090-4295(02)02243-4 |
| [2] | MILSOM I, ABRAMS P, CARDOZO L, ROBERTS R G, THÜROFF J, WEIN A J. How widespread are the symptoms of an overactive bladder and how are they managed? A population-based prevalence study[J]. BJU Int, 2001, 87: 760–766. |
| [3] | STEWART W F, VAN ROOYEN J B, CUNDIFF G W, ABRAMS P, HERZOG A R, COREY R, et al. Prevalence and burden of overactive bladder in the United States[J]. World J Urol, 2003, 20: 327–336. |
| [4] | HASHIM H, ABRAMS P. Is the bladder a reliable witness for predicting detrusor overactivity?[J]. J Urol, 2006, 175: 191–194. DOI: 10.1016/S0022-5347(05)00067-4 |
| [5] | ESPUÑA-PONS M, CARDOZO L, CHAPPLE C, SIEVERT K D, VAN KERREBROECK P, KIRBY M G. Overactive bladder symptoms and voiding dysfunction in neurologically normal women[J]. Neurourol Urodyn, 2012, 31: 422–428. DOI: 10.1002/nau.v31.4 |
| [6] | BEKKERS J M. Enhancement by histamine of NMDA-mediated synaptic transmission in the hippocampus[J]. Science, 1993, 261: 104–106. DOI: 10.1126/science.8391168 |
| [7] | NEUHAUS J, OBERBACH A, SCHWALENBERG T, STOLZENBURG J U. Cultured smooth muscle cells of the human vesical sphincter are more sensitive to histamine than are detrusor smooth muscle cells[J]. Urology, 2006, 67: 1086–1092. DOI: 10.1016/j.urology.2005.11.031 |
| [8] | DE GROAT W C. Influence of central serotonergic mechanisms on lower urinary tract function[J]. Urology, 2002, 59(5 Suppl 1): 30–36. |
| [9] | DAMASER M S, BRZEZINSKI K, LONGHURST P A. Filling mechanics of obstructed and de-obstructed rat urinary bladders[J]. Neurourol Urodyn, 1999, 18: 659–671. DOI: 10.1002/(ISSN)1520-6777 |
| [10] | GASBARRO G, LIN D L, VURBIC D, QUISNO A, KINLEY B, DANESHGARI F, et al. Voiding function in obese and type 2 diabetic female rats[J]. Am J Physiol Renal Physiol, 2010, 298: F72–F77. DOI: 10.1152/ajprenal.00309.2009 |
| [11] | SONG Q X, CHERMANSKY C J, BIRDER L A, LI L, DAMASER M S. Brain-derived neurotrophic factor in urinary continence and incontinence[J]. Nat Rev Urol, 2014, 11: 579–588. |
| [12] | SACCO E, BIENTINESI R. Innovative pharmacotherapies for women with overactive bladder:where are we now and what is in the pipeline[J]. Int Urogynecol J, 2015, 26: 629–640. DOI: 10.1007/s00192-014-2557-9 |
| [13] | PARSONS B A, DRAKE M J. Animal models in overactive bladder research[J]. Handb Exp Pharmacol, 2011: 15–43. |
| [14] | SAITO M, SHIMIZU S, KINOSHITA Y, SATOH I, SHOMORI K, DIMITRIADIS F, et al. Bladder dysfunction after acute urinary retention in the rats:a novel over active bladder model[J]. Mol Cell Biochem, 2010, 333(1/2): 109–114. |
| [15] | HILL S J, GANELLIN C R, TIMMERMAN H, SCHWARTZ J C, SHANKLEY N P, YOUNG J M, et al. International Union of Pharmacology. ⅩⅢ. Classification of histamine receptors[J]. Pharmacol Rev, 1997, 49: 253–178. |
| [16] | CHARLES J, ANGUS J A, WRIGHT C E. Central endogenous histamine modulates sympathetic outflow through H3 receptors in the conscious rabbit[J]. Br J Pharmacol, 2003, 139: 1023–1031. DOI: 10.1038/sj.bjp.0705322 |
| [17] | ZHAO X L, YANAI K, HASHIMOTO Y, STEINBUSCH H W, WATANABE T. Effects of unilateral vagotomy on nitric oxide synthase and histamine H3 receptors in the rat dorsal vagal complex[J]. J Chem Neuroanat, 1996, 11: 221–229. DOI: 10.1016/S0891-0618(96)00163-9 |
| [18] | MUROTA H, KATAYAMA I. Emedastine difumarate:a review of its potential ameliorating effect for tissue remodeling in allergic diseases[J]. Expert Opin Pharmacother, 2009, 10: 1859–1867. DOI: 10.1517/14656560903078410 |
| [19] | RAMAGE A G. The role of central 5-hydroxytryptamine (5-HT, serotonin) receptors in the control of micturition[J]. Br J Pharmacol, 2006, 147(Suppl 2): S120–S131. |
| [20] | JOST W, MARSALEK P. Duloxetine:mechanism of action at the lower urinary tract and Onuf's nucleus[J]. Clin Auton Res, 2004, 14: 220–227. |
| [21] | KAWAMORITA N, KAIHO Y, MIYAZATO M, ARAI Y, YOSHIMURA N. Roles of the spinal glutamatergic pathway activated through α-amino-3-hydroxy-5-methylisoxazole-4-propionic acid (AMPA) receptors and its interactions with spinal noradrenergic and serotonergic pathways in the rat urethral continence mechanisms[J]. Neurourol Urodyn, 2015, 34: 475–481. DOI: 10.1002/nau.v34.5 |
| [22] | VERHEIJ M H, DE GRAAF C, DE KLOE G E, NIJMEIJER S, VISCHER H F, SMITS R A, et al. Fragment library screening reveals remarkable similarities between the G protein-coupled receptor histamine H4 and the ion channel serotonin 5-HT3A[J]. Bioorg Med Chem Lett, 2011, 21: 5460–5464. DOI: 10.1016/j.bmcl.2011.06.123 |
| [23] | BOYER E W, SHANNON M. The serotonin syndrome[J]. N Engl J Med, 2005, 352: 1112–1120. DOI: 10.1056/NEJMra041867 |
 2017, Vol. 38
2017, Vol. 38


