2. 暨南大学附属第一医院药学部, 广州 510630;
3. 暨南大学附属第一医院检验科, 广州 510630
2. Department of Pharmacy, the First Affiliated Hospital of Jinan University, Guangzhou 510630, Guangdong, China;
3. Department of Laboratory Medicine, the First Affiliated Hospital of Jinan University, Guangzhou 510630, Guangdong, China
银屑病(psoriasis)俗称“牛皮癣”,是一种常见的易于复发的慢性炎症性增生性皮肤病,其主要的组织病理学改变为新生血管形成、表皮角质形成细胞过度增殖及真皮T淋巴细胞炎性浸润[1];临床表现上有4种类型,即寻常型、脓疱型、红皮病型和关节病型,其中寻常型银屑病最常见,典型皮损为红色丘疹或斑块上覆有多层银白色鳞屑[2-3]。病程较长、皮损广泛、瘙痒、鳞屑和可见的斑块是困扰银屑病患者的主要问题,且缺乏长期根治的方法,是当前皮肤科领域重点研究的疾病之一[4]。由于病因复杂,机制不明确[5],患者多伴有多种内源性代谢紊乱,因此应用代谢组学技术对寻常型银屑病患者内源性代谢谱进行研究,可以为深入探究疾病发病机制和寻求长期、有效、安全的新治疗方法提供方向。
代谢组学通过考察机体受病理生理刺激或基因突变而引起的体内代谢产物的动态变化来研究机体的代谢网络[6]。通常采用的现代分析测定方法有核磁共振(nuclear magnetic resonance, NMR)、气相色谱-质谱联用(gas chromatography-mass spectrometry, GC-MS)、液相色谱-质谱联用(liquid chromatography-mass spectrometry, LC-MS)等[7]。NMR技术不破坏样品结构和性质,且能对样品实现非选择性分析,具有良好的真实性和重复性等优点[8]。本研究以寻常型银屑病患者和健康者的血浆为研究对象,采用基于核磁共振氢谱(nuclear magnetic resonance 1H spectroscopy, 1HNMR)的代谢组学技术观察寻常型银屑病患者体内代谢轮廓的改变,寻找患者体内的潜在生物标记物,并进行相关代谢通路分析,以探讨疾病的可能发病机制,为其治疗和诊断提供依据。
1 材料和方法 1.1 一般资料随机选取2015年3月至9月间在暨南大学附属第一医院皮肤科门诊接受治疗的寻常型银屑病患者10例作为病例组,男5例、女5例,平均年龄(37.53±9.34)岁。选取暨南大学附属第一医院12例同期健康体检者作为对照组,男5例、女7例,平均年龄(35.76±8.27)岁。本研究经过暨南大学附属第一医院伦理委员会批准,所有入选对象均签署了知情同意书。
1.2 纳入标准与排除标准纳入标准:(1) 符合《临床诊疗指南:皮肤病与性病分册》[9]、《中国银屑病治疗指南(2008版)》[10]临床诊断标准且处于稳定期,年龄18~65岁;(2) 银屑病面积与严重性指数(psoriasis area and severity index,PASI)评分>7分且≤20分,体表面积(body surface area,BSA)<30%。
排除标准:(1) 关节型、脓疱型、红皮病型银屑病以及特殊部位银屑病,包括颜面、头皮、指甲、皱褶、龟头、黏膜、掌跖部位的患者; (2) 妊娠、哺乳期或1年内计划妊娠者; (3) 焦虑自评量表(SAS)>50分或抑郁自评量表(SDS)>53分,或合并其他精神疾病者; (4) 合并有循环系统、呼吸系统、消化系统、泌尿系统、内分泌系统和造血系统等严重原发性疾病,常规用药无法控制者;(5) 合并肿瘤的患者;(6) 有严重感染,水、电解质及酸碱平衡紊乱者,及合并有钙代谢失调者;(7) 丙氨酸转氨酶或天冬氨酸转氨酶增高>3倍正常值上限、肌酐增高>1.5倍正常值上限、血红蛋白增高>20 g/L、血小板计数减少<75.0×109/L、白细胞计数减少<3.0×109/L、血钙升高>2.9 mmol/L或降低<2 mmol/L、血钾升高>5.5 mmol/L或降低<3 mmol/L,属于上述临床检测指标之一的患者, 或其他实验室检查异常, 研究者判断不适合参与本研究的患者; (8) 已知对本研究中所用药物过敏者; (9) 正在参加其他药物临床试验者或1个月内参加过其他临床试验者; (10) 2周内曾用激素、维甲酸类等外用药物者, 4周内曾接受紫外线治疗或系统治疗者, 12周内曾使用生物制剂治疗者; (11) 需进行西医系统治疗的患者。
1.3 样本收集所有人均清晨空腹抽血,置于5 mL EDTA-K2抗凝管中,采血后立即轻轻颠倒混匀5~6次,静置2 h,然后离心(4 000 r/min, 15 min, 4 ℃;离心机半径18 cm),并提取上层血浆于-80 ℃冰箱冻存待测。
1.4 样本预处理血浆样品在室温下静置约20 min至完全解冻后,吸取0.3 mL加入0.1 mL 2,2,3,3-三甲基甲硅烷基丙酸(TSP, 1 mg/mL)和0.2 mL磷酸盐缓冲溶液(0.2 mol/L NaH2PO4-0.2 mol/L Na2HPO4 1:1, pH 7.4, 99% D2O)中,混匀后静置20 min,然后离心(12 000 r/min,10 min,4 ℃;离心机半径9.5 cm),取0.55 mL上清液转入5 mm核磁管,4 ℃冰箱保存备用。
1.5 NMR数据采集及处理在Bruker AVANCE Ⅲ-500超导傅立叶变化核磁共振波谱仪上调用弛豫编辑(Carr-Purcell-Meiboom-Gill, CPMG)脉冲序列,CPMG脉冲序列可以压制大分子物质的信号,从而检测血浆中的小分子代谢物。采用预饱和方式抑制水峰,饱和时间为2 s,混合时间0.15 s,谱宽8 000 Hz,采样点数32 000,弛豫延迟2 s,采样时间2 s,累加次数64次,自旋回波时间(2 nτ)为320 ms,控制温度在298 K。自由感应衰减(free induction decay, FID)信号经过傅立叶变换转为一维NMR谱图,采用MestReNova 5.3软件对所有CPMG谱进行调相、基线校正,以TSP化学位移0.00进行定标,自动积分,积分区间化学位移0.5~9.0,积分间隔为化学位移0.04。为了消除残余水峰引起的影响,将积分区间化学位移4.5~5.2的积分值设为零。此外,为了消除样本间因浓度不同而带来的分析误差,对各分段积分值进行归一化处理。所得数据输出并转换为Excel格式文件保存。
1.6 数据分析和统计学处理将保存的Excel格式数据导入到SIMCA-P12.0软件包(Umetrics, Umeå, Sweden)进行多元统计分析。数据采用平均中心化(mean centering)和UV标度化(unit variance scaling)[11-13]预处理后,首先进行主成分分析(principal component analysis, PCA)。为强化组间差异,消除无关因素影响,进一步采用正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)。统计分析采用SPSS 17.0软件,从OPLS-DA模型中提取变量重要性投影(variable importance in projection, VIP)值>1的变量,对其归一化积分值进行独立样本t检验,检验水准(α)为0.05。同时结合相关系数(correlation coefficient)柱状图进行对比,筛选出潜在的生物标记物。对这些差异标记物通过人类代谢产物数据库(http://www.hmdb.ca)及查阅文献来鉴定其代谢产物名称并构建相关代谢通路图进行分析。
2 结果 2.1 健康组与寻常型银屑病组血浆1HNMR波谱图比较1HNMR谱峰信号的强弱反映样本中各组分的相对含量,由图 1可知,健康组与寻常型银屑病组在某些化学位移处的组分含量有显著差异,参考文献[14-16]进行相关谱峰归属。
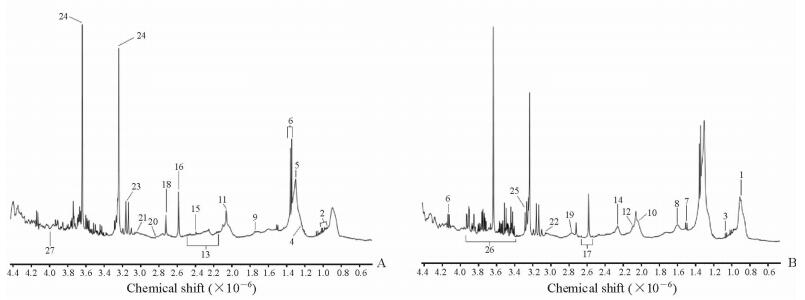
|
图 1 健康组与寻常型银屑病组血浆的1HNMR波谱图 Fig 1 Plasma 1HNMR spectrum of healthy group and psoriasis vulgaris group A: Healthy group; B: Psoriasis vulgaris group. 1: VLDL/LDL CH3; 2: Leucine/isoleucine; 3: Valine; 4: β-Hydroxybutyrate; 5: VLDL/LDL (CH2)n; 6: Lactate; 7: Alanine; 8: Lipid CH2CH2C=O; 9: Arginine/lipid CH2CH2C=C; 10: Lipid CH2C=C; 11: N-acetyl glycoprotein; 12: Glutamate; 13: Glutamine; 14: Acetoacetate/lipid CH2C=O; 15: Pyruvate; 16: Ca-EDTA (co-shifting signal); 17: Citrate; 18: Mg-EDTA; 19: Lipid C=CCH2C=C; 20: Aspartate; 21: Creatine; 22: Creatinine; 23: Acetate Ca-EDTA; 24: EDTA; 25: Acetate Mg-EDTA; 26: Glucose; 27: Phenylalanine. 1HNMR: Nuclear magnetic resonance 1H spectroscopy; VLDL: Very low-density lipoprotein; LDL: Low-density lipoprotein; EDTA: Ethylene diamine tetraacetic acid |
2.2 模式识别分析
图 2为用PCA和OPLS-DA进行模式识别的得分图。图中t1和t2分别表示前2个主成分,得分图反映了各个样品在t1和t2组成的坐标体系中的分布情况,图中每个点代表1个样本。由PCA得分图可见,寻常型银屑病组和健康组沿第一主成分t[1]轴方向已有明显分离的趋势(R2X: 94.7%, Q2: 84.3%);由OPLS-DA得分图可见,两组沿t[1]轴方向能明显分开,且无交叉和重叠(R2X: 93.8%, R2Y: 97.0%, Q2: 92.5%)。由以上分析可知,模型稳定可靠,寻常型银屑病组和健康组血浆代谢轮廓存在明显差异。
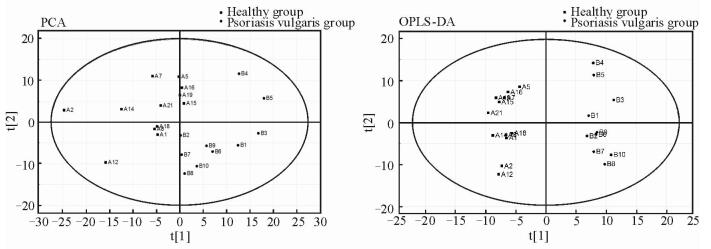
|
图 2 PCA (左)和OPLS-DA (右)得分图 Fig 2 PCA (left) and OPLS-DA (right) score plot PCA: Principal component analysis; OPLS-DA: Orthogonal partial least squares discriminant analysis |
图 3给出了OPLS-DA模型中部分变量相关系数柱状图,横坐标表示变量的化学位移,纵坐标表示相应变量的相关系数值。相关系数的绝对值大小代表其对应变量对OPLS-DA分析结果的影响,即间接反映两组相应代谢物的差异大小,相关系数越大说明该变量对回归方程的拟合效果越好,对模型也越重要。正值代表其对应的代谢物水平在寻常型银屑病组中高于健康组,负值则低于健康组。

|
图 3 OPLS-DA模型部分变量相关系数柱状图 Fig 3 OPLS-DA part variables correlation coefficient bar graph OPLS-DA: Orthogonal partial least squares discriminant analysis |
2.3 统计学分析与分子标记物的鉴定
对OPLS-DA模型中提取的VIP值 > 1的变量的归一化积分值采用独立样本t检验进行统计分析,同时结合相关系数柱状图进行对比,共有38个化学位移值所代表的代谢物在健康组与寻常型银屑病组中差异有统计学意义,对上述化学位移值所代表的代谢物通过人类代谢产物数据库及查阅文献进行成分鉴定。从表 1中可见,健康组与寻常型银屑病组血浆中对分类贡献较大的特异性代谢物有21个,这些差异代谢物与糖代谢、脂类代谢和氨基酸代谢等多个代谢通路相关。各差异性代谢物之间的代谢通路简图见图 4。
|
|
表 1 寻常型银屑病组与健康组比较的差异性代谢物 Tab 1 The differential metabolites in psoriasis vulgaris group and healthy group |

|
图 4 差异性代谢物代谢通路图 Fig 4 The metabolic pathways of differential metabolites Metabolites in the box represent increase compared to controls. VLDL: Very low-density lipoprotein; LDL: Low-density lipoprotein; CoA: Coenzyme A |
3 讨论
1HNMR代谢组学通过比较刺激前后或不同病理生理状态下的NMR代谢图谱,能够获得丰富的体内分子代谢物信息,已经成为研究生物样品代谢物变化的一种重要手段。本研究运用1HNMR代谢组学技术对寻常型银屑病组与健康组血浆进行代谢轮廓分析,模型识别分析结果显示两组能够被明显区分,组间内源性代谢物的含量存在明显差异,提示寻常型银屑病的相关生物代谢通路发生了改变。与健康组相比,寻常型银屑病组血浆中VLDL、LDL、脂类、亮氨酸、异亮氨酸、缬氨酸、β-羟基丁酸、乳酸、丙氨酸、精氨酸、N-乙酰糖蛋白、乙酰乙酸、谷氨酸、丙酮酸、谷氨酰胺、柠檬酸、肌酸、肌酐、葡萄糖、天冬氨酸和苯丙氨酸含量明显增高。这一结果与刘卫红等[17]的研究基本相符,同时又发现了其他多种差异性代谢物,这可能是由于样本量偏少所致,并对这些差异性代谢物进行了代谢通路分析。欧阳昕等[18]的研究结果显示系统性红斑狼疮患者血清中异亮氨酸、缬氨酸、丙氨酸、谷氨酸、苯丙氨酸、丙酮酸、柠檬酸、肌酸、肌酐含量均明显降低,这是系统性红斑狼疮与寻常型银屑病差异性代谢物的区别之处。这些差异性代谢物代谢水平的变化说明寻常型银屑病与脂肪酸代谢、三羧酸循环、氨基酸代谢、丙酮酸代谢、糖异生、糖酵解、葡萄糖-丙氨酸循环等多个代谢途径紊乱相关。
寻常型银屑病组血浆中葡萄糖、乳酸、丙酮酸含量明显升高说明糖代谢发生紊乱。葡萄糖是生物体内的主要能源物质,其主要来源是糖原分解和糖异生,乳酸、甘油、生糖氨基酸等非糖化合物作为主要原料通过糖异生作用产生葡萄糖。葡萄糖经过糖酵解途径分解成丙酮酸,它是机体糖、脂肪和蛋白质合成与分解代谢的重要中间产物,当机体缺氧时,丙酮酸会在乳酸脱氢酶的作用下转化成乳酸。研究发现,在炎症时,即使在有氧条件下机体也优先进行丙酮酸转化为乳酸的代谢,这种现象被称为有氧糖酵解或Warburg效应[19]。寻常型银屑病是一种以炎性细胞大量浸润、角质形成细胞过度增殖为主要病理特征的疾病,这些以增殖为主的病理变化必然产生大量的能量消耗,故出现乳酸、葡萄糖水平变化可能属于同类炎性疾病的共同特点[20]。
寻常型银屑病组血浆中亮氨酸、异亮氨酸、缬氨酸、丙氨酸、精氨酸、N-乙酰糖蛋白、谷氨酸、谷氨酰胺、天冬氨酸和苯丙氨酸含量明显增高,说明氨基酸代谢发生紊乱。N-乙酰糖蛋白是炎症标记物和急性期反应物蛋白,其水平的增高提示在寻常型银屑病发展过程中炎症的发生[21]。谷氨酸是氨基酸合成和降解反应中的一个关键中间代谢物,谷氨酰胺和丙氨酸是氨的主要运输形式,精氨酸参与尿素循环。肝脏与氨基酸代谢关系极为密切,肝脏作为氨基酸代谢的中心,任何肝损伤都可能干扰氨基酸的代谢[22],这些氨基酸含量的升高说明肝脏功能发生损害,同时引起丙酮酸或三羧酸循环中间产物如柠檬酸等浓度升高,从而使三羧酸循环或糖代谢途径发生紊乱,其中苯丙氨酸、异亮氨酸和亮氨酸也能沿脂肪酸分解或合成途径生成酮体或脂肪酸,使其含量升高。
寻常型银屑病组血浆中VLDL、LDL、脂类、乙酰乙酸和β-羟基丁酸含量明显升高,表明脂代谢发生异常。酮体是脂肪酸在肝脏分解氧化时特有的中间代谢物,由脂肪酸经β-氧化产生的大量乙酰辅酶A在一系列酶系作用下生成,在肝细胞生成后进入血液循环。正常人血液中酮体含量极少,但在糖代谢受阻、脂肪代谢异常等情况下脂肪被大量动员[23],所以乙酰乙酸和β-羟基丁酸水平的升高表明脂肪酸氧化的增强。肌酸是体内能量储存和利用的重要化合物,一部分从食物中摄取,另一部分则由肝脏合成。肌酸在体内以甘氨酸为骨架合成后转变成磷酸肌酸即储存三磷酸腺苷的高能磷酸键[24],血浆中较高浓度的肌酸说明肌肉能量代谢发生紊乱。肌酸和磷酸肌酸代谢的最终产物是肌酸酐,由肾脏排出,其血浆含量的高低与肾脏功能是否正常关系密切,可作为肾病的标记物之一,在血浆中肌酐含量增加说明肾脏功能发生紊乱[25]。
综上所述,从1HNMR代谢组学角度来看,寻常型银屑病患者不仅存在脂类代谢、糖代谢和氨基酸代谢紊乱,还伴随着炎症反应的发生和肝肾功能的损害,这是机体多种代谢途径异常、多功能发生紊乱的综合结果。这些内源性代谢物含量的改变提供了更多关于寻常型银屑病发生、发展过程中的生化信息,可加深对该疾病发病机制的认识,对探讨疾病的综合防治策略具有重要意义。由于NMR代谢组学方法只能检测到血浆中的小部分分子代谢物,对机体内源性代谢物的全面检测还有待于GC-MS、LC-MS等多种方法的综合分析,以便更加系统全面地解释体内代谢物变化过程。
| [1] | 初金玉, 刘丽英, 鄂佳, 杨静, 王晶. 银屑胶囊联合复方氟米松软膏治疗寻常型银屑病的临床观察[J]. 中国药房, 2016, 27: 3665–3667. |
| [2] | 潘柏良. 7种药物治疗寻常型银屑病的成本-效果分析[J]. 中国药房, 2011, 22: 2417–2420. |
| [3] | GRIFFITHS C E, BARKER J N. Pathogenesis and clinical features of psoriasis[J]. Lancet, 2007, 370: 263–271. DOI: 10.1016/S0140-6736(07)61128-3 |
| [4] | 马可芹, 郝平生, 李娇慧, 周茜. 代谢组学与银屑病证候本质研究进展[J]. 辽宁中医杂志, 2014, 41: 591–593. |
| [5] | 卢传坚, 曾召, 谢秀丽, 宁江. 1979-2010年寻常型银屑病文献证候分布情况分析[J]. 中医杂志, 2012: 959–961. |
| [6] | 杜智勇, 沈安娜, 苏亮, 梁健球, 许顶立. 基于H-NMR的模式识别方法在慢性心力衰竭患者血清代谢组学中的应用[J]. 南方医科大学学报, 2012, 32: 415–419. |
| [7] | WU H, XUE R, DONG L, LIU T, DENG C, ZENG H, et al. Metabolomic profiling of human urine in hepatocellular carcinoma patients using gas chromatography/mass spectrometry[J]. Anal Chim Acta, 2009, 648: 98–104. DOI: 10.1016/j.aca.2009.06.033 |
| [8] | 钟莉, 张景萍, 麦日排提·阿卜杜拉, 阿吉古丽·努尔买买提, 古丽尼沙·莫沙, 库热西·玉努斯. 基于核磁共振代谢技术的维吾尔族原发性高血压患者血浆代谢组学研究[J]. 岭南心血管病杂志, 2015, 21: 663–668. |
| [9] | 中华医学会. 临床诊疗指南:皮肤病与性病分册[M]. 北京: 人民卫生出版社, 2006: 109-113. |
| [10] | 医学会皮肤性病学分会银屑病学组. 中国银屑病治疗指南(2008版)[J]. 中华皮肤科杂志, 2009, 42: 213–214. |
| [11] | 阿基业. 代谢组学数据处理方法--主成分分析[J]. 中国临床药理学与治疗学, 2010, 15: 481–489. |
| [12] | PINTO J, ALMEIDA L M, MARTINS A S, DUARTE D, BARROS A S, GALHANO E, et al. Prediction of gestational diabetes through NMR metabolomics of maternal blood[J]. J Proteome Res, 2015, 14: 2696–2706. DOI: 10.1021/acs.jproteome.5b00260 |
| [13] | PINTO J, BARROS A S, DOMINGUES M R, GOODFELLOW B J, GALHANO E, PITA C, et al. Following healthy pregnancy by NMR metabolomics of plasma and correlation to urine[J]. J Proteome Res, 2015, 14: 1263–1274. DOI: 10.1021/pr5011982 |
| [14] | PROBERT F, RICE P, SCUDAMORE C L, WELLS S, WILLIAMS R, HOUGH T A, et al. H NMR metabolic profiling of plasma reveals additional phenotypes in knockout mouse models[J]. J Proteome Res, 2015, 14: 2036–2045. DOI: 10.1021/pr501039k |
| [15] | SAVORANI F, KRISTENSEN M, LARSEN F H, ASTRUP A, ENGELSENS B. High throughput prediction of chylomicron triglycerides in human plasma by nuclear magnetic resonance and chemometrics[J]. Nutr Metab (Lond), 2010, 7: 43. DOI: 10.1186/1743-7075-7-43 |
| [16] | KIM J A, CHOI H J, KWON Y K, RYU D H, KWON T H, HWANG G S. H NMR-based metabolite profiling of plasma in a rat model of chronic kidney disease[J]. PLoS One, 2014, 9: e85445. DOI: 10.1371/journal.pone.0085445 |
| [17] | 刘卫红, 李萍, 王萍, 颜贤忠, 张琪, 陈合兵, 等. 银屑病血热证患者治疗前后血浆代谢组学分析[J]. 首都医科大学学报, 2009, 30: 430–435. |
| [18] | 欧阳昕, 文锦丽, 彭武建, 王林纤, 王红蕾, 戴勇. 应用代谢组学方法构建系统性红斑狼疮诊断模型[J]. 中国现代医学杂志, 2011, 21: 2878–2881. |
| [19] | LU H, FORBES R A, VERMA A. Hypoxia-inducible factor 1 activation by aerobic glycolysis implicates the Warburg effect in carcinogenesis[J]. J Biol Chem, 2002, 277: 23111–23115. DOI: 10.1074/jbc.M202487200 |
| [20] | 陈勤, 祝骥, 卢德赵. 电针对佐剂关节炎大鼠血浆H-NMR代谢谱图的影响[J]. 浙江中医杂志, 2016, 51: 95–97. |
| [21] | POEZE M, LUIKING Y C, BREEDVELD P, MANDERS S, DEUTZ N E. Decreased plasma glutamate in early phases of septic shock with acute liver dysfunction is an independent predictor of survival[J]. Clin Nutr, 2008, 27: 523–530. DOI: 10.1016/j.clnu.2008.04.006 |
| [22] | 张艳花, 王东琴, 李晓伟, 张福生, 李震宇, 薛英, 等. 基于H-NMR代谢组学技术寻找CCl4致大鼠急性肝损伤的代谢标志物[J]. 药物评价研究, 2014, 37: 11–16. |
| [23] | 廖沛球, 薛蓉, 吴亦洁, 裴奉奎, 李晓晶. 给药硝酸镨后大鼠尿液和血清的核磁共振代谢组学研究[J]. 分析化学, 2012, 40: 1421–1428. |
| [24] | 麦提喀斯木·尼扎木丁, 麦合苏木·艾克木, 买吾拉尼江·依孜布拉, 维妮拉·乌斯曼, 玉苏甫江·台外库力, 阿不都热依木·玉苏甫. 基于NMR代谢组学方法研究异常黑胆质成熟剂对抑郁症大鼠血浆代谢的影响[J]. 新疆医科大学学报, 2016, 39: 1–6. |
| [25] | MONTEIRO N, BRANCO M, PERES S, BORGES F, MANSINHO K. The impact of tenofovir disoproxil fumarate on kidney function:four-year data from the HIV-infected outpatient cohort[J]. J Int AIDS Soc, 2014, 17(4 Suppl 3): 19565. |
 2017, Vol. 38
2017, Vol. 38


