左心室肥大(left ventricular hypertrophy,LVH)是高血压病主要的心脏改变和常见并发症之一,是心血管事件发生的一项独立危险因子[1-2],而LVH的逆转能够使心血管死亡、心肌梗死和脑卒中风险降低[3-5]。因此,LVH的早期发现与干预具有十分重要的意义。目前临床上诊断LVH的主要方法有心电图(electrocardiogram,ECG)、超声心动图(ultrasonic cardiogram,UCG)和心脏磁共振成像(magnetic resonance imaging,MRI)等。ECG反映心脏的电学变化,而UCG和MRI反映心脏的形态学改变。LVH的ECG电学变化能否早于UCG和心脏MRI反映的形态学改变,尚未得到完全阐明。本研究拟通过制备高血压动物模型,系统观察高血压导致LVH的过程中ECG和UCG的变化,以期揭示LVH所导致的ECG变化能否早于UCG的形态学改变,进一步探明ECG在高血压性LVH早期诊断中的意义。
1 材料和方法 1.1 主要设备日本光电株式会社ECG-9130P心电图机;飞利浦公司Philips IE33型超声仪;通用电气公司GE R500型X线仪器。
1.2 动物分组与模型制备雄性日本大耳白兔40只,按体质量对其进行编号,从随机数字表中按序查找,对≤40的数字进行标记,查够25个数字,将与此25个数字对应的动物纳入实验组,余下的15只纳入对照组。实验组:以20%乌拉坦10 mL/kg腹腔麻醉动物,待角膜反射和夹趾反射消失及四肢松弛后,取右侧卧位,固定于手术台上。于肾动脉上方1 cm处用丝线结扎缩窄腹主动脉,使其内径减少50%~60%。对照组:不做丝线结扎,其余处理同实验组。
1.3 观察指标 1.3.1 血压测量两组兔分别于术前及术后第2、4、6、8周进行血压测量。使用小号封闭式留置静脉针穿刺耳中动脉,穿刺成功后连接压力换能器,将压力换能器与监护仪血压模块连接,测量血压。
1.3.2 超声检查两组兔分别于术前及术后第2、4、6、8周进行腹部血管和心脏超声检查。动物以20%乌拉坦10 mL/kg腹腔麻醉后置于检查床,剔除胸和侧腹部兔毛。开启血管模式,兔右侧卧位,分别测量狭窄部位、狭窄上段及狭窄下段血管内径和血流速度。而后转换成心脏模式,兔仰卧位,测量室间隔及左心室下后壁厚度、左心室收缩和舒张末期内径、心功能等参数,均测量3次取其平均值。
1.3.3 描记ECG分别于术前及术后第2、4、6、8周做ECG检查。麻醉后将兔于仰卧位固定于兔台上,针状电极刺于兔的皮下,电极位置与人描计ECG位置大体相同,并用记号笔标记,保证每次ECG描记部位固定。调节走纸速度为50 mm/s,定标电压10 mm/mV或20 mm/mV,待基线平稳后描记12导联ECG。测量不同时间点各个导联R波振幅、QRS波振幅、心电轴、QRS波时限、QT间期及按心率校正的QT间期(QTc)。
1.3.4 X线胸片检查实验组和对照组兔分别于术前和术后第8周行X线胸片检查。于麻醉状态下取仰卧位拍摄X线胸部平片,测量心胸比值。
1.3.5 病理检查实验组和对照组兔在第8周其他检查结束后,称体质量,之后空气栓塞法处死。游离心脏,用冷生理盐水快速冲洗,留取左心室,吸水纸吸干后快速用电子天平称质量并记录。切取室间隔、左心室前壁及后壁组织块,4%多聚甲醛固定,石蜡包埋并切片,H-E染色,光镜下观察。
1.4 统计学处理采用SPSS 17.0软件进行统计学分析。计量资料以x±s表示,配对资料的比较采用配对t检验,重复测量定量资料的比较采用方差分析。若不能满足球形检验,采用校正自由度的Greenhouse-Geisser检验统计量及其对应的P值做统计推断。组内两两比较及组间两两比较采用LSD-t法。检验水准(α)为0.05。
2 结果 2.1 一般情况实验过程中兔死亡3只。资料完整的兔共37只,实验组23只,对照组14只。实验组兔于术后第3周普遍出现精神差、活动少、食量减少及体质量不增,对照组兔假手术后在饲养过程中未见明显异常。
2.2 血压比较术前两组兔血压差异无统计学意义。术后第2、4、6、8周,实验组兔血压逐渐增高,与对照组比较差异有统计学意义(P < 0.05)。对照组兔术后各时间点血压无明显变化。见表 1。
|
|
表 1 实验组与对照组兔不同时间点血压比较 Tab 1 Comparison of the blood pressure in rabbits at different time points between experimental group and control group |
2.3 超声测量值比较 2.3.1 腹主动脉超声检查比较
实验组兔腹主动脉缩窄程度基本恒定,缩窄部位与对照组相比血流速度明显加快。缩窄远端血管内径术后逐渐增大,血流速度低于狭窄处,但高于缩窄上段。对照组兔术前及术后腹主动脉内径和血流速度无明显变化。
2.3.2 心脏超声测量值比较实验组与对照组兔术前心脏超声测量指标基线值比较差异无统计学意义。实验组兔左心室收缩和舒张末期内径于术后4周始逐渐增大,6、8周与对照组相比差异有统计学意义(P < 0.05);左心室下壁、后壁及室间隔厚度术后即逐渐增大,4周后与对照组相比差异有统计学意义(P < 0.05);E/A术后逐渐降低,术后4周后与对照组相比差异有统计学意义(P < 0.05);左心室射血分数术后亦逐渐降低,术后8周与对照组相比差异有统计学意义(P < 0.05)。对照组兔术后各指标变化差异均无统计学意义(P>0.05)。见表 2。
|
|
表 2 实验组与对照组兔不同时间点心脏超声测量指标比较 Tab 2 Comparison of the UCG indices in rabbits at different time points between experimental group and control group |
2.4 ECG检查比较
兔ECG大致与人类相似,呈窦性心律,可见P波、QRS波、T波、PR段及ST段,胸导联R/S比值逐渐递增。但受兔心脏在胸腔位置的影响,胸导联R波振幅并非逐渐增加,V1、V2导联R波振幅较高,R/S较大,而V5和V6导联R波振幅较低,同时心电轴变异较大。见图 1A。

|
图 1 兔标准12导联ECG及实验组兔术前及术后ECG Fig 1 Standard 12-lead ECG and ECG before and after operation of rabbits in experimental group A: Standard 12-lead ECG of rabbits; B: Limb lead ECG of rabbits in experimental group; C: Chest lead ECG of rabbits in experimental group. ECG: Electrocardiogram |
2.4.1 各导联R波振幅的变化
术前两组兔各导联R波振幅差异无统计学意义。实验组Ⅱ、Ⅲ、aVF及胸前各导联术后R波振幅逐渐增高(图 1B、1C),术后2周开始与对照组相比差异有统计学意义(P < 0.05);Ⅰ、aVR导联R波振幅有增高趋势,Ⅰ导联2周和6周时R波振幅与对照组比较有统计学意义(P < 0.05),aVR导联4周和8周时与对照组比较差异有统计学意义(P < 0.05);而aVL导联R波振幅逐渐下降,与对照组比较差异有统计学意义(P < 0.05)。对照组术后各导联R波振幅无明显变化。见表 3。
|
|
表 3 实验组与对照组兔不同时间12导联ECG R波振幅比较 Tab 3 Comparison of R-wave amplitudes in 12-lead ECG in rabbits at different time points between experimental group and control group |
2.4.2 QRS波振幅的变化
术前两组兔各导联QRS波振幅差异无统计学意义。实验组Ⅱ、Ⅲ、aVF和胸前各导联QRS波振幅呈逐渐增高趋势(图 1B、1C),术后2周开始即与对照组相比差异有统计学意义(P < 0.05);aVR导联QRS波振幅有增高趋势,6周和8周时与对照组比较差异有统计学意义(P < 0.05);Ⅰ导联QRS波振幅无明显增高趋势,术后4周振幅略有降低,与对照组比较差异有统计学意义(P < 0.05)。对照组术后各导联QRS波振幅无明显变化。见表 4。
|
|
表 4 实验组与对照组兔不同时间点12导联ECG QRS波振幅比较 Tab 4 Comparison of the QRS complex wave amplitude in 12-lead ECG in rabbits at different time pointsbetween experimental group and control group |
2.4.3 QRS波时限和QTc变化
术前两组兔QRS波时限和QTc差异无统计学意义。实验组QRS波时限和QTc呈逐渐递增趋势,术后4、6和8周与对照组相比差异均有统计学意义(P < 0.05)。对照组术后QRS波时限和QTc无明显变化。见表 5。
|
|
表 5 实验组与对照组兔QRS波时限和QTc变化 Tab 5 Comparison of QRS duration and QTc in rabbits at different time points between experimental group and control group |
2.5 X线胸片比较
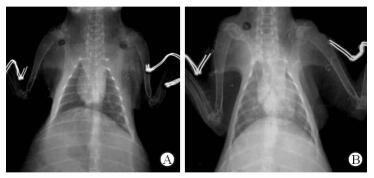
X线胸片见大部分兔心影稍偏左,与人类相似,小部分兔心影稍偏右或居中。术前实验组和对照组兔心胸比值差异无统计学意义(0.33±0.15 vs 0.34±0.14)。实验组术后8周兔心胸比值高于术前(0.55±0.16 vs 0.33±0.15, t=2.819,P < 0.05; 图 2),对照组心胸比值术前、术后无明显变化(0.34±0.14 vs 0.33±0.12)。
|
图 2 实验组兔术前(A)及术后8周(B) X线胸片 Fig 2 Comparison of the chest X-ray of rabbits before (A) and 8 weeks after operation (B) in experimental group |
2.6 左心室质量指数比较
左心室质量指数即左心室质量与体质量的比值。实验组及对照组左心室质量指数分别为(1.45±0.36) g/kg和(1.02±0.28) g/kg,实验组左心室质量指数高于对照组(t=2.719, P=0.01)。
2.7 心肌组织病理染色比较光镜下可见,对照组兔心肌细胞大小正常,排列整齐,走行方向一致,胞核呈椭圆形,居中,间质无明显增生(图 3A);实验组兔心肌细胞体积增大,细胞间隙增宽,部分心肌细胞溶解、断裂,部分出现空泡,脂肪变性,间质纤维增生(图 3B)。

|
图 3 对照组(A)和实验组(B)心肌组织病理学比较 Fig 3 Comparison of myocardial tissue pathology between control group (A) and experimental group (B) Original magnification: ×200 |
3 讨论
UCG是诊断LVH的重要手段。UCG能够评价左心室的切面构型,测量左心室舒缩末期内径、室壁厚度等,并结合彩色多普勒技术进一步了解心脏的舒缩及射血功能。本研究中,实验组兔于术后第3周普遍出现精神差、活动少、食量减少和体质量不增,术后兔血压逐渐上升,心胸比值增加,左心室质量指数增大,病理见心肌细胞肥大、部分变性或坏死,说明造模成功。腹主动脉缩窄术后,左心室下壁、后壁及室间隔均逐渐增厚,从术后第4周开始与对照组相比差异有统计学意义;左心室舒缩末期内径于术后第6周逐渐增大,与对照组相比差异有统计学意义。提示术后4周内心脏表现为向心性肥厚,第6周后逐渐出现离心性肥厚,同以往研究[6]一致。
腹主动脉缩窄术后,E/A逐渐降低。提示随着左心室壁增厚,室壁僵硬,顺应性降低,出现左心室舒张功能下降。左心室射血分数术后虽逐渐减小,但各时间点均未小于50%,提示心脏收缩能力基本正常。在高血压早期,可能受神经-体液因素影响,儿茶酚胺分泌增多,使心肌收缩力增强,左心室射血分数并不会显著减小[7]。
ECG由于检查费用不高且方便,是诊断LVH所广泛采用的方法之一。高血压性LVH可引起相应的心电学重塑,反映在心电图上,可产生诸多变化,如QRS波振幅增高、电轴左偏、ST-T改变、QRS波时限增加、QTc延长、P波增宽、PTFV1负值增大及室壁激动时间增加等[8]。考虑到实验过程中,兔心电轴的多变性,V1导联P波变化和ST-T改变并不明显,以及室壁激动时间的测量误差较大,本研究主要针对QRS波振幅和时限、以及QTc的变化进行分析,探究三者在高血压性LVH过程中的变化规律。本研究发现,Ⅱ、Ⅲ、aVF及胸前各导联R波振幅和QRS波振幅均呈逐渐增高趋势,从术后第2周开始即与对照组差异有统计学意义。究其原因,可能是因为在LVH发展过程中,左心室质量、表面积、心腔内血容量的增加以及扩大的心室到胸壁的距离变短,导致QRS波振幅增大[9]。LVH时,心脏向左下方扩大。当QRS向量环向下方偏移时,投影在Ⅱ、Ⅲ和aVF导联的正侧,这些导联可出现高R波[8]。当QRS环向左增大时,结合兔X线胸片可知,兔的心脏大部分居中,少数稍偏左或右,V1、V2导联已位于室间隔,相当于人类V3、V4导联的位置,V5、V6导联已远离左心室,QRS环的左向偏移必将引起胸前导联尤其是V5、V6导联R波振幅的增高。可能由于兔心脏在胸腔位置及转位等原因,与人类存在一定差异,标准Ⅰ、aVL导联R波振幅和QRS波振幅未呈现明显变化,而aVR导联却略有增高。
本实验中,实验组兔QRS波时限和QTc呈逐渐递增趋势,从术后第4周开始与对照组相比显著延长。LVH时,QRS波时限增宽,可能是因为左心室壁增厚,从心内膜向心外膜除极时间延长,或存在传导系统的损伤导致传导时间延长。同时心脏复极时间也相应延长,从而引起QTc延长。吴婧[10]通过测量小鼠ECG,同样发现LVH早期可出现QRS波时限和QTc明显延长。而QRS波时限和QTc延长具有重要的临床意义。Oikarinen等[11]发现,在校正了治疗策略和其他的影响因素后,QRS波时限延长是全因死亡和心血管死亡的独立预测因素。也有研究表明,QTc延长是心脏性猝死和卒中的独立危险因素[12-15]。
ECG反映心脏的电学改变,UCG反映心脏的形态学改变。研究表明,血液动力学、儿茶酚胺和醛固酮等致高血压性LVH因素能影响心肌细胞的离子通道特性,在较短的时间内使其发生电学重塑,进而使ECG参数发生变化[16-18]。而UCG检测的结构性LVH,是由于血流动力学负荷、神经激素的激活和其他因素的长期作用造成的[19]。在高血压发展过程中,左心室经历由正常构型到向心性肥厚,再到离心性肥厚的发展过程[20]。由此可推测高血压LVH所致ECG电学改变早于UCG反映的结构变化。本研究表明,腹主动脉缩窄术后,UCG所测量的参数,如左心室下壁、后壁和室间隔从术后第4周始显著增厚。然而ECG指标,如Ⅱ、Ⅲ和aVF导联以及胸前导联R波振幅和QRS波振幅,从术后第2周就开始显著增大。证实LVH所致ECG变化早于UCG的结构改变,Ⅱ、Ⅲ和aVF导联以及胸前导联的R波振幅和QRS波振幅可作为心电图早期判断LVH的指标。
综上,本研究以日本大耳白兔为研究对象,通过ECG和UCG参数对比分析,发现高血压致LVH早期即可引起ECG多导联R波振幅和QRS波振幅增大,QRS波时限和QTc延长。高血压致LVH过程中,ECG电学改变早于UCG反映的结构改变,ECG对高血压性LVH具有一定的早期诊断价值。
| [1] | KRAUSER D G, DEVEREUX R B. Ventricular hypertrophy and hypertension:prognositic elements and implications for management[J]. Herz, 2006, 31: 305–316. DOI: 10.1007/s00059-006-2819-5 |
| [2] | HAWKINS N M, WANG D, MCMURRAY J J, PFEFFER M A, SWEDBERG K, GRANGER C B, et al. Prevalence and prognostic implications of electrocardiographic left ventricular hypertrophy in heart failure:evidence from the CHARM programme[J]. Heart, 2007, 93: 59–64. DOI: 10.1136/hrt.2005.083949 |
| [3] | MATHEW J, SLEIGHT P, LONN E, JOHNSTONE D, POGUE J, YI Q, et al. Reduction of cardiovascular risk by regression of electrocardiographic markers of left ventricular hypertrophy by the angiotensin-converting enzyme inhibitor ramipril[J]. Circulation, 2001, 104: 1615–1621. DOI: 10.1161/hc3901.096700 |
| [4] | LEVY D, SALOMON M, D'AGOSTINO R B, BELANGER A J, KANNEL W B. Prognostic implications of baseline electrocardiographic features and their serial changes in subjects with left ventricular hypertrophy[J]. Circulation, 1994, 90: 1786–1793. DOI: 10.1161/01.CIR.90.4.1786 |
| [5] | OKIN P M, DEVEREUX R B, JERN S, KJELDSEN S E, JULIUS S, NIEMINEN M S, et al. Regression of electrocardiographic left ventricular hypertrophy during antihypertensive treatment and the prediction of major cardiovascular events[J]. JAMA, 2004, 292: 2343–2349. DOI: 10.1001/jama.292.19.2343 |
| [6] | 赵康.速度向量成像技术评价腹主动脉缩窄致高血压兔模型心功能演变的实验研究[D].长沙:中南大学, 2010:18-20. |
| [7] | 汪荣荣, 蒋廷波, 薛枫. 高血压心脏病的超声心动图诊断[J]. 浙江医学, 2014, 36: 528–529. |
| [8] | 郭继鸿. 心电图学[M]. 北京: 人民卫生出版社, 2002: 148-151. |
| [9] | SURAWICZ B, KNILANS T K.周氏实用心电图学[M].郭继鸿, 洪江, 译.北京:北京大学医学出版社, 2014:47-48. |
| [10] | 吴婧.压力超负荷性心肌肥厚、心衰发展过程中清醒小鼠心电图的变化[D].石家庄:河北医科大学, 2006:34-37. |
| [11] | OIKARINEN L, NIEMINEN M S, VⅡTASALO M, TOIVONEN L, JERN S, DAHL F B, et al. QRS duration and QT interval predict mortality in hypertensive patients with left ventricular hypertrophy:the Losartan Intervention for Endpoint Reduction in Hypertension Study[J]. Hypertension, 2004, 43: 1029–1034. DOI: 10.1161/01.HYP.0000125230.46080.c6 |
| [12] | PANIKKATH R, REINIER K, UY-EVANADO A, TEODORESCU C, GUNSON K, JUI J, et al. Electrocardiographic predictors of sudden cardiac death in patients with left ventricular hypertrophy[J]. Ann Noninvasive Electrocardiol, 2013, 18: 225–229. DOI: 10.1111/anec.12003 |
| [13] | HAUGAA K H, BOS J M, BORKENHAGEN E J, TARRELL R F, MORLAN B W, CARABALLO P J, et al. Impact of left ventricular hypertrophy on QT prolongation and associated mortality[J]. Heart Rhythm, 2014, 11: 1957–1965. DOI: 10.1016/j.hrthm.2014.06.025 |
| [14] | SOLIMAN E Z, SHAH A J, BOERKIRCHER A, LI Y, RAUTAHARJU P M. Inter-relationship between electrocardiographic left ventricular hypertrophy and QT prolongation as predictors of increased risk of mortality in the general population[J]. Circ Arrhythm Electrophysiol, 2014, 7: 400–406. DOI: 10.1161/CIRCEP.113.001396 |
| [15] | ISHIKAWA J, ISHIKAWA S, KARIO K. Prolonged corrected QT interval is predictive of future stroke events even in subjects without ECG-diagnosed left ventricular hypertrophy[J]. Hypertension, 2015, 65: 554–560. DOI: 10.1161/HYPERTENSIONAHA.114.04722 |
| [16] | AHMMED G U, DONG P H, SONG G, BALL N A, XU Y, WALSH R A, et al. Changes in Ca cycling proteins underlie cardiac action potential prolongation in a pressure-overloaded guinea pig model with cardiac hypertrophy and failure[J]. Circ Res, 2000, 86: 558–570. DOI: 10.1161/01.RES.86.5.558 |
| [17] | CHORVATOVA A, HART G, HUSSAIN M. Na/Ca exchange current (INa/Ca) and sarcoplasmic reticulum Ca release in catecholamine-induced cardiac hypertrophy[J]. Cardiovasc Res, 2004, 61: 278–287. DOI: 10.1016/j.cardiores.2003.11.019 |
| [18] | BOIXEL C, GAVILLET B, ROUGIER J S, ABRIEL H. Aldosterone increases voltage-gated sodium current in ventricular myocytes[J]. Am J Physiol Heart Circ Physiol, 2006, 290: H2257–H2266. DOI: 10.1152/ajpheart.01060.2005 |
| [19] | 詹平, 李金国. 高血压心室重构及其干预策略[J]. 医学综述, 2008, 14: 1507–1509. |
| [20] | 夏稻子, 张宇红, 张文华, 刘晓宁, 薛伟, 胡滨.高血压病左心室重构的超声评价[J/CD].中华医学超声杂志(电子版), 2005, 2:343-346. http://www.cqvip.com/QK/87825X/200506/20926169.html |
 2017, Vol. 38
2017, Vol. 38


