缺血再灌注(ischemia-reperfusion,IR)常见于器官移植、器官部分切除、创伤及休克等病理过程中,IR损伤是指部分器官或组织缺血后再灌注,不仅不能使组织器官功能恢复,反而使缺血所致的功能和代谢障碍及结构破坏进一步加重。如何有效预防和减轻IR损伤越来越受到临床医生的重视。已有研究显示,在肾脏、肝脏、心脏等IR损伤模型中,均可观察到低剂量脂多糖(lipopolysaccharide,LPS)预处理可减轻器官IR损伤这一现象[1-3],但其机制仍不明确。
热休克蛋白27(heat shock protein-27,HSP27)是一种抗凋亡蛋白,能减轻细胞的坏死,在稳定纤维型肌动蛋白细胞骨架中起关键作用[4-5]。肾脏由于其血流高灌注的特性,IR损伤发生率较高,我们既往研究证明上调HSP27的表达能显著改善小鼠肾脏IR损伤[6]。据此我们推测在LPS预处理减轻器官IR损伤的机制中,HSP27可能起了关键作用。本研究拟在小鼠肾IR模型中探索HSP27参与LPS减轻IR损伤的可能性。
1 材料和方法 1.1 主要试剂及仪器HSP27抗体(1:500, #2442)购于Cell Signaling Technology公司,β-actin抗体购于Santa Cruz Biotechnology公司;PCR引物购于TaKaRa公司;caspase-3活性比色法检测试剂盒购于Millipore公司;槲皮素(quercetin)购于上海碧云天生物技术有限公司。
1.2 实验动物及分组雄性C57BL/6小鼠(SPF级)购自中国科学院上海实验动物中心,动物生产许可证号:SCXK (沪)2012-0002。8~10周龄,体质量20~28 g。清洁环境下自由进食、饮水、12 h/12 h昼夜规律。
小鼠随机分为4组:假手术组、LPS+假手术组、肾IR组和LPS+肾IR组,每组又分为槲皮素(200 mg/kg)亚组和溶剂对照亚组,每亚组8只小鼠。
1.3 肾IR动物模型制作及给药方法肾IR组小鼠切除右侧肾脏,用无损伤血管夹(蛇牌钛合金微血管夹,Aesculap公司,德国)夹闭左侧肾蒂25 min后开放,随后关腹;假手术组仅切除右侧肾脏而不夹闭左侧肾蒂,开放腹腔25 min后关腹。LPS+假手术组、LPS+肾IR组于IR造模前3 d给予LPS (3 mg/kg)腹腔内注射,假手术组和肾IR组注射相同剂量的溶剂(生理盐水)。槲皮素亚组采用灌胃的方式给予槲皮素(200 mg/kg),溶剂对照亚组灌注相同剂量的溶剂(生理盐水);给药时间为IR造模前3 d。
1.4 肾IR损伤后肾功能检测小鼠再灌注后24 h经腹主动脉采血,用德灵全自动生化仪测定小鼠血清肌酐(Cr)和尿素氮(BUN)水平。
1.5 实时定量RT-PCR检测炎症因子和HSP27 mRNA的表达小鼠再灌注后24 h取左肾标本,行实时定量RT-PCR,以β-actin为参照,得出TNF-α、IL-6、IL-10及HSP27的mRNA相对表达量,实验重复3次。
1.6 蛋白质印迹法检测HSP27蛋白的表达小鼠再灌注后24 h取左肾标本,行蛋白质印迹分析,以β-actin为参照, 得出HSP27在蛋白水平的相对表达量,实验重复3次。
1.7 Caspase-3活性测定按试剂盒说明,将肾组织用磷酸盐缓冲液洗涤后,置入玻璃匀浆机,加入细胞裂解液,然后加入caspase-3四肽荧光底物Ac-DEVD-AMC,于37 ℃下反应1 h,用荧光分光光度计分析荧光强度,激发光波长380 nm,发射光波长430~460 nm。
1.8 肾组织病理学检查小鼠再灌注后24 h取左肾组织,以10%中性甲醛固定,脱水后进行石蜡包埋,切片厚度为5 μm,进行PAS染色,显微镜下观察肾脏病理改变。
1.9 统计学处理采用SPSS 11.0软件进行统计分析,各数据采用x±s表示,组间均数比较采用单因素方差分析,检验水准(α)为0.05。
2 结果 2.1 LPS上调肾脏HSP27 mRNA和蛋白表达水平相比假手术组,LPS预处理或IR损伤均能明显上调肾脏内HSP27的mRNA和蛋白表达水平,而且LPS+IR能更进一步增加HSP27的表达(P < 0.05, 图 1A)。
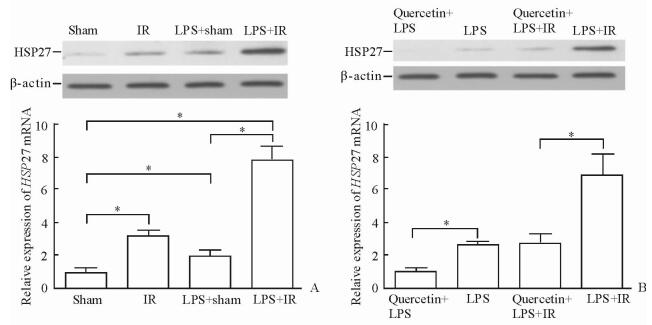
|
图 1 LPS (A)和槲皮素(B)对肾脏HSP27蛋白(上)和mRNA (下)表达的影响 Fig 1 Effect of LPS (A) and quercetin (B) on expression of HSP27 protein (upper) and mRNA (lower) in the kidney LPS: Lipopolysaccharide; IR: Ischemia-reperfusion; HSP27: Heat shock protein-27. *P < 0.05. n=8, x±s |
2.2 LPS预处理能明显减轻肾IR损伤
IR能明显损伤小鼠肾脏功能,表现为血清Cr、BUN水平明显升高;与IR组相比,LPS+IR组小鼠的血清Cr、BUN水平均降低(P < 0.05,图 2)。同样,LPS能明显改善肾脏IR损伤后所致的病理损伤,表现为急性肾小管损伤明显减轻(图 3)。另外,LPS预处理降低了IR后肾内炎症介质(TNF-α、IL-1β和IL-6) mRNA的表达,与IR组之间差异有统计学意义(P < 0.05,图 4)。
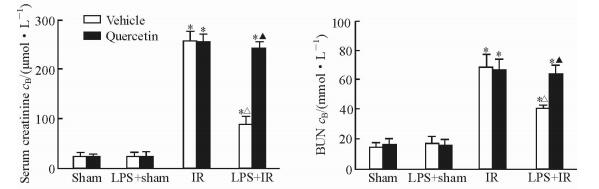
|
图 2 LPS和槲皮素对肾IR后肾功能的影响 Fig 2 Effect of LPS and quercetin on renal function after renal IR LPS: Lipopolysaccharide; IR: Ischemia-reperfusion; BUN: Blood urea nitrogen. *P < 0.05 vs sham group; △P < 0.05 vs IR group; ▲P < 0.05 vs vehicle+LPS+IR group. n=8, x±s |

|
图 3 LPS和槲皮素对肾脏IR后肾脏病理损伤的影响 Fig 3 Effect of LPS and quercetin on renalhistological injury after renal IR LPS:Lipopolysaccharide; IR:Ischemia-reperfusion. PAS-stained renal section, original magnification: ×200 |

|
图 4 LPS和槲皮素对肾IR后肾炎症介质表达的影响 Fig 4 Effect of LPS and quercetin on expression of inflammatory cytokines in the kidney after renal IR LPS: Lipopolysaccharide; IR: Ischemia-reperfusion; TNF-α: Tumor necrosis factor-α; IL-1β: Interleukin-1β; IL-6: Interleukin-6. *P < 0.05.n=8, x±s |
2.3 抑制HSP27能消除LPS对肾脏IR损伤的保护作用
槲皮素(200 mg/kg)能显著抑制HSP27 mRNA和蛋白表达水平(图 1B),可以作为明确的HSP27抑制剂在本研究模型中使用。在对小鼠进行槲皮素预处理后,LPS对小鼠肾脏IR所致的保护作用被消除,LPS+IR组血清Cr和BUN水平有所升高,槲皮素+LPS+IR组的Cr和BUN水平有明显升高(P < 0.05),但其和IR组比较差异无统计学意义(图 2)。同样,槲皮素的使用能显著抵消LPS对肾脏IR损伤后病理损伤的改善作用和炎症介质的降低作用(图 3、4)。
2.4 抑制HSP27能增加肾脏IR所致的凋亡作用LPS预处理能明显抑制肾IR所致的凋亡相关蛋白caspase-3的表达,但槲皮素的使用能抵消这一作用,即上调组织内caspase-3的表达(P < 0.05, 图 5)。

|
图 5 LPS和槲皮素对肾IR后caspase-3表达的影响 Fig 5 Effect of LPS and quercetin on expression ofcaspase-3 in the kidney after renal IR LPS: Lipopolysaccharide; IR: Ischemia-reperfusion. *P < 0.05.n=8, x±s |
3 讨论
LPS又称内毒素,是革兰阴性菌细胞壁中的主要成分,可引起发热、微循环障碍、内毒素休克、播散性血管内凝血及多器官功能衰竭等。然而,近年来的动物实验研究发现,用低剂量LPS预处理不仅能改善随后大剂量LPS所致的内毒素血症,而且能明显减轻器官IR损伤,这一现象在肾脏、肝脏、小肠、脑、心脏等脏器的IR损伤模型中均有发现[1-3],但其机制尚不明确。
HSP27是小分子热休克蛋白(small heat shock protein, sHSP)家族成员,广泛存在于各种组织中。作为一种伴侣蛋白, 其序列高度保守, 能够协助细胞内其他多肽链完成正确的折叠、组装、转运和降解, 在调节细胞迁移、凋亡、收缩、氧化应激状态等方面发挥重要作用,是一种有效的抗凋亡蛋白,能减轻细胞的凋亡[5]。既往的体内、外实验均证实LPS能上调HSP27的表达[7-10]。我们的前期研究成果显示,LPS预处理能激活肾脏内缺氧诱导因子2α的表达,同时输尿管结扎所致的缺氧诱导因子2α激活能上调肾脏内HSP27的表达,继而减轻肾脏IR损伤[1, 10]。因此,我们推测,LPS对肾脏IR损伤的保护可能是通过上调HSP27表达实现的。
本研究用LPS预处理肾脏IR损伤小鼠模型,结果显示LPS预处理组小鼠肾功能优于IR组,肾脏病理及炎症因子表达均明显低于IR组,验证了既往研究对LPS在器官IR损伤中保护作用的报道。本研究结果显示,单独运用IR损伤或LPS预处理,均能引起肾脏内HSP27表达增加,而LPS+IR则能更显著增加HSP27的表达。Kim等[11]报道相比于野生型小鼠,HSP27过表达小鼠肾IR损伤有明显减轻,提示HSP27能减轻肾脏IR损伤。据此推测,本研究中LPS预处理联合IR损伤,可能起到了类似HSP27过表达的作用,从而减轻了肾脏的IR损伤。随后,我们通过抑制HSP27的合成来观察LPS预处理是否还能起到肾脏IR损伤保护作用,结果发现给予小鼠HSP27合成抑制剂槲皮素处理后,LPS上调HSP27表达的作用被明显抑制,同时该组小鼠肾脏IR损伤程度显著加重。说明槲皮素抑制HSP27合成后,也抑制了LPS预处理对肾脏IR损伤的保护作用。
在肾IR损伤的众多病理生理机制中,如电解质失衡、激活细胞凋亡机制[12]、氧化应激[13]等,细胞凋亡的作用越来越受到人们的重视。研究发现caspase依赖的细胞凋亡途径在肾脏IR损伤诱导的肾小管上皮细胞凋亡中发挥主要作用[12]。本研究发现LPS能明显降低小鼠IR后凋亡效应蛋白caspase-3的表达,而这一效应通过槲皮素的干预后有明显减弱,提示LPS上调的HSP27可能通过减少凋亡的途径参与对肾脏IR损伤的保护过程。
综上所述,LPS预处理能有效减轻小鼠肾脏IR损伤,而这种保护效应需要关键分子HSP27的参与;另外,LPS/HSP27通路改善小鼠肾脏IR损伤可能与降低肾脏IR后细胞凋亡有关。
| [1] | HE K, CHEN X, HAN C, XU L, ZHANG J, ZHANG M, et al. Lipopolysaccharide-induced cross-tolerance against renal ischemia-reperfusion injury is mediated by hypoxia-inducible factor-2α-regulated nitric oxide production[J]. Kidney Int, 2014, 85: 276–288. DOI: 10.1038/ki.2013.342 |
| [2] | SANO T, IZUISHI K, HOSSAIN M A, INOUE T, KAKINOKI K, HAGⅡKE M, et al. Hepatic preconditioning using lipopolysaccharide:association with specific negative regulators of the Toll-like receptor 4 signaling pathway[J]. Transplantation, 2011, 91: 1082–1089. DOI: 10.1097/TP.0b013e31821457cb |
| [3] | NADER N D, ASGERI M, DAVARI-FARID S, POURAFKARI L, AHMADPOUR F, PORHOMAYON J, et al. The effect of lipopolysaccharide on ischemic-reperfusion injury of heart:a double hit model of myocardial ischemia and endotoxemia[J]. J Cardiovasc Thorac Res, 2015, 7: 81–86. DOI: 10.15171/jcvtr.2015.19 |
| [4] | HUOT J, HOULE F, SPITZ D R, LANDRY J. HSP27 phosphorylation-mediated resistance against actin fragmentation and cell death induced by oxidative stress[J]. Cancer Res, 1996, 56: 273–279. |
| [5] | BAKTHISARAN R, TANGIRALA R, RAO Ch M. Small heat shock proteins:role in cellular functions and pathology[J]. Biochim Biophys Acta, 2015, 1854: 291–319. DOI: 10.1016/j.bbapap.2014.12.019 |
| [6] | ZHANG S, HAN C H, CHEN X S, ZHANG M, XU L M, ZHANG J J, et al. Transient ureteral obstruction prevents against kidney ischemia/reperfusion injury via hypoxia-inducible factor (HIF)-2α activation[J/OL]. PLoS One, 2012, 7:e29876. doi:10.1371/journal.pone.0029876. |
| [7] | RENTON K W, NICHOLSON T E. Hepatic and central nervous system cytochrome P450 are down-regulated during lipopolysaccharide-evoked localized inflammation in brain[J]. J Pharmacol Exp Ther, 2000, 294: 524–530. |
| [8] | LIU J, HONG S, FENG Z, XIN Y, WANG Q, FU J, et al. Regulation of lipopolysaccharide-induced inflammatory response by heat shock protein 27 in THP-1 cells[J]. Cell Immunol, 2010, 264: 127–134. DOI: 10.1016/j.cellimm.2010.05.011 |
| [9] | KOSTENKO S, MOENS U. Heat shock protein 27 phosphorylation:kinases, phosphatases, functions and pathology[J]. Cell Mol Life Sci, 2009, 66: 3289–3307. DOI: 10.1007/s00018-009-0086-3 |
| [10] | CONCANNON C G, GORMAN A M, SAMALI A. On the role of Hsp27 in regulating apoptosis[J]. Apoptosis, 2003, 8: 61–70. DOI: 10.1023/A:1021601103096 |
| [11] | KIM M, PARK S W, KIM M, CHEN S W, GERTHOFFER W T, D'AGATI V D, et al. Selective renal overexpression of human heat shock protein 27 reduces renal ischemia-reperfusion injury in mice[J]. Am J Physiol Renal Physiol, 2010, 299: F347–F358. DOI: 10.1152/ajprenal.00194.2010 |
| [12] | PADANILAM B J. Cell death induced by acute renal injury:a perspective on the contributions of apoptosis and necrosis[J]. Am J Physiol Renal Physiol, 2003, 284: F608–F627. DOI: 10.1152/ajprenal.00284.2002 |
| [13] | 王切, 王素玲, 王磊. 大鼠肾缺血再灌注损伤肝内过氧化酶Ⅰ、过氧化氢酶、细胞外超氧化物歧化酶的表达变化[J]. 解剖学杂志, 2016, 39: 401–405. |
 2017, Vol. 38
2017, Vol. 38


