尿酸酶(uricase,UC)作为治疗高尿酸血症、痛风、肿瘤溶解综合征等疾病[1]的酶类药物,主要是通过在有氧条件下催化尿酸生成尿囊素、二氧化碳和过氧化氢[2]来达到降尿酸作用的。现已上市的UC类药物主要有两大类:基因重组UC和聚乙二醇化UC,但这两类药物均存在各种不良反应[3-4],因此,具有更优治疗效果、更少不良反应的药物依然是研究热点。
多囊脂质体是内部由许多水性囊状腔室构成的非同心大型脂质体[5]。与传统脂质体相比,多囊脂质体有更适于包载水溶性药物、延长药物的作用时间达到缓释效果以及提高药物生物利用度等特点[6]。多囊脂质体不仅用于包载水溶性小分子药物,还可以作为生物大分子如载脂蛋白E[7]、胰岛素[8]、LXT-101[9]等蛋白质、多肽类药物的载体。
本研究制备透明质酸(HA)修饰的UC多囊脂质体(uricase in hyaluronic acid-uricase multivesicular liposomes,UHMVLs),希望能提高UC的活性、增强UC的治疗效果;同时UC多囊脂质体经HA修饰以后,在降低尿酸水平的同时靶向到透明质酸受体CD44和CD168,起到保护关节和抗炎的作用[10-11];而且HA还可通过促进内源性HA合成来改善病理性关节液的性状,达到持续缓解痛风性关节炎症状和病情的作用[12-15]。目前尚无对UHMVLs的相关报道,本研究考察UHMVLs的体外特性及其在大鼠体内的药效学过程,为UHMVLs的进一步研究提供参考依据。
1 材料和方法 1.1 主要材料和试剂UC (Sigma-Aldrich,批号:SLBC3289,生物试剂);大豆卵磷脂(德国LucasMeyer公司,批号:20120706,生物试剂);胆固醇(广州天马精细化工厂,批号:20110307,分析纯);1-乙基-3-[3-(二甲胺基)丙基]碳化二亚胺盐酸盐(成都格雷西亚化学技术有限公司,分析纯);N, N-二羟乙基甘氨酸(Bicine,美国Amresco公司,批号:20120614,分析纯);尿酸测定试剂盒(南京建成生物工程研究所);氢氧化钠、氯仿、乙醚(重庆川东化工集团有限公司,分析纯)。
1.2 主要仪器与动物RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);UV-7504PC紫外分光光度计(上海欣茂仪器有限公司);SHZ-D (Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司);KQ-2200B型水浴型超声仪(江苏昆山市超声仪器有限责任公司);Nano-ZS90型马尔文粒径测定仪(英国马尔文公司);AG-135型电子分析天平(梅特勒-托利多仪器上海有限公司)。
雄性SD大鼠,体质量(230±20) g,由重庆医科大学实验动物中心提供,许可证号:SCXK (渝)2015-0001。
1.3 UHMVLs的制备称取适量卵磷脂、胆固醇、三油酸甘油酯,加入适量乙醚使其充分溶解,再加入等体积的3%葡萄糖溶液涡旋形成油包水型初乳。使用注射器将初乳快速注入10 mL含L-赖氨酸的4%葡萄糖水溶液中,用高速分散均质机剪切得到复乳。将复乳转移至磨口圆底烧瓶,减压旋蒸除去有机溶剂。将适量HA的Bicine-NaOH溶液在pH 6.0条件下用1-乙基-3-[3-(二甲胺基)丙基]碳化二亚胺盐酸盐在37 ℃孵育预活化[16]。将已激活的HA加入到复乳溶液中,调节pH为8.5,并在37 ℃条件下与复乳溶液进行孵化。将脂质体从过量的试剂和副产物中离心分离,即得UHMVLs。
1.4 UC活性测定方法的建立参照Tan等[17]的方法,用硼酸-硼砂缓冲液(pH 8.5,50 mmol/L)配制75 μmol/L的尿酸溶液作为测定UC活性的底物,在1.18 mL尿酸溶液中加入20 μL UC,快速混匀后,在293 nm处测定紫外吸收值。
1.5 UHMVLs参数的测定 1.5.1 形态和粒径分布取适量UHMVLs混悬液置于载玻片上,使用光学显微镜观察形态并拍照。使用测微尺测定UHMVLs的粒径分布[18],每次微粒计数量为500个以上,计数3次。
1.5.2 包封率采用葡聚糖凝胶柱分离-考马斯亮蓝法[19]测定包封率。吸取0.5 mL的UHMVLs,上Sephadex G-200层析柱,用Bicine-NaOH缓冲液(pH 8.5)以1 mL/min的流速洗脱分离UHMVLs和UC。接收UHMVLs部分,取100 μL加入乙醚提取UC后,再加入考马斯亮蓝,测定在595 nm波长处的紫外吸收值。以相同方法处理未过柱的UHMVLs,计算包封率,重复3次。
1.5.3 最适温度将尿酸溶液分别在20、30、40、50、60、70 ℃水浴条件下预热,10 min后在室温(25 ℃)条件下分别测定游离UC和UHMVLs中UC的活性。
1.5.4 最适pH将pH 6.5、7.0、7.5、8.0、8.5、9.0、9.5的尿酸溶液放置于40 ℃水浴中预热10 min,测定游离UC和UHMVLs中UC的活性。
1.5.5 血浆稳定性取相同浓度的UC和UHMVLs各500 μL,分别与适量的含10%胎牛血清的空白血浆混合,于37 ℃下孵育0、1、2、4、6、8、12、24、48 h,分别测定游离UC和UHMVLs中UC活性。
1.6 药效学研究将大鼠随机分为4组,每组3只。设正常对照组、高尿酸血症对照组、UC组和UHMVLs组。后3组大鼠按照500 mg/kg剂量一次性灌胃2 mL次黄嘌呤后,以100 mg/kg剂量皮下注射氧嗪酸钾,建立高尿酸血症大鼠模型[20]。
造模成功1 h后,UC组和UHMVLs组大鼠分别尾静脉注射470 mU游离UC和UHMVLs。高尿酸血症对照组、UC组和UHMVLs组于造模后1、2、3、4、5、7、9、12、24、36、48 h分别从大鼠眼眶静脉取血0.2 mL,空白对照组直接眼眶下静脉取血0.2 mL,离心,取血清。使用尿酸测定试剂盒测定血清中的尿酸含量。
1.7 统计学处理根据所测结果绘制尿酸浓度-时间曲线,用DAS2.1.1软件计算药代动力学参数。计量数据以x±s表示,组间比较采用配对样品t检验,检验水准(α)为0.05。
2 结果 2.1 形态和粒径分布通过光学显微镜观察到UHMVLs为圆球形,大小相对均匀,见图 1。UHMVLs的平均粒径为(23.1±1.7) μm。

|
图 1 UHMVLs的光学显微镜图 Fig 1 Micrograghs of UHMVLs UHMVLs: Uricase in hyaluronic acid-uricase multivesicular liposomes. Original magnification: ×400 |
2.2 包封率
制备的3批UHMVLs的平均包封率为(62.48±3.87)%(n=3)。
2.3 最适温度结果见图 2A。游离UC和UHMVLs最适温度皆为40 ℃。在温度20~70 ℃时,UHMVLs中UC活性均较游离UC的高(P < 0.05)。结果表明,UHMVLs能提高UC的活性,可能是因为UHMVLs的包裹改变了UC的构象,使UC的生物活性增强。

|
图 2 UC和UHMVLs的最适温度(A)、最适pH (B)和血浆稳定性(C) Fig 2 Optimum temperature (A), pH (B) and plasma stability (C) of free UC and UHMVLs UC: Uricase; UHMVLs: Uricase in hyaluronic acid-uricase multivesicular liposomes. *P < 0.05 vs UC group. n=3, x±s |
2.4 最适pH
结果见图 2B。在40 ℃时,游离UC和UHMVLs的最适pH值分别为8.5和8.0。pH6.5~9.5,UHMVLs中UC的活性均较游离UC的活性高(P < 0.05)。结果表明UHMVLs能提高UC的活性。
2.5 血浆稳定性结果见图 2C。除0 h外各时间点UHMVLs组中UC活性均高于UC组(P < 0.05),在37 ℃血浆中UC保留50%初始活性的时间约为8.53 h,而UHMVLs保留50%初始活性的时间约为35.41 h。可见将UC制备成UHMVLs提高了UC的血浆稳定性。
2.6 游离UC和UHMVLs的体内药效学特性由图 3可知,建模后高尿酸血症对照组、UC组和UHMVLs组大鼠尿酸水平与正常对照组尿酸水平相比均升高(P < 0.05),UHMVLs组大鼠血清中尿酸约3 h达到最高浓度,之后开始下降,约9 h时降至正常对照组水平,说明UHMVLs对高尿酸血症大鼠模型降尿酸效果明显。而UC组和高尿酸血症对照组达到最高尿酸浓度的时间延迟为4 h,并且尿酸浓度降低至正常水平的时间延至36 h。UC组最高尿酸浓度低于高尿酸血症对照组,但两组尿酸浓度降至正常水平的时间接近,说明尾静脉注射UC后大鼠血清尿酸水平下降不明显。总之,UHMVLs在很大程度上降低了尿酸浓度,2~24 h UHMVLs降低高尿酸血症大鼠模型血清中尿酸水平的效果较游离UC更显著(P < 0.05)。
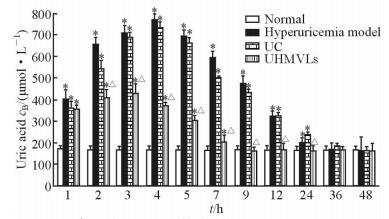
|
图 3 高尿酸血症大鼠静脉注射UC和UHMVLs后血清中的尿酸浓度 Fig 3 Concentrations of serum uric acid in rats with hyperuricemiaafter intravenous injection of free UC and UHMVLs UC: Uricase; UHMVLs: Uricase in hyaluronic acid-uricase multivesicular liposomes. *P < 0.05 vs normal group; △P < 0.05 vs UC group. n=3, x±s |
3 讨论
UC作为蛋白质类药物,具有生物大分子类药物的固有缺点,即稳定性差(分子结构易受环境影响)、代谢半衰期短(需多次给药),增加给药次数不仅影响患者的用药顺应性,还给患者增加了经济负担。多囊脂质体具有良好的缓释效应,且在载药和释药过程中不影响药物结构,以原形释药保证药物活性[6]。
本实验测定了UC和UHMVLs的最适温度、最适pH,结果表明UHMVLs较UC更能有效发挥酶促反应。UHMVLs和游离UC的最适温度均为40 ℃,在20~70 ℃时UHMVLs中UC的活性均较游离UC高(P < 0.05)。在pH为6.5~9.5时,UHMVLs中UC的活性较游离UC高(P < 0.05),且UHMVLs的最适pH值由游离UC的8.5变为8.0,更接近于人体血浆pH值。UHMVLs延长了UC在血浆中的半衰期,增强了UC在血浆中的稳定性。
本实验采用氧嗪酸钾成功构建了大鼠高尿酸血症模型,对UHMVLs进行体内初步药效学研究。结果显示,静脉注射游离UC和UHMVLs后,UHMVLs组大鼠血清尿酸下降速度和程度均快于游离UC组模型大鼠。与游离UC相比,UHMVLs表现出较高的活性,能更有效降低高尿酸血症大鼠模型血清中的尿酸水平。本实验为UHMVLs的进一步研究提供了依据。
| [1] | DONISELLI N, MONZEGLIO E, DAL PALÙA, MERLI A, PERCUDANI R. The identification of an integral membrane, cytochrome C urate oxidase completes the catalytic repertoire of a therapeutic enzyme[J/OL]. Sci Rep, 2015, 5:13798. doi:10.1038/srep13798. |
| [2] | FREITAS DDA S, SPENCER P J, VASSAO R C, ABRAHAO-NETO J. Biochemical and biopharmaceutical properties of PEGylated uricase[J]. Int J Pharm, 2010, 387(1/2): 215–222. |
| [3] | ALLEN K C, CHAMPLAIN A H, COTLIAR J A, BELKNAP S M, WEST D P, MEHTA J, et al. Risk of anaphylaxis with repeated courses of rasburicase:a Research on Adverse Drug Events and Reports (RADAR) project[J]. Drug Saf, 2015, 38: 183–187. DOI: 10.1007/s40264-014-0255-7 |
| [4] | 刘永贵, 赵丽嘉, 崔艳丽, 贺星, 沈雪砚, 陈常青. 抗高尿酸血症药物研究进展[J]. 现代药物与临床, 2015, 30: 345–350. |
| [5] |
雷婷婷, 罗文, 赵华, 何丹, 张景勍. 溴新斯的明多囊脂质体在大鼠体内的药动学研究[J]. 第二军医大学学报, 2015, 36: 459–462.
LEI T T, LUO W, ZHAO H, HE D, ZHANG J Q. Pharmacokinetics of neostigmine bromide multivesicular liposomes in rats[J]. Acad J Sec Mil Med Univ, 2015, 36: 459–462. DOI: 10.3724/SP.J.1008.2015.00459 |
| [6] | 李晗, 梅兴国. 多囊脂质体递送蛋白质/多肽类药物的研究进展[J]. 中国药学杂志, 2014, 49: 94–98. |
| [7] | RAMPRASAD M P, ANANTHARAMAIAH G M, GARBER D W, KATRE N V. Sustained-delivery of an apolipoprotein E-peptidomimetic using multivesicular liposomes lowers serum cholesterol levels[J]. J Control Release, 2002, 79: 207–218. DOI: 10.1016/S0168-3659(01)00552-1 |
| [8] | JAIN A K, CHALASANI K B, KHAR R K, AHMED F J, DIWAN P V. Muco-adhesive multivesicular liposomes as an effective carrier for transmucosal insulin delivery[J]. J Drug Target, 2007, 15: 417–427. DOI: 10.1080/10611860701453653 |
| [9] | 王涛.LXT-101多囊脂质体研究[D].北京:中国人民解放军军事医学科学院, 2010. http://cdmd.cnki.com.cn/Area/CDMDUnitArticle-90106-2010-2.htm |
| [10] | KATRE N V. Liposome-based depot injection technologies[J]. Am J Drug Deliv, 2004, 2: 213–227. DOI: 10.2165/00137696-200402040-00002 |
| [11] | KIM S. 7-DepoFoam-mediated drug delivery into cerebrospinal fluid[J]. Methods Neurosci, 1994, 21: 118–131. DOI: 10.1016/B978-0-12-185291-7.50013-8 |
| [12] | ASARI A, MIYAUCHI S, MATSUZAKA S, ITO T, KOMINAMI E, UCHIYAMA Y. Molecular weight-dependent effects of hyaluronate on the arthritic synovium[J]. Arch Histol Cytol, 1998, 61: 125–135. DOI: 10.1679/aohc.61.125 |
| [13] | GHOSH P. The role of hyaluronic acid (hyaluronan) in health and disease:interactions with cells, cartilage and components of synovial fluid[J]. Clin Exp Rheumatol, 1994, 12: 75–82. |
| [14] | MONFORT J, NACHER M, MONTELL E, VILA J, VERGES J, BENITO P. Chondroitin sulfate and hyaluronic acid (500-730 kDa) inhibit stromelysin-1 synthesis in human osteoarthritic chondrocytes[J]. Drugs Exp Clin Res, 2005, 31: 71–76. |
| [15] | 方奕巍, 尹宗宁. 透明质酸修饰的白蛋白纳米粒的制备及抗肿瘤作用的初步评价[J]. 四川大学学报(医学版), 2011, 42: 480–484. |
| [16] | 王娜, 赵春景, 黄开顺, 滕永真, 张景勍. 产朊假丝酵母尿酸酶脂质纳米粒的制备及其药效学特性分析[J]. 中国生物制品学杂志, 2013, 26: 1147–1150. |
| [17] | TAN Q, ZHANG J, WANG N, LI X, XIONG H, TENG Y, et al. Uricase from Bacillus fastidious loaded in alkaline enzymosomes:enhanced biochemical and pharmacological characteristics in hypouricemic rats[J]. Eur J Pharm Biopharm, 2012, 82: 43–48. DOI: 10.1016/j.ejpb.2012.06.002 |
| [18] | 邓雪, 何丹, 熊华蓉, 周云莉, 张景勍. 静脉注射尿酸酶多囊脂质体的药代动力学和药效学研究[J]. 四川大学学报(医学版), 2015, 46: 688–691. |
| [19] |
谢江川, 胡雪原, 晏子俊, 周云莉, 张景勍. 载天冬酰胺酶自组装纳米囊的药动学及生物等效性[J]. 第二军医大学学报, 2016, 37: 690–693.
XIE J C, HU X Y, YAN Z J, ZHOU Y L, ZHANG J Q. Pharmacokinetics and bioequivalence of self-assembly nanocapsules loaded with asparaginase[J]. Acad J Sec Mil Med Univ, 2016, 37: 690–693. |
| [20] | 徐立, 时乐. 次黄嘌呤与氧嗪酸钾不同剂量配伍制备高尿酸血症大鼠模型[J]. 中国药理学与毒理学杂志, 2008, 22: 306–310. |
 2017, Vol. 38
2017, Vol. 38


