2型糖尿病(type 2 diabetes mellitus,T2DM)是由胰岛素抵抗和胰岛β细胞功能失调引起的慢性代谢紊乱综合征,其发病机制目前尚不十分明确,通常认为是由遗传因素和环境因素共同作用的结果。在已报道的约50个与T2DM密切相关的基因当中,细胞周期素依赖性激酶(CDK)5调节亚单位相关蛋白1类似物1(cyclin-dependent kinase 5 regulatory subunit-associated protein 1-like 1, CDKAL1)一直是研究的焦点[1],并已有多篇关于CDKAL1基因rs7756992位点A>G突变与T2DM易感性的报道,然而受样本量大小及种族差异影响,各地区间研究结果不尽相同。本文应用meta分析方法定量评价以往的研究结果,以期获得CDKAL1基因rs7756992 A>G多态性与T2DM易感性关系的综合证据,为T2DM的早期防治提供一定的参考。
1 资料和方法 1.1 资料来源以“基因多态性”“细胞周期素依赖性激酶(CDK)5调节亚单位相关蛋白1类似物1”和“2型糖尿病”为中文主题词检索中国学术期刊全文数据库(CNKI)、万方数据资源系统,以“gene polymorphism”“cyclin-dependent kinase 5 regulatory subunit-associated protein 1-like 1”“CDKAL1”和“type 2 diabetes mellitus”为英文主题词检索EMBASE、PubMed、ScienceDirect等数据库,并辅以文献追溯和手工检索等方法。对CDKAL1基因rs7756992位点单核苷酸多态性和T2DM易感性关系的研究报道始于2007年[1],末次检索为2015年9月,未进行语种限制,摘要和未发表文章不被考虑。
1.2 文献纳入与排除标准纳入标准:(1)以全文形式发表的研究报告;(2)研究对象为临床确诊的T2DM病例;(3)研究类型为病例对照研究,原始文献有严格的对照;(4)各文献提供完整的病例组和对照组中个体基因型的频率分布,可计算二分类数据的比值比(OR)和95%可信区间(95%CI);(5)对照组基因型分布符合Hardy-Weinberg遗传平衡(HWE)定律。排除标准:(1)未设立对照组;(2)剔除信息少或数据不完整而无法利用的文献;(3)同一人群资料的重复研究结果,只保留样本量最多的一篇文献;(4)对照组人群中的被研究位点不符合HWE定律。
1.3 数据提取与质量评价由2名研究者独立提取数据,并经核对,结果存在分歧时通过讨论达成一致。提取的数据包括:第一作者、发表时间、研究人群的种族、T2DM诊断标准、病例组和对照组例数及个体基因型的例数。根据英国牛津循证医学中心评价标准,分别从样本量是否充分、数据是否充分、诊断标准是否清楚、对照组基因型分布是否符合HWE定律、基因检测方法是否合理、病例组与对照组是否具有可比性等多方面对纳入文献进行质量评价。
1.4 统计学处理采用统计学软件Stata 12.0进行分析,检验水准(α)为0.05。采用χ2检验确定对照组基因型频率是否符合HWE定律,P<0.05为不符合HWE定律,予以剔除。采用Q检验及I2检验评价研究间的异质性,如P<0.1则认为各研究存在异质性,I2=25%~49%为轻度异质性,I2=50%~74%为中度异质性,I2=75%~100%为高度异质性。计算二分类数据的OR和95%CI,若各研究间无异质性,采用固定效应模型;若各研究间存在异质性,则采用随机效应模型,并应用meta回归分析异质性来源。合并效应OR值的统计学检验采用Z检验评价,并根据种族、异质性来源进行亚组分析。应用敏感性分析评价结果的稳定性,采用Begger漏斗图及Egger线性回归评价是否存在发表偏倚。
2 结果 2.1 文献基本情况通过检索数据库共获得相关文献35篇,仔细阅读每篇文献后,最终确定入选15篇文献[1-15](表 1);共纳入T2DM病例组24 315例和对照组35 132例,对照组人群基因型分布经检验均符合HWE定律。由于Steinthorsdottir等[1]和Cauchi等[4]在同一文献中进行多次独立研究,因而这15篇文献实际共包括22项研究,其中研究对象为亚洲人群(中国、日本、印度、以色列)的有11项研究[2-10, 12-13],为白种人群(冰岛、丹麦、美国、新西兰、法国、澳大利亚、俄罗斯)的有7项研究[1, 4, 11],为非洲人群(西非、摩洛哥、突尼斯)的有4项研究[1, 4, 14-15]。T2DM诊断标准符合美国糖尿病协会(ADA)诊断标准的有4项研究[1, 4, 9, 12],其余18项研究均符合世界卫生组织(WHO)糖尿病诊断标准[1-8, 10-11, 13-15]。
|
|
表 1 纳入文献的CDKAL1 rs7756992位点A>G基因型的分布特征及文献信息 |
2.2 Meta分析结果
通过将T2DM病例组和健康对照组相比,来确定CDKAL1基因rs7756992 A>G多态性是否与T2DM易感性相关(表 2)。(1)等位基因模型。在总人群、白种人群及亚洲人群中,G等位基因增加T2DM的发生风险(P < 0.01),而在非洲人群中两者之间无统计学关联(图 1)。(2)共显性模型。在总人群、白种人群及亚洲人群中,GG基因型相对AA基因型增加T2DM的发生风险(P < 0.01),而在非洲人群中两者之间无统计学关联;在总人群和白种人群中,AG基因型相对AA基因型增加T2DM的发生风险(P < 0.01),而在亚洲人群和非洲人群中两者之间无统计学关联。(3)显性模型。在总人群、白种人群及亚洲人群中,含有G等位基因的基因型相对AA基因型增加T2DM的发生风险(P < 0.01),而在非洲人群中两者之间无统计学关联。(4)隐性模型。在总人群、白种人群、亚洲人群及非洲人群中,GG纯合基因型相对非GG纯合基因型均增加T2DM的发生风险(P < 0.05)。
|
|
表 2 CDKAL1基因rs7756992位点A>G多态性与T2DM易感性的meta分析 |

|
图 1 CDKAL1基因rs7756992位点A>G多态性与T2DM易感性关联的meta分析森林图(G vs A) a~e:同一文献中的不同研究. T2DM: 2型糖尿病 |
2.3 异质性分析
在各遗传模式下,白种人群及非洲人群各研究间均不存在异质性,而亚洲人群各研究间均存在中、高度异质性。为探索异质性来源,我们对所有基因遗传模式进行了meta回归分析,结果显示OR异质性主要来自于T2DM组的例数大小,为此,按照T2DM组例数大小分为2个亚组(亚组1:T2DM组例数≥1 000,共6项研究;亚组2:T2DM组例数 < 1 000,共5项研究)。亚组分析显示,亚组1中rs7756992 A>G多态性与T2DM易感性在各遗传模式下均存在显著关联(P < 0.01),且各研究间异质性较未分组时明显降低;而在亚组2中未发现rs7756992位点A>G多态性与T2DM易感性之间的相关性,且各研究间异质性较未分组时明显增加(表 3)。
|
|
表 3 CDKAL1基因rs7756992位点A>G多态性与亚洲人群T2DM易感性的meta分析 |
2.4 纳入文献质量分析 2.4.1 敏感性分析
人群未分组时各研究间异质性较大,故根据研究人群分为白种人群、亚洲人群及非洲人群。白种人群与非洲人群不具有异质性,在这两亚组人群研究中对所有纳入文献采取逐一排除的方法进行敏感性分析,结果显示任意一项研究被排除出相应的效应模型后,每组OR值都比较接近并且与总OR值相近;而亚洲人群亚组1各研究间异质性显著降低,采用相同的敏感性分析方法,结果显示剔除前后的结果差异无统计学意义,提示本研究稳定性较好。
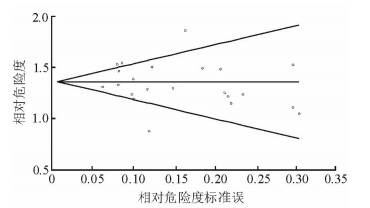
2.4.2 发表偏倚分析采用Begger漏斗图和Egger线性回归法评估发表偏倚,Begger漏斗图显示资料分布基本对称(图 2),Egger线性回归法检验亦未发现明显发表偏倚(t=-2.04,P=0.055)。
|
图 2 CDKAL1基因rs7756992 A>G多态性与2型糖尿病易感性关联的文献发表偏倚漏斗图 |
3 讨论
CDKAL1基因位于人类染色体6p22.3,全长37 kb,编码含539个氨基酸残基的蛋白。CDKLA1在人类胰腺、骨骼肌细胞及脑组织中高度表达,其结构与细胞周期依赖性蛋白激酶5调节亚单位相关蛋白1(cyclin-dependent kinase 5 regulatory subunit associated protein 1, CDK5RAP1)有相似的蛋白质结构域,可特异地抑制CDK5的活化。CDK5是一种丝氨酸/苏氨酸蛋白激酶,CDK5在胰腺组织中通过形成CDK5-P35复合物被激活并抑制胰岛素的分泌,因而其被认为在β细胞功能紊乱所致的糖尿病病理过程中发挥重要作用。CDKLA1基因突变可能导致对CDK5抑制作用的丧失,进而增加罹患T2DM的风险[7];另有研究发现CDKAL1基因敲除小鼠中,胰岛β细胞线粒体存在ATP生成障碍和第一时相胰岛素分泌受损,提示CDKAL1亦可通过非CDK5依赖途径调节β细胞内胰岛素的释放,因而其基因突变也可导致罹患T2DM的风险增加[16]。
2007年全基因组研究发现CDKAL1基因是人类T2DM重要的风险基因之一[17],其中关于CDKAL1基因rs7756992位点A>G多态性与T2DM易感性的研究逐渐成为关注的焦点,然而这些研究存在不一致的结果。本次meta分析结果显示,未分组人群在各遗传模式下,合并OR(95%CI)分别为等位基因模式(G vs A)1.171(1.122, 1.223),共显性模式(GG vs AA)1.380(1.258, 1.515),共显性模式(AG vs AA)1.131(1.089, 1.176),显性模式(AG+GG vs AA)1.168(1.101, 1.240),隐性模式(GG vs AA+AG)1.343(1.282, 1.405),表明CDKAL1基因rs7756992位点G等位基因是T2DM的易感基因;由于各研究间异质性较大,按种族将研究人群分为白种人群、亚洲人群及非洲人群进行亚组分析,结果提示G等位基因与白种人群和亚洲人群T2DM发病有关(P < 0.05),但在非洲人群则未发现G等位基因与T2DM发病相关(P>0.05),其原因可能与种族间的遗传差异有关,也可能是由于非洲人群仅筛选出4项研究,且样本量偏小所致,今后应增加非洲人群研究的次数与样本量,从而增强结论的可信度。
在11项关于亚洲人群的研究间仍然存在中、重度异质性,meta回归分析发现T2DM组例数是异质性的主要来源。为此按T2DM组病例数大小将亚洲人群研究进一步分为亚组1(≥1 000例)和亚组2( < 1 000例),结果发现亚组1各研究间异质性较未分组时降低,同时G等位基因与T2DM发病的关联更强;而亚组2各研究间异质性较未分组时增高,也未发现G等位基因与T2DM发病的阳性关联,提示可通过增加T2DM组的样本量来降低各研究间的异质性,增强研究结果的可信度。
本研究设计了严格的纳入和排除标准,采用分层分析、回归分析等方法处理研究中产生的混杂偏倚等,分析结果可信度较好。尽管如此,本研究仍存在一定局限性:(1)未对纳入文献进行质量评价,不能排除纳入了低质量研究对结果造成一定的偏倚;(2)所纳入的大部分研究的T2DM诊断是按照WHO公布的糖尿病诊断标准进行,但有些研究是遵循ADA糖尿病诊断标准,可能导致各研究纳入的患者之间存在一定差异;(3)仅对CDKAL1基因多态位点中的1个位点进行分析,虽然分析结果显示具有统计学关联,但其OR值均在1.1~1.3附近,且基因-基因、基因-环境之间的潜在交互作用的影响未包含在本次meta分析中,因而本研究分析结果仅用于研究参考。
综上所述,CDKAL1基因rs7756992位点A>G多态性可能增加亚洲人群及白种人群罹患T2DM的风险,但与非洲人群T2DM的易感性无关。考虑到T2DM的发生是遗传及环境因素共同作用的结果,结合本研究的一些局限性,因而确切结论尚需大样本病例对照或前瞻性临床研究进一步证实。
| [1] | STEINTHORSDOTTIR V, THORLEIFSSON G, REYNISDOTTIR I, BENEDIKTSSON R, JONSDOTTIR T, WALTERS G B, et al. A variant in CDKAL1 influences insulin response and risk of type 2 diabetes[J]. Nat Genet, 2007, 39: 770–775. DOI: 10.1038/ng2043 |
| [2] | HORIKOSHI M, HARA K, ITO C, SHOJIMA N, NAGAI R, UEKI K, et al. Variations in the HHEX gene are associated with increased risk of type 2 diabetes in the Japanese population[J]. Diabetologia, 2007, 50: 2461–2466. DOI: 10.1007/s00125-007-0827-5 |
| [3] | OMORI S, TANAKA Y, TAKAHASHI A, HIROSE H, KASHIWAGI A, KAKU K, et al. Association of CDKAL1, IGF2BP2, CDKN2A/B, HHEX, SLC30A8, and KCNJ11 with susceptibility to type 2 diabetes in a Japanese population[J]. Diabetes, 2008, 57: 791–795. DOI: 10.2337/db07-0979 |
| [4] | CAUCHI S, MEYRE D, DURAND E, PROEN A C, MARRE M, HADJADJ S, et al. Post genome-wide association studies of novel genes associated with type 2 diabetes show gene-gene interaction and high predictive value[J/OL]. PLoS One, 2008, 3:e2031. doi:10.1371/journal.pone.0002031. |
| [5] | LIU Y, YU L, ZHANG D, CHEN Z, ZHOU D Z, ZHAO T, et al. Positive association between variations in CDKAL1 and type 2 diabetes in Han Chinese individuals[J]. Diabetologia, 2008, 51: 2134–2137. DOI: 10.1007/s00125-008-1141-6 |
| [6] | HORIKAWA Y, MIYAKE K, YASUDA K, ENYA M, HIROTA Y, YAMAGATA K, et al. Replication of genome-wide association studies of type 2 diabetes susceptibility in Japan[J]. J Clin Endocrinol Metab, 2008, 93: 3136–3141. DOI: 10.1210/jc.2008-0452 |
| [7] | RONG R, HANSON R L, ORTIZ D, WIEDRICH C, KOBES S, KNOWLER W C, et al. Association analysis of variation in/near FTO, CDKAL1, SLC30A8, HHEX, EXT2, IGF2BP2, LOC387761, and CDKN2B with type 2 diabetes and related quantitative traits in Pima Indians[J]. Diabetes, 2009, 58: 478–488. DOI: 10.2337/db08-0877 |
| [8] | TAKEUCHI F, SERIZAWA M, YAMAMOTO K, FUJISAWA T, NAKASHIMA E, OHNAKA K, et al. Confirmation of multiple risk Loci and genetic impacts by a genome-wide association study of type 2 diabetes in the Japanese population[J]. Diabetes, 2009, 58: 1690–1699. DOI: 10.2337/db08-1494 |
| [9] | TABARA Y, OSAWA H, KAWAMOTO R, ONUMA H, SHIMIZU I, MIKI T, et al. Replication study of candidate genes associated with type 2 diabetes based on genome-wide screening[J]. Diabetes, 2009, 58: 493–498. DOI: 10.2337/db07-1785 |
| [10] | XU M, BI Y, XU Y, YU B, HUANG Y, GU L, et al. Combined effects of 19 common variations on type 2 diabetes in Chinese:results from two community-based studies[J/OL]. PLoS One, 2010, 5:e14022. doi:10.1371/journal.pone.0014022. |
| [11] | CHISTIAKOV D A, POTAPOV V A, SMETANINA S A, BEL'CHIKOVA L N, SUPLOTOVA L A, NOSIKOV V V. The carriage of risk variants of CDKAL1 impairs beta-cell function in both diabetic and non-diabetic patients and reduces response to non-sulfonylurea and sulfonylurea agonists of the pancreatic KATP channel[J]. Acta Diabetol, 2011, 48: 227–235. DOI: 10.1007/s00592-011-0299-4 |
| [12] | LU F, QIAN Y, LI H, DONG M, LIN Y, DU J, et al. Genetic variants on chromosome 6p21.1 and 6p22.3 are associated with type 2 diabetes risk:a case-control study in Han Chinese[J]. J Hum Genet, 2012, 57: 320–325. DOI: 10.1038/jhg.2012.25 |
| [13] | 李伟, 牛庆, 李霞莲, 沈飞霞, 施红英, 曹淑彦, 等. CDKAL1基因rs7756992位点多态性与2型糖尿病发病风险及临床特征关联分析[J]. 温州医学院学报, 2013, 43: 141–146. |
| [14] | BENRAHMA H, CHAROUTE H, LASRAM K, BOULOUIZ R, ATIG R K, FAKIRI M, et al. Association analysis of IGF2BP2, KCNJ11, and CDKAL1 polymorphisms with type 2 diabetes mellitus in a Moroccan population:a case-control study and meta-analysis[J]. Biochem Genet, 2014, 52: 430–442. DOI: 10.1007/s10528-014-9658-5 |
| [15] | LASRAM K, BEN HALIM N, BENRAHMA H, MEDIENE-BENCHEKOR S, ARFA I, HSOUNA S, et al. Contribution of CDKAL1 rs7756992 and IGF2BP2 rs4402960 polymorphisms in type 2 diabetes, diabetic complications, obesity risk and hypertension in the Tunisian population[J]. J Diabetes, 2015, 7: 102–113. DOI: 10.1111/jdb.2015.7.issue-1 |
| [16] | OHARA-IMAIZUMI M, YOSHIDA M, AOYAGI K, SAITO T, OKAMURA T, TAKENAKA H, et al. Deletion of CDKAL1 affects mitochondrial ATP generation and first-phase insulin exocytosis[J/OL]. PLoS One, 2010, 5:e15553. doi:10.1371/journal.pone.0015553. |
| [17] | SCOTT L J, MOHLKE K L, BONNYCASTLE L L, WILLER C J, LI Y, DUREN W L, et al. A genome-wide association study of type 2 diabetes in Finns detects multiple susceptibility variants[J]. Science, 2007, 316: 1341–1345. DOI: 10.1126/science.1142382 |
 2017, Vol. 38
2017, Vol. 38


