子痫前期(preeclampsia, PE)是产科常见并发症,主要表现为妊娠20周以后出现的高血压和蛋白尿,造成孕产妇心血管等系统功能紊乱,严重威胁母婴健康[1-3]。PE患者存在明显的激素水平异常,孕激素水平的降低与PE的发生、发展密切相关,补充孕激素能明显改善PE患者的临床症状[4-5],然而具体机制尚未明确,临床上尚未将孕激素治疗纳入PE的常规治疗[6]。孕激素不仅参与雌性动物生殖活动的调节,而且对心血管活动也具有重要的调节作用[7]。孕激素属于脂溶性的类固醇类激素,容易透过细胞膜和血脑屏障,影响中枢神经系统的功能;它可通过结合神经元胞质或者核内孕激素受体(主要有nPGRA、nPGRB两种亚型)发挥基因组效应,调控基因的转录和表达[8]。在中枢神经系统内,头端延髓腹外侧区(rostral ventrolateral medulla, RVLM)是血压和交感神经活动的主要调控中枢[9-10]。γ-氨基丁酸(γ-aminobutyric acid, GABA)是中枢神经系统内一种重要的抑制性神经递质,RVLM内GABA受体的表达及功能低下是高血压病交感输出增强的主要机制之一[11]。GABA受体包括离子型的A和C亚型以及代谢型的B亚型,其中GABAA和GABAB受体广泛分布于中枢神经系统。GABA能机制主要通过GABAA受体介导,也有研究报道RVLM内GABAB受体参与了心血管功能的调控[12]。PE患者存在明显的交感神经功能亢进,且是心血管功能紊乱的主要机制[10, 13]。研究发现,正常妊娠动物模型RVLM内GABA受体的蛋白和基因表达均明显增加,可能是由孕激素水平升高所致[12, 14]。然而PE患者交感神经活性增强是否与RVLM内GABA受体蛋白的表达及功能下调有关并不清楚。有研究表明,RVLM内GABA能机制的上调是降低血压和抑制交感输出的重要机制[14-15],然而孕激素能否通过上调RVLM内GABA受体的表达及功能从而降低PE交感输出亢进,改善其心血管功能紊乱也并不十分清楚。本研究通过观察GABA受体在PE大鼠RVLM区的表达,以及孕激素对该受体表达的影响,阐明GABA受体蛋白表达增强在孕激素改善PE患者心血管功能中的作用和意义,进一步明确孕激素改善PE的机制,为其临床预防及治疗提供新的策略。
1 材料和方法 1.1 建立PE动物模型健康成年SD大鼠购买于第二军医大学实验动物中心[动物生产许可证号:SCXK(沪)2013-0016]。本研究设立未孕正常大鼠组(Con组)、未孕大鼠+醋酸去氧皮质酮(desoxycorticosterone acetate,DOCA)+生理盐水组(DS组)、受孕大鼠组(NP组)和受孕大鼠+DOCA+生理盐水组(PDS组)。其中Con组及DS组每组4只,NP组及PDS组每组20只。在24 h控温、控光条件下将雌性SD大鼠(200~250 g)与雄性大鼠(275~300 g)于当日16:00合笼(雌雄鼠比例2:1),次日晨8:00行雌鼠阴道涂片。相差显微镜10倍物镜观察,若见到角化无核的阴道上皮细胞及堆积于其间的雄鼠精子,则记录为受孕第1天,当日DOCA(上海亿欣生物有限公司)12.5 mg腹腔注射,其后分别在第8、15天予以DOCA 6.5 mg腹腔注射;整个孕期予以0.9%生理盐水替代普通饮用水喂养,妊娠18 d PE模型(PDS组)建立成功[16]。
1.2 补充孕激素PE模型建立成功后,分别取PDS组及NP组大鼠各16只,均随机分为2个亚组,即PDS+Veh组、PDS+17-OHPC组、NP+Veh组和NP+17-OHPC组,每组8只大鼠。正常喂养4组大鼠至妊娠第15天时,PDS+17-OHPC组和NP+17-OHPC组大鼠腹腔注射己酸羟孕酮(17-α-hydroxyprogesterone caproate,17-OHPC;3.32 mg/kg;大连美伦生物有限公司);PDS+Veh组和NP+Veh组大鼠腹腔注射等量芝麻油(Veh)。
1.3 心血管指标的监测将大鼠用2%戊巴比妥钠(0.3 mL/100 g)腹腔麻醉后,固定于手术台上,备皮消毒后行气管插管,连接呼吸机,并设置参数为潮气量1.5~2.0 mL、呼吸频率60次/分、呼吸比1:2、氧流量0.5 L/min。于右侧腹股沟区手术暴露并分离股动脉,插入动脉导管,导管接液压换能器后开启并连接PowerLab/8SP系统(ADInstruments公司),监测平均动脉压(mean arterial pressure,MAP)及心率(heart rate,HR),监测结束后取一段连续、平稳10 min的MAP及HR,由PowerLab/8SP软件计算该段MAP及HR平均值。
1.4 肾交感放电活动(renal sympathetic nerve activity, RSNA)的记录大鼠麻醉固定后取侧卧位,从后腹膜分离并暴露肾动、静脉和肾神经,在显微镜下用玻璃分针轻柔地分离肾神经并切断远端,将肾神经挂在双极记录电极上并用硅胶(Wacker Silgel)包埋,RSNA通过放大器放大后输入PowerLab/8SP系统记录整合。过量麻醉处死大鼠1~2 min后,记录RSNA的最大值[17]。RSNA基线值(消除绝对值的噪声)用其占最大值的百分比来表示。
1.5 样本的采集妊娠第17~18天(16:00~次日16:00)收集24 h尿液于预先加入100 μL冰醋酸的收集瓶中,并保存于-80℃。妊娠第18天监测心血管指标后,将大鼠用2%戊巴比妥钠(0.3 mL/100 g)腹腔麻醉,固定后逐层暴露枕骨大孔,用100 μL微量进样器通过枕骨大孔抽取脑脊液,500×g 4℃离心10 min,取上清并保存于-80℃。然后断头取血储存于4 mL离心管中,4℃静置1~2 h,2 000×g离心15 min,取上清并保存于-80℃。将脑组织置于液氮中保存。
1.6 血清和脑脊液中孕激素含量以及24 h尿蛋白含量的测定大鼠尿蛋白试剂盒及大鼠孕激素试剂盒购自上海西唐生物科技有限公司,按照说明书指导过程测定450 nm处的光密度(D)值,计算各组大鼠血清和脑脊液中孕激素以及24 h尿蛋白的实际浓度。
1.7 GABAA受体、GABAB受体、nPGRA和nPGRB蛋白的检测参照大鼠脑图谱[17]于冰冻切片机上定位并抽取RVLM组织,加入组织细胞裂解液(北京普利来基因技术有限公司)60 μL(含全细胞裂解液、蛋白酶抑制剂及蛋白磷酸酶抑制剂)制备组织匀浆,用BCA蛋白定量试剂盒(碧云天生物试剂有限公司)测定含量后加入相应体积的上样缓冲液(Thermo fisher Fermentas,美国),混匀变性后行SDS-PAGE、转膜、5%脱脂牛奶封闭。TBST(Tris-盐酸缓冲液+Tween)洗膜3次,加入一抗(抗体均购于英国Abcam公司,GABAA和GABAB受体抗体按1:5 000稀释;nPGRA和nPGRB抗体按1:500稀释),以α-tubulin作为内参,室温孵育2 h,4℃过夜,TBST洗膜3次后加入二抗室温孵育1~2 h,洗膜3次后可进行化学发光显影,最后使用Gel-Pro analyzer软件进行蛋白条带分析。
1.8 统计学处理用GraphPad Prism 6.0软件进行分析,数据均以x±s表示。PE大鼠模型的评价采用单因素方差分析(one-way ANOVA);组间相关指标比较采用双因素方差分析(two-way ANOVA)。检验水准(α)为0.05。
2 结果 2.1 雌鼠阴道涂片确定受孕如图 1所示,若见到角化无核的阴道上皮细胞及堆积于其间的雄鼠精子(雄鼠精子头部为弯镰刀头状,尾部较长,多呈屈曲),则确认为受孕第1天。
|
图 1 交配后雌性大鼠阴道涂片 Fig 1 Pregnancy was confirmed by the vaginal smears |
2.2 PE动物模型的评价
如表 1所示,PDS组大鼠的MAP、RSNA值及24 h尿蛋白含量均高于Con、DS及NP组(P < 0.05),HR高于Con和DS组(P < 0.05)。
|
|
表 1 各组大鼠心血管指标以及24 h尿蛋白含量的比较 Tab 1 Comparison of cardiovascular parameters and 24-h urine protein contents among each group |
2.3 各组大鼠血清及脑脊液中孕激素的含量变化
与NP组相比,PDS+Veh组大鼠血清及脑脊液中孕激素含量下降(P < 0.05),而补充孕激素3 d后,二者均升高(P < 0.05)。见表 2。
|
|
表 2 各组大鼠血清及脑脊液中孕激素含量的比较 Tab 2 Comparison of serum and CSF progesterone concentrations among each group |
2.4 孕激素对PE大鼠心血管功能的影响
如表 3所示, 与NP组大鼠相比,PDS+Veh组大鼠的MAP、HR、RSNA值及24 h尿蛋白含量均升高(P < 0.05);而与PDS+Veh组相比,PE大鼠补充孕激素后(PDS+17-OHPC组)的MAP、RSNA及24 h尿蛋白含量均降低(P < 0.05)。补充孕激素前后PE大鼠的HR值差异无统计学意义。
|
|
表 3 补充孕激素后各组心血管指标以及24 h尿蛋白含量的改变 Tab 3 The levels of cardiovascular parameters and 24-h urine protein after administration of progesterone |
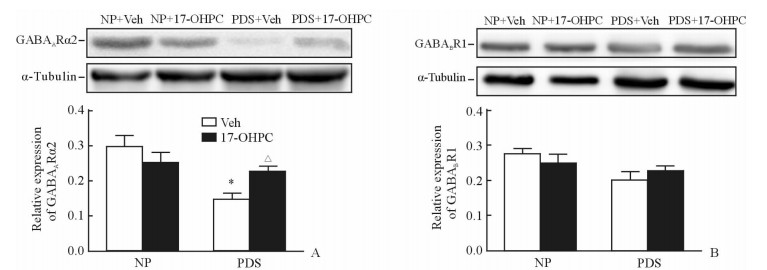
2.5 大鼠RVLM内GABAA和GABAB受体亚基的表达情况
PDS+Veh组大鼠RVLM内GABAA受体亚基(Rα2)的表达较NP+Veh组降低(P < 0.05,图 2A),补充孕激素3 d后,即PDS+17-OHPC组GABAA受体的表达上调(P < 0.05)。GABAB受体亚基(R1)在4组大鼠RVLM内表达差异无统计学意义(图 2B)。
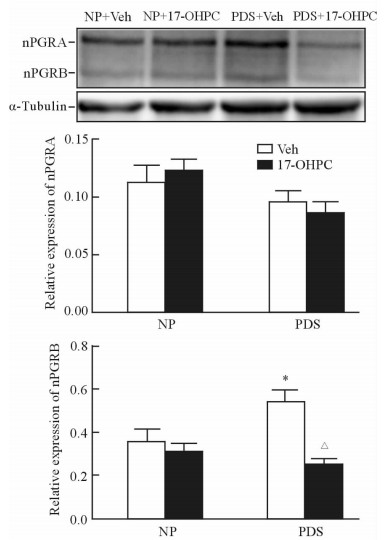
2.6 大鼠RVLM区nPGRA和nPGRB蛋白表达情况如图 3所示,nPGRA蛋白在4组大鼠RVLM内的表达差异无统计学意义。但PDS+Veh组大鼠RVLM内nPGRB蛋白的表达较NP+Veh组升高(P < 0.05),孕激素补充3 d后,其表达下调(P < 0.05)。
|
图 2 RVLM内GABAA(A)和GABAB(B)受体亚基的表达 Fig 2 Comparison of GABAAR(A) and GABABR (B) protein subunit expression in RVLM |
|
图 3 RVLM内nPGRA和nPGRB的表达 Fig 3 Comparison of nPGRA and nPGRB protein expression in RVLM |
3 讨论
目前对PE患者的临床治疗主要集中在降压、预防子痫及镇静等对症治疗方面,常用药物如硝苯地平、拉贝洛尔、硫酸镁等可对胎儿的生长发育产生不利的影响,且有一定的致畸作用[18],因此探索安全、有效的治疗方案迫在眉睫。本实验成功建立了PE大鼠模型,表现为血压升高、心率增快、RSNA增强以及24 h尿蛋白含量升高,补充孕激素后上述指标均下降,而正常妊娠大鼠补充孕激素后上述指标无明显变化。大量实验观察到PE患者或PE动物模型血清中的孕激素水平降低[19-20]。本实验中,PE大鼠的血清及脑脊液中孕激素水平均低于正常妊娠(NP)组,且对PE大鼠补充孕激素后其心血管功能得到改善,说明PE的发生、发展与孕激素的水平密切相关。
PE患者表现为血压升高、尿蛋白异常、水肿等,近期研究发现PE的发生可增加远期心肌病的风险[21]。Amaral等[4]在PE模型上发现孕激素能通过减少外周循环系统中的CD4+T细胞、炎性因子,改善NO的生物利用度以及胎盘缺血等途径发挥心血管保护效应。Sammour等[22]通过对40例随机选取的34~40周的PE患者肌内注射17-OHPC(200 mg/d)1~6周后,观察到80%的患者血压降低、水肿减轻。尽管大量研究提示孕激素可改善PE患者的心血管功能,但其机制并不清楚,临床缺乏足够的证据支持孕激素的使用[18]。研究表明,中枢神经系统RVLM内GABA能机制的低下是高血压病交感输出亢进和血压升高等功能紊乱的机制之一[10, 14]。GABA是中枢神经系统中重要的抑制性递质,主要通过与GABAA受体结合后发挥效应。既往研究发现,正常妊娠时相关动物模型表现为血压和交感神经活动均轻度降低,且其RVLM内GABAA受体蛋白和基因表达增加,并且其升高可能与孕激素水平升高有关[12]。研究发现,孕激素及其代谢产物可通过非基因组机制发挥生理学效应,孕激素在胞外可结合GABAA受体,使氯离子通道开放,引起神经元超极化、兴奋性降低,进而发挥交感抑制作用[23]。此外,孕激素还可通过基因组机制,与神经元胞质及核内孕激素受体结合形成激素-受体复合物,调节基因转录,使GABA蛋白表达增多,增强其交感抑制作用。故本实验观察了孕激素对GABA受体的表达情况影响,主要检测了表达在RVLM的GABAA受体亚基Rα2和GABAB受体亚基R1的表达水平,结果发现PE大鼠模型RVLM内GABAA受体表达低下,补充孕激素后其表达上调,而GABAB受体的表达无明显改变。此外,本研究发现PE大鼠模型RVLM内nPGRB蛋白的表达增加,补充孕激素后其表达下调;而是否补充孕激素对nPGRA的表达均无明显影响。上述结果说明孕激素可以上调RVLM区GABAA受体的表达,可能是孕激素改善PE心血管功能的机制之一。
本研究明确了PE大鼠补充孕激素前后RVLM内GABA受体和nPGR蛋白的表达变化情况,提示孕激素可能通过与nPGRB相互作用导致GABAA受体表达增强,从而参与孕激素改善PE患者心血管功能的效应调节,进而为孕激素改善PE患者心血管功能的机制研究提出了新的研究方向。
然而,进一步的工作仍然有待进行:(1)本实验主要研究了PE大鼠模型RVLM内GABA受体以及nPGR蛋白在孕激素干预前后表达的变化趋势,而脑内其他心血管中枢,如室旁核、孤束核、疑核也参与心血管功能的调节[9-10],故该作用是否亦存在于这些核团有待于进一步的研究;(2)本实验初步检测了PE大鼠模型RVLM内GABA受体以及nPGR蛋白在孕激素干预前后的表达变化,我们需要在整体动物模型上观察特异性的激动GABA受体或nPGR后孕激素对大鼠心血管功能的影响,进一步明确GABAA受体和nPGRB蛋白表达的变化在孕激素改善PE中的具体作用。
| [1] | 中华医学会妇产科学分会妊娠期高血压疾病学组. 妊娠期高血压疾病诊治指南(2015)[J]. 中华妇产科杂志 , 2015, 10 :721–728. |
| [2] | SEELY E W, SOLOMON C G. Improving the prediction of preeclampsia[J]. N Engl J Med , 2016, 374 :83–84. DOI:10.1056/NEJMe1515223 |
| [3] | LIN S, LEONARD D, CO M A, MUKHOPADHYAY D, GIRI B, PERGER L, et al. Pre-eclampsia has an adverse impact on maternal and fetal health[J]. Transl Res , 2015, 165 :449–463. DOI:10.1016/j.trsl.2014.10.006 |
| [4] | AMARAL L M, CORNELIUS D C, HARMON A, MOSELEY J, MARTIN JR J N, LAMARCA B. 17-Hydroxyprogesterone caproate significantly improves clinical characteristics of preeclampsia in the reduced uterine perfusion pressure rat model[J]. Hypertension , 2015, 65 :225–231. DOI:10.1161/HYPERTENSIONAHA.114.04484 |
| [5] | HUDA S S, FREEMAN D J, NELSON S M. Short-and long-term strategies for the management of hypertensive disorders of pregnancy[J]. Expert Rev Cardiovasc Ther , 2009, 7 :1581–1594. DOI:10.1586/erc.09.147 |
| [6] | SUZUKI Y, MATSUURA A, YAMAMOTO T. .[Management of pregnancy induced hypertension][J]. Nihon Rinsho , 2015, 73 :1897–1903. |
| [7] | BLANCH G T, FREIRIA-OLIVEIRA A H, SPERETTA G F, CARRERA E J, LI H, SPETH R C, et al. Increased expression of angiotensin Ⅱ type 2 receptors in the solitary-vagal complex blunts renovascular hypertension[J]. Hypertension , 2014, 64 :777–783. DOI:10.1161/HYPERTENSIONAHA.114.03188 |
| [8] | MESIANO S, WANG Y, NORWITZ E R. Progesterone receptors in the human pregnancy uterus:do they hold the key to birth timing?[J]. Reprod Sci , 2011, 18 :6–19. DOI:10.1177/1933719110382922 |
| [9] | GREENWOOD J P, SCOTT E M, WALKER J J, STOKER J B, MARY D A. The magnitude of sympathetic hyperactivity in pregnancy-induced hypertension and preeclampsia[J]. Am J Hypertens , 2003, 16 :194–199. DOI:10.1016/S0895-7061(02)03256-9 |
| [10] | GUYENET P G. The sympathetic control of blood pressure[J]. Nat Rev Neurosci , 2006, 7 :335–346. |
| [11] | BIANCARDI V C, CAMPOS R R, STERN J E. Altered balance of γ-aminobutyric acidergic and glutamatergic afferent inputs in rostral ventrolateral medulla-projecting neurons in the paraventricular nucleus of the hypothalamus of renovascular hypertensive rats[J]. J Comp Neurol , 2010, 518 :567–585. DOI:10.1002/cne.22256 |
| [12] | MICHAEL FOLEY C, STANTON J J, PRICE E M, CUNNINGHAM J T, HASSER E M, HEESCH C M. GABAA α1 and α2 receptor subunit expression in rostral ventrolateral medulla in nonpregnant and pregnant rats[J]. Brain Res , 2003, 975 :196–206. DOI:10.1016/S0006-8993(03)02635-0 |
| [13] | GREENWOOD J P, SCOTT E M, STOKER J B, WALKER J J, MARY D A. Sympathetic neural mechanisms in normal and hypertensive pregnancy in humans[J]. Circulation , 2001, 104 :2200–2204. DOI:10.1161/hc4301.098253 |
| [14] | PENG J F, WU Z T, WANG Y K, YUAN W J, SUN T, NI X, et al. GABAergic mechanism in the rostral ventrolateral medulla contributes to the hypotension of moxonidine[J]. Cardiovasc Res , 2011, 89 :473–481. DOI:10.1093/cvr/cvq289 |
| [15] | CONCAS A, FOLLESA P, BARBACCIA M L, PURDY R H, BIGGIO G. Physiological modulation of GABA(A) receptor plasticity by progesterone metabolites[J]. Eur J Pharmacol , 1999, 375 :225–235. DOI:10.1016/S0014-2999(99)00232-0 |
| [16] | IANOSI-IRIMIE M, VU H V, WHITBRED J M, PRIDJIAN C A, NADIG J D, WILLIAMS M Y, et al. A rat model of preeclampsia[J]. Clin Exp Hypertens , 2005, 27 :605–617. DOI:10.1080/10641960500298608 |
| [17] | ZHA Y P, WANG Y K, DENG Y, ZHANG R W, TAN X, YUAN W J, et al. Exercise training lowers the enhanced tonically active glutamatergic input to the rostral ventrolateral medulla in hypertensive rats[J]. CNS Neurosci Ther , 2013, 19 :244–251. DOI:10.1111/cns.2013.19.issue-4 |
| [18] | SIBAI B, DEKKER G, KUPFERMINC M. Pre-eclampsia[J]. Lancet , 2005, 365 :785–799. DOI:10.1016/S0140-6736(05)71003-5 |
| [19] | AMARAL L M, KIPRONO L, CORNELIUS D C, SHOEMAKER C, WALLACE K, MOSELEY J, et al. Progesterone supplementation attenuates hypertension and the autoantibody to the angiotensin Ⅱ type Ⅰ receptor in response to elevated interleukin-6 during pregnancy[J]. Am J Obstet Gynecol , 2014, 211 :158e1–158e6. DOI:10.1016/j.ajog.2014.02.018 |
| [20] | KIPRONO L V, WALLACE K, MOSELEY J, MARTIN J Jr, LAMARCA B. Progesterone blunts vascular endothelial cell secretion of endothelin-1 in response to placental ischemia[J]. Am J Obstet Gynecol , 2013, 209 :44e1–44e6. DOI:10.1016/j.ajog.2013.03.032 |
| [21] | BEHRENS I, BASIT S, LYKKE J A, RANTHE M F, WOHLFAHRT J, BUNDGAARD H, et al. Association between hypertensive disorders of pregnancy and later risk of cardiomyopathy[J]. JAMA , 2016, 315 :1026–1033. DOI:10.1001/jama.2016.1869 |
| [22] | SAMMOUR M B, EL-KABARITY H, FAWZY M M, SCHINDLER A E. Prevention and treatment of pregnancy-induced hypertension (preeclampsia) with progestogens[J]. J Steroid Biochem Mol Biol , 2005, 97 :439–440. DOI:10.1016/j.jsbmb.2005.08.014 |
| [23] | CZYZEWSKA-SZAFRAN H, WUTKIEWICZ M, REMISZEWSKA M, JASTRZEBSKI Z, CZARNECKI A, DANYSZ A. Down-regulation of the GABA-ergic system in selected brain areas of spontaneously hypertensive rats (SHR)[J]. Pol J Pharmacol Pharm , 1989, 41 :619–627. |
 2016, Vol. 37
2016, Vol. 37


