2. 第二军医大学长海医院胃肠外科, 上海 200433;
3. 上海体育学院, 上海 200438;
4. 第二军医大学热带医学与公共卫生学系生物防御教研室, 上海市医学生物防护重点实验室, 上海 200433
2. Department of Gastrointestinal Surgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Shanghai University of Sports, Shanghai 200438, China;
4. Department of Biological Defense(Microbiology), Shanghai Key Laboratory of Medical Biodefence, Faculty of Tropical Medicine and Public Health, Second Military Medical University, Shanghai 200433, China
东南沿海是我军的重点作战方向,夏季的高温高湿环境严重影响战士的体能和作业效率。在热环境特别是湿热环境条件下进行体力活动时,由于机体产热增加及散热困难,极易引起体内热量蓄积、核心温度升高并导致热应激反应,使得军事作业、训练效率下降且差错率升高,甚至酿成重大安全事故。另外,严重的热蓄积可导致热应激损伤,中暑和心、脑、肾等重要器官的功能损害,甚至危及生命。因此,提高我军官兵对热环境的耐受能力,以提升军事作业和训练效率,是增强部队战斗力和适应未来战场需要的重要课题。
热习服是指机体在热环境下通过反复训练,逐步提高对热环境的耐受能力,从而减少热环境对机体损伤的过程[1-2]。既往研究证明,热习服训练是世界公认的、能显著提高机体耐热能力、降低中暑发病率和减少对机体重要脏器损伤的有效方法之一[3]。热习服的评价方法众多,指标各异,主要为给予一次高强度热刺激后,评价机体核心体温和皮肤平均温度的升高幅度、出汗率和汗液电解质浓度以及心率和心功能指数[4]。然而,目前通过这些物理学指标进行热习服评价存在敏感性不高和操作复杂等问题,因此我们急需寻找一种客观、便捷、准确、实时的评价方法。近年来随着机体生化代谢机制研究的不断推进,研究发现热习服和热应激过程中伴随体温、出汗、体能下降以及器官损伤的同时,血液内激素、热休克蛋白和某些细胞因子的浓度也会发生变化[5]。与此同时,机体代谢终末产物(如乳酸、尿素氮等)的含量也会发生相应改变。这些代谢产物的变化除与机体生化代谢过程的改变密切相关外,更有可能有效地指示机体热习服的程度以及热习服对机体热应激损伤的保护程度。代谢组学作为一门新兴学科,着重研究生物体被扰动后(如基因的改变或环境的改变)其代谢产物(内源性代谢物质)的种类、数量及变化规律[6],强调尽可能地保留和反映生物体总的代谢产物信息,为全面评价热习服及后续热环境运动刺激血浆中代谢物质的变化提供了可能。
本研究结合代谢组学的核磁共振(nuclear magnetic resonance,NMR)法和多元统计方法,评价热习服完成及后续热环境运动刺激后大鼠血浆中代谢产物的变化,筛选热习服的特异性指示标志物,为制定热习服客观评价指标体系提供线索。
1 材料和方法 1.1 热习服和热环境运动刺激实验方案取20只雄性SD大鼠[由第二军医大学动物实验中心提供,动物许可证号:SCXK(沪)2013-0016],通过负重力竭游泳实验,剔除游泳时间最长和最短的大鼠4只,其余16只随机分为对照组与热习服组,每组8只。对照组大鼠在常温(24℃)、常湿(相对湿度60%)条件下自由活动2 h;热习服组大鼠在高温(36℃)、常湿(相对湿度60%)环境条件下自由活动1 h后,在动物跑步机上以14 m/min的速度平板运动1 h,1次/d,连续14 d [7-8]。热习服实验结束后的第2天在乙醚作用下眼眶取血。继续休息4 d后,将两组大鼠均置于高温(36℃)、相对湿度85%的环境中以21 m/min速度平板运动30 min,即进行热环境运动刺激。热环境运动刺激结束后立即在水合氯醛(40 mg/kg)麻醉下腹主动脉取血5 mL,所取血液经2 100×g离心15 min后取血浆,储存于-80℃待进行NMR检测。
1.2 1HNMR实验样品的采集与制备1HNMR检测前取200 μL血浆样品于离心管中,加入400 μL磷酸盐缓冲液(0.2 mol/L,pH 7.4),混匀后4℃、12 000×g离心5 min,取550 μL上清液加入至5 mm核磁管中备用[9]。
1.3 1HNMR实验方案使用Bruker 600 MHz NMR谱仪(上海敏芯信息科技有限公司)在恒温(25℃)条件下检测所有样品的1HNMR谱。采用cpm gprld脉冲序列并做单脉冲压制水峰,2 s预饱和时间,7 288.63 Hz谱宽,64 k采样点数,分别行128次叠加和循环。使用傅立叶变换将自由感应衰减(free induction decay,FID)信号转换为1HNMR图谱。最后应用TopSpin 3.0软件调整相位和校正基线,并以乳酸双峰处定标为1.33[10]。
1.4 数据预处理和多元统计分析采用Amix 3.9.5软件对校正完成的所有样品1HNMR谱进行分段积分(除去4.9~5.2水峰),积分区间为0~9,积分间隔为0.02。输出的数据导入Simca-p 13.0软件进行分析,采用偏最小二乘法(partical least-squares discriminant analysis,PLS-DA)和正交偏最小二乘法(orthogonal partical least-squares discriminant analysis,OPLS-DA)两种方法进行模式识别,初步筛选出代谢差异物质。
1.5 特征代谢产物的识别参考文献或查找相关的数据库确定检测出有差异的物质,并采用t检验方法比较这些物质的组间差异是否具有统计学意义。检验水准(α)为0.05。
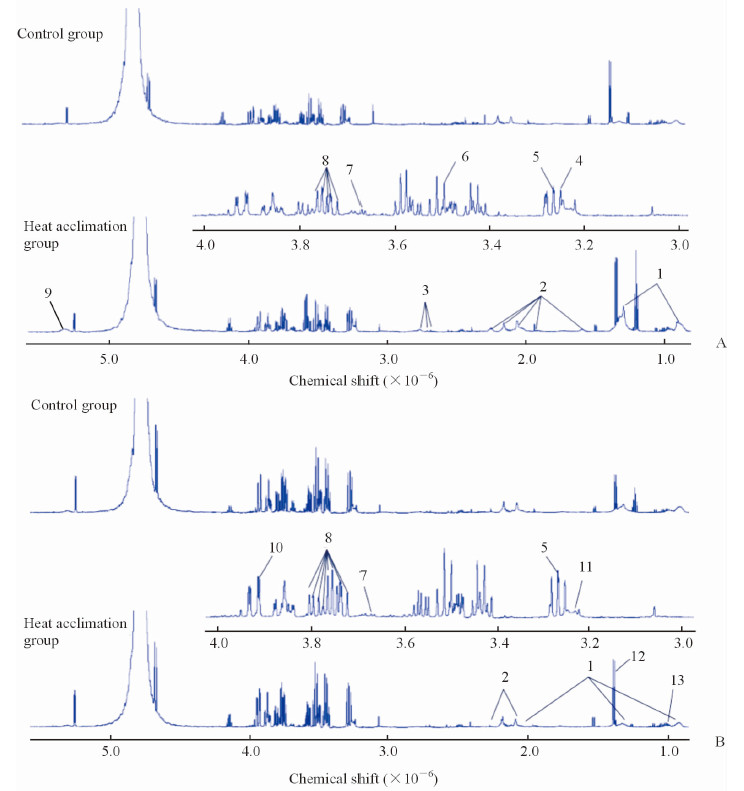
2 结果 2.1 热习服及热环境运动刺激后大鼠血浆代谢产物的1HNMR谱经过14 d热习服训练和热环境运动刺激后,检测得对照组和热习服组大鼠血浆代谢产物的1HNMR谱,并根据文献[11-14]确定图中1~13信号峰所示物质,见图 1。
|
图 1 热习服和热环境运动刺激后对照组与热习服组大鼠血浆代谢产物的1HNMR谱 Fig 1 1HNMR spectra of rat plasma from control and heat acclimation groups after heat acclimation and stimulation with exercise |
2.2 热习服及热环境运动刺激后血浆代谢产物的变化 2.2.1 PLS-DA和OPLS-DA模型
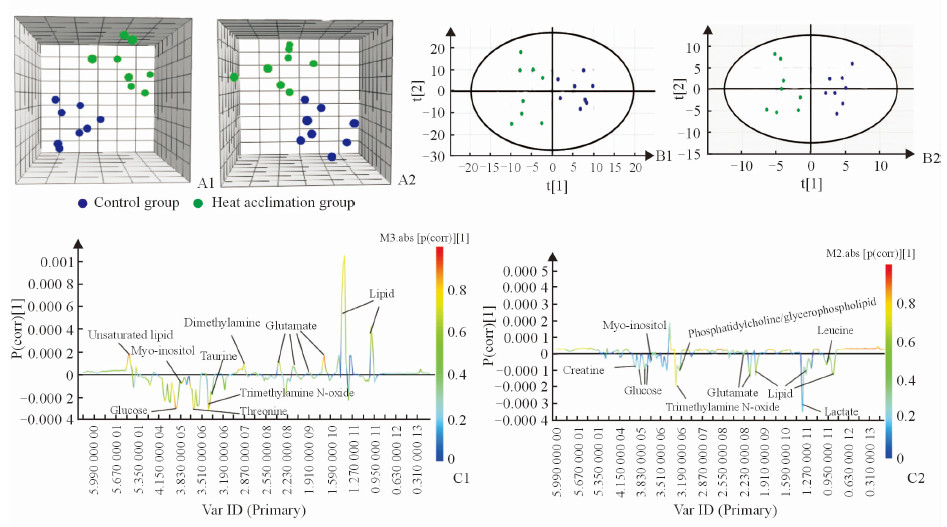
热习服完成后,对热习服组和对照组大鼠血浆代谢产物的1HNMR谱进行PLS-DA分析得3D空间分布图(R2X=0.552,R2Y=0.839,Q2=0.657;图 2A1),行OPLS-DA分析所得的得分图和S线图(R2X=0.552,R2Y=0.839,Q2=0.599;图 2B1、2C1)。热环境运动刺激后,对热习服组和对照组大鼠血浆代谢产物的1HNMR谱进行PLS-DA分析得3D空间分布图(R2X=0.808,R2Y=0.743,Q2=0.506;图 2A2),行OPLS-DA分析所得的得分图和S线图(R2X=0.906,R2Y=0.896,Q2=0.599;图 2B2、2C2)。结果显示在PLS-DA和OPLS-DA两种模式下,热习服组和对照组的积分值均在95%参考值区间内且两组间无交叉重合点,说明热习服组和对照组大鼠血浆代谢产物能够显著分开,两组大鼠在热习服完成和热环境运动刺激后血浆代谢物质之间存在差异。在热习服完成后,与对照组相比,热习服组大鼠血浆中不饱和脂肪酸、谷氨酸、脂质和二甲胺的含量升高,而葡萄糖、肌醇、牛磺酸、苏氨酸和三甲胺氧化物含量下降(图 2C1);而在热环境运动刺激后,与对照组相比,热习服组大鼠血浆中肌酸、葡萄糖、肌醇、三甲胺氧化物、磷脂酰胆碱/甘油磷脂、谷氨酸、脂质、乳酸和亮氨酸的含量均下降(图 2C2),表明在热习服和热环境运动刺激后,热习服组和对照组大鼠血浆中存在有差异的代谢物质。
|
图 2 热习服和热环境运动刺激后大鼠血浆1HNMR谱PLS-DA和OPLS-DA结果 Fig 2 PLS-DA and OPLS-DA results of rat plasma from control and heat acclimation groups after heat acclimation and stimulation with exercise |
2.2.2 t检验
使用t检验检测PLS-DA和OPLS-DA两种识别模式筛选出的差异代谢物质的组间差异,结果表明,在热习服完成后,与对照组相比,热习服组大鼠血浆中不饱和脂肪酸、谷氨酸、脂质和二甲胺的含量升高,而葡萄糖、肌醇、牛磺酸、苏氨酸和三甲胺氧化物含量均下降(P < 0.05);而在热环境运动刺激后,与对照组相比,热习服组大鼠血浆中三甲胺氧化物、谷氨酸和脂质的含量均下降(P < 0.05),见表 1。
|
|
表 1 热习服和热环境运动刺激后热习服组与对照组大鼠血浆代谢物质浓度变化比较 Tab 1 Comparison of plasma metabolite changes between control and heat acclimation groups after heat acclimation with exercise in thermal environment |
3 讨论
既往研究证明,大鼠在热环境中自由活动,需要28 d才能完成习服的过程[15]。根据我们最新研究表明,大鼠在热环境中自由活动1 h,然后以低强度(14 m/min)在小动物跑步机上运动1 h,14 d即可达到习服状态[16]。大鼠习服后再进入同样的热环境,其核心体温、心率及体质量丢失率均明显小于未习服大鼠,同时其血液内应激激素、热休克蛋白及部分细胞因子也发生了不同变化。血液内应激激素和热休克蛋白的变化提示热习服后大鼠热应激程度明显下降,但其不同的代谢通路特别是与代谢相关的代谢终末产物的变化规律仍不清楚。
本研究通过分析热习服及后续热环境运动刺激后大鼠血浆代谢物质的变化,发现在热习服完成后,与对照组相比,热习服组大鼠血浆中不饱和脂肪酸、谷氨酸、脂质和二甲胺的含量均升高,而葡萄糖、肌醇、牛磺酸、苏氨酸和三甲胺氧化物含量均下降;在热环境运动刺激后,热习服组大鼠血浆中三甲胺氧化物、谷氨酸和脂质的含量均下降。
葡萄糖作为供应机体能量的主要来源之一,在热习服过程中热习服组大鼠高温运动需要氧化分解大量葡萄糖供应能量,故在热习服完成后,热习服组大鼠与对照组相比血浆中葡萄糖含量下降。肌醇具有维持镇静和体液渗透压平衡的功能[17],热习服组大鼠由于高热和运动的刺激,机体处于高度兴奋状态,必须消耗大量肌醇来维持内环境的稳态,故在热习服完成后,热习服组大鼠血浆中肌醇含量也降低。三甲胺氧化物作为一种有害物质,其在血液中的高含量会增加心血管疾病的发病率[18];在热习服训练作用下三甲胺氧化物分解成二甲胺和脂肪酸[19],减少对机体的损伤,故大鼠在热习服完成后,血浆中二甲胺和脂肪酸的含量上升,三甲胺氧化物含量下降。苏氨酸在苏氨酸脱氢酶和醛缩酶的作用下代谢生成乙酰辅酶A,加快三羧酸循环,促进葡萄糖的氧化分解[20],因而热习服完成后大鼠血浆中苏氨酸含量较低。牛磺酸是一种维持机体内环境稳态的物质[21],热习服组大鼠在热习服训练期间,机体处于兴奋状态,需要消耗大量牛磺酸来维持内环境的稳态,故在热习服完成后大鼠血浆中牛磺酸的含量降低。谷氨酸作为三羧酸循环的重要反应物质,其在血浆中的高含量可以加快三羧酸循环,促进葡萄糖的氧化分解,故在热习服完成后大鼠血浆中谷氨酸含量较高
热习服后的大鼠在重新进入热环境并进行体力活动时,由于其产热减少和散热能力增强,故其能够耐受较高的环境温度和运动强度,因此在同样高温条件下进行同等强度的运动后,其体能消耗、热应激水平均明显低于对照组。本实验中经高温运动刺激后,热习服组大鼠血浆中的谷氨酸、脂质和三甲胺氧化物的含量低于对照组,表明热习服可以通过增强对血液内产能物质的利用和有氧氧化能力,从而提高机体在热环境中的运动能力,降低机体的氧化应激水平,从而起到对机体重要组织器官的保护作用。
此外,三甲胺氧化物是唯一在热习服后以及热环境运动刺激后血浆含量均下降的物质。三甲胺氧化物含量的上升可能预示机体氧化应激水平的升高以及对机体各种组织器官的细胞毒性增加[22],其血浆含量下降说明热习服降低血液中具有细胞毒性的胺类物质的含量。热环境运动刺激后,热习服组大鼠血浆中三甲胺氧化物的含量也低于对照组,表明热习服训练有可能通过降低血液内特异的细胞毒性物质,降低热应激导致的器官损伤,从而加强对机体重要器官的保护作用。上述结果同时提示三甲胺氧化物有可能作为热习服和热应激损伤的特异标志物,以判断热习服和热应激的程度,为制定客观的热习服评价指标体系提供有益线索。
综上所述,与对照组相比,热习服组大鼠在热习服和热环境运动刺激后血浆中三甲胺氧化物的含量均明显下降,说明热习服降低了热环境运动刺激对大鼠的损伤程度,提示三甲胺氧化物可作为热习服的指示性标志物,为制定热习服客观评价体系提供有意义的线索。
| [1] | GUY J H, DEAKIN G B, EDWARDS A M, MILLER C M, PYNE D B. Adaptation to hot environmental conditions:an exploration of the performance basis, procedures and future directions to optimise opportunities for elite athletes[J]. Sports Med , 2015, 45 :303–311. DOI:10.1007/s40279-014-0277-4 |
| [2] | CHALMERS S, ESTERMAN A, ESTON R, BOWERING K J, NORTON K. Short-term heat acclimation training improves physical performance:a systematic review, and exploration of physiological adaptations and application for team sports[J]. Sports Med , 2014, 44 :971–988. DOI:10.1007/s40279-014-0178-6 |
| [3] | SHIDO O, MATSUZAKI K. Involvement of neurogenesis in the hypothalamic area in establishing long-term heat acclimation in rats[J]. Temperature(Austin) , 2015, 2 :362–367. |
| [4] | PÉRIARD J D, RACINAIS S, SAWKA M N. Adaptations and mechanisms of human heat acclimation:applications for competitive athletes and sports[J]. Scand J Med Sci Sports , 2015, 25 (Suppl 1) :25–38. |
| [5] | AMORIM F T, FONSECA I T, MACHADO-MOREIRA C A, MAGALHÃES FDE C. Insights into the role of heat shock protein 72 to whole-body heat acclimation in humans[J]. Temperature (Austin) , 2015, 2 :499–505. DOI:10.1080/23328940.2015.1110655 |
| [7] | 贾伟, 蒋健, 刘平, 赵立平, 陈闽军, 周明眉, 等. 代谢组学在中医药复杂理论体系研究中的应用[J]. 中国中药杂志 , 2006, 31 :621–624. |
| [8] | OÖPIK V, TIMPMANN S, KREEGIPUU K, UNT E, TAMM M. Heat acclimation decreases the growth hormone response to acute constant-load exercise in the heat[J]. Growth Horm IGF Res , 2014, 24 :2–9. DOI:10.1016/j.ghir.2013.10.001 |
| [9] | BECKONERT O, KEUN H C, EBBELS T M, BUNDY J, HOLMES E, LINDON J C, et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts[J]. Nat Protoc , 2007, 2 :2692–2703. DOI:10.1038/nprot.2007.376 |
| [10] | HAN B, HUANG H, LI Z, GONG M, SHI W, ZHU C, et al. Therapeutic effects of Chinese medicine herb pair, Huzhang and Guizhi, on monosodium urate crystal-induced gouty arthritis in rats revealed by anti-inflammatory assessments and NMR-based metabonomics[J]. Evid Based Complement Alternat Med , 2016, 2016 :9398435. |
| [11] | YANG Y, LIU Y, ZHENG L, ZHANG Q, GU Q, WANG L, et al. 1H NMR based serum metabolic profiles associated with pathological progression of pancreatic islet β cell tumor in Rip1-Tag2 mice[J]. Int J Biol Sci , 2015, 11 :595–603. DOI:10.7150/ijbs.11058 |
| [12] | SENGUPTA A, GHOSH S, SHARMA S, SONAWAT H M. 1H NMR metabonomics indicates continued metabolic changes and sexual dimorphism post-parasite clearance in self-limiting murine malaria model[J]. PLoS One , 2013, 8 :e66954. DOI:10.1371/journal.pone.0066954 |
| [13] | WEI T, ZHAO L, JIA J, XIA H, DU Y, LIN Q, et al. Metabonomic analysis of potential biomarkers and drug targets involved in diabetic nephropathy mice[J]. Sci Rep , 2015, 5 :11998. DOI:10.1038/srep11998 |
| [14] | XUE L, WANG Y, LIU L, ZHAO L, HAN T, ZHANG Q, et al. A HNMR-based metabonomics study of postmenopausal osteoporosis and intervention effects of Er-Xian Decoction in ovariectomized rats[J]. Int J Mol Sci , 2011, 12 :7635–7651. DOI:10.3390/ijms12117635 |
| [15] | SCHWIMMER H, GERSTBERGER R, HOROWITZ M. Heat acclimation affects the neuromodulatory role of AngⅡ and nitric oxide during combined heat and hypohydration stress[J]. Brain Res Mol Brain Res , 2004, 130 (1/2) :95–108. |
| [16] | 李玉祥, 陈新民, 梁涵, 安合定, 马文领, 史仍飞. 不同热习服条件对大鼠湿热环境下运动能力的影响[J]. 海军医学杂志 , 2016, 37 :4–8. |
| [17] | SCHNEIDER S. Inositol transport proteins[J]. FEBS Lett , 2015, 589 :1049–1058. DOI:10.1016/j.febslet.2015.03.012 |
| [18] | TANG W H, WANG Z, LEVISON B S, KOETH R A, BRITT E B, FU X, et al. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk[J]. N Engl J Med , 2013, 368 :1575–1584. DOI:10.1056/NEJMoa1109400 |
| [19] | 陈军, 周海霞. 浅谈氧化三甲胺(TMAO)[J]. 科技创新导报 , 2012, 19 :143–144. |
| [20] | 张思聪, 张艳蕾, 李福昌. 苏氨酸的代谢及其营养生理作用[J]. 饲料研究 , 2012, 7 :14–17. |
| [21] | 胡艳丽, 李瑞雪, 井丽巍. 牛磺酸的研究进展[J]. 黑龙江医药 , 2015, 4 :728–730. |
| [22] | RANI A, JAYARAJ A, JAYARAM B, PANNURU V. Trimethylamine-N-oxide switches from stabilizing nature:a mechanistic outlook through experimental techniques and molecular dynamics simulation[J]. Sci Rep , 2016, 6 :23656. DOI:10.1038/srep23656 |
 2016, Vol. 37
2016, Vol. 37


