非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(insulin resistance,IR)和遗传易感密切相关的代谢应激性肝脏损伤,是指除外酒精和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[1-2]。2014年世界胃肠病学全球指南指出,非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH)是NAFLD最严重的组织学表现,当NAFLD进展到NASH,可增高肝硬化、肝衰竭及肝细胞癌的风险[3]。NAFLD与糖尿病及肥胖密切相关,世界范围发病率为25%~35%,亚洲范围发病率>10%[4]。近年来随着我国人民生活水平的提高及生活方式的改变,NAFLD的发病率正逐年增加,并有年轻化的趋势。同时,NAFLD是可逆慢性疾病,然而当发展至肝硬化、肝衰竭等晚期阶段则不再可逆。因此,早期准确诊断、评估NAFLD患者的肝脏脂肪含量,对于患者的干预、治疗和随访等临床意义重大。在非创伤性影像学诊断中,磁共振(MR)特别是单体素磁共振波谱分析(MRS)是目前已被广泛认可的研究活体组织代谢、生化改变及化合物定量的方法,但仍然存在扫描时间长、患者配合要求高等限制因素。本研究以单体素MRS为对照,采用3.0T MRI多回波(multi-echo, ME)Dixon序列对肝脏脂肪含量进行定量测定,前瞻性研究其对于NAFLD患者肝脏脂肪含量定量检测的准确性和临床价值。
1 资料和方法 1.1 研究对象前瞻性地纳入2015年7月1日至2015年12月30日期间自愿参加本研究的20例志愿者。其中女性5例中NAFLD患者4例,正常对照者1例;男性15例中NAFLD患者12例,正常对照者3例。年龄29~61岁,平均年龄(43.45±10.55)岁,中位年龄41岁。纳入标准:临床和超声检查确诊的NAFLD患者,以及此时间段内自愿加入本研究的正常人群。排除标准:MR禁忌证者;重度肝脏铁质沉积患者;肝脏肿瘤患者;脾脏切除术后患者;乙肝等肝炎病毒携带者及患者;血清学检查肝功能异常患者;酗酒史者(饮酒每个月>3次每次>5瓶啤酒,或女性>20 g/d、男性>30 g/d);近期3个月内有脂肪肝药物治疗史的患者;家族性遗传疾病者。
1.2 影像学检查方法由同一名具有丰富MR操作经验的技师对所有受试者进行检查。扫描设备:西门子Skyra 3.0T MRI。扫描方法:首先屏气扫描状位T2加权像,并以此为定位像,依次扫描Screening Dixon、ME Dixon、横断位T1加权及T2加权像。定位标准:肝脏包括其中。自动生成Screening Dixon(初筛)报告和脂质含量伪彩图。SVS定位方法:在Screening Dixon图像出来后,在评估菜单下选择撤销二维失真矫正对水相图像进行处理;将处理出来的图像行3D重建冠状位和矢状位,然后将冠状位和矢状位拖进扫描界面,在肝脏最大面选取感兴趣区(ROI),尽量避开肝内汇管区。扫描Histo序列,得出波谱图及相应脂质含量报告。冠状T2加权扫描参数:TR 1 000 ms,TE 99 ms,FOV 340 mm,层厚7 mm,Averages 1,翻转角度160°;Screening Dixon扫描参数:TR 4.19 s,TE 1.23 ms,FOV 420 mm,层厚4 mm,Averages 1,翻转角度7°;ME Dixon序列扫描参数:TR 9.15 ms,TE 1.05 ms,FOV 420 mm,层厚3.5 mm,Averages 1,翻转角度4°;横断位T2加权扫描参数:TR 1 200 ms,TE 95 ms,FOV 420 mm,层厚7 mm,Averages 1,翻转角度160°;横断位T1加权扫描参数:TR 3.97 ms,TE 1.23 ms,FOV 450 mm,层厚4 mm,Averages 1,翻转角度9°;SVS-st-Histo扫描参数:TR 3 000 ms,TE 12 ms,Averages 1,翻转角度90°,volR > > L 30 mm,volA > > P 30 mm,volF > > H 30 mm。
1.3 影像学诊断及后处理数据由同一名具有丰富肝脏疾病影像诊断经验的高年资影像专业住院医师观察图像,分析结果,并经过一名影像专业副主任医师复核。记录每例受试者Screening Dixon序列的肝脏总体脂肪分数(fat fraction,FF)值。在ME Dixon序列,每例受试者测量3个ROI区的FF值。选择区域:左肝1个、右肝2个。将右肝分为两部分:右前叶及右后叶,分别在两部分各选取一个ROI区域,其中一个是与Histo序列ROI区相对应的区域,记为ROI1。所有选择的ROI区域均尽量规避汇管区。观察Histo序列各受试者的单体素MRS的波谱图,记录脂质峰、水峰和FF值。
1.4 统计学处理采用SPSS 20.0软件进行数据分析。分类资料采用百分比(%)表示。应用Spearman方法进行各类FF百分比的相关性分析。检验水准(α)为0.05。
2 结果 2.1 3.0T MRI ME Dixon成像脂肪定量分析基本情况通过初筛扫描(Screening Dixon),首先可以获得受试者全肝脂质含量、铁含量的初步定量,并自动给出受试者是否为NAFLD的初步诊断报告和脂质分布伪彩图(图 1、2)。然后通过一次采集,完成ME精确扫描(ME Dixon),回波数为6(图 3、4)。Screening Dixon及ME Dixon均可以得到同相位(in-phase, IP)、反相位(opp-phase, OP)、脂像、水像图。ME Dixon还可得到T2*脂像、T2*水像、有效T2*图以及自动合成的脂肪分数图, 并可在任意ROI测量肝脏FF值(图 5、6)。最后受试者可以通过ME T2校正的单体素波谱技术(Histo),生成MRS波谱图,并自动生成所选ROI的脂肪定量报告(图 1、2)。本研究中,全部受试者均较好的配合完成检查。
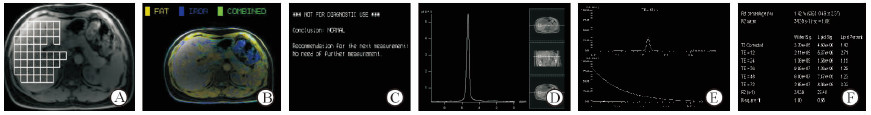
|
图 1 正常肝脏Screening Dixon扫描初筛结果和Histo波谱结果 Fig 1 Results of Screening Dixon and Histo spectra of normal liver |
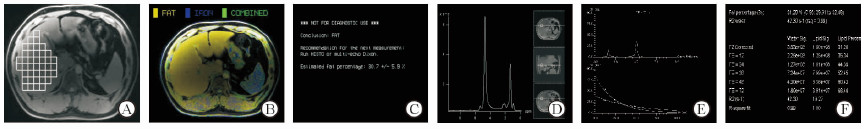
|
图 2 NAFLD肝脏Screening Dixon扫描初筛结果和Histo波谱结果 Fig 2 Results of Screening Dixon and Histo spectra of NAFLD liver |

|
图 3 正常肝脏ME Dixon序列扫描所得6个(A~F)不同TE的回波图像 Fig 3 Multi-echo (ME) Dixon obtained 6 different TE echo images (A-F) of normal liver |
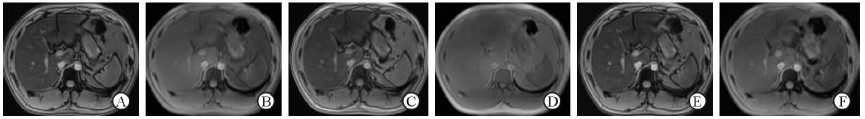
|
图 4 NAFLD肝脏的ME Dixon序列扫描所得6个(A~F)不同TE的回波图像 Fig 4 Multi-echo (ME) Dixon obtained 6 different TE echo images (A-F) of NAFLD liver |
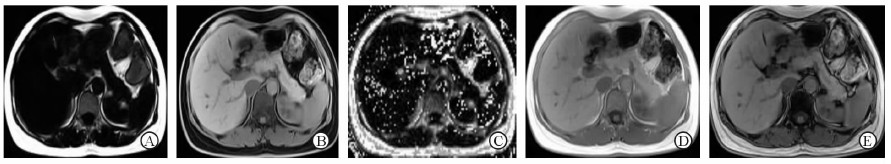
|
图 5 正常肝脏ME Dixon序列扫描所得四相位图和FF图 Fig 5 Four phase diagram and FF map of multi-echo (ME) Dixon of normal liver |
2.2 NAFLD患者肝脏脂肪的影像学表现
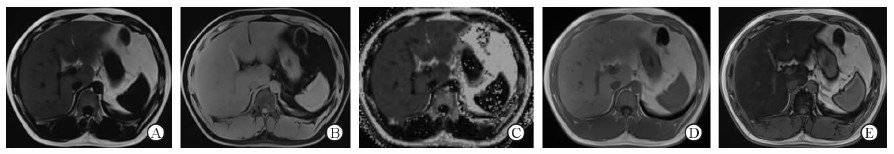
NAFLD受试者的肝脏Screening Dixon伪彩图中脂质(黄色)分布区域较正常受试者明显增大(图 2)。NAFLD受试者ME Dixon同/反相位T1WI(IP/OP)序列表现为:OP图像上肝脏的信号强度较IP图像信号降低;其脂像图像肝脏信号较正常受试者升高,而水像降低(图 6)。NAFLD受试者的Histo单体素波谱中,得到左高右低的谱线,基线较平稳,左侧高耸的为水峰,右侧较低的为脂质峰(图 2D)。
|
图 6 NAFLD肝脏ME Dixon序列四相位图和FF图 Fig 6 Four phase diagram and FF map of multi-echo (ME) Dixon of NAFLD liver |
2.3 3.0 T MRI ME Dixon成像与单体素MRS的相关性分析
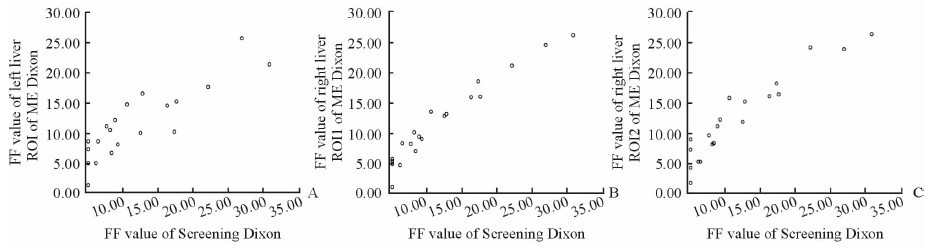
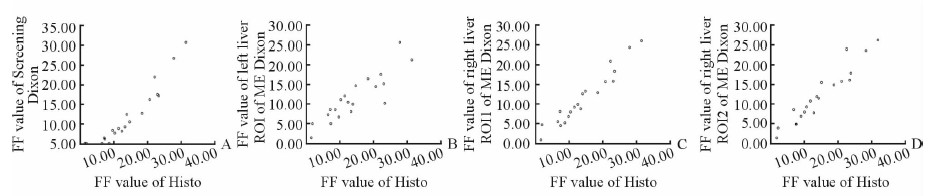
通过比对每一位受试者在各序列测得的FF值,得出Screening Dixon与ME Dixon测得的FF值高度正相关(r=0.842、0.959、0.945,P < 0.001;图 7);Screening Dixon及ME Dixon与Histo测得的FF值高度正相关(r=0.971、0.842、0.959、0.945,P < 0.001;图 8)。
|
图 7 Screening Dixon与ME Dixon的FF值散点分布图 Fig 7 Scatter diagram of FF values of Screening Dixon group and multi-echo (ME) Dixon group |
|
图 8 Screening Dixon、ME Dixon与Histo的FF值散点分布图 Fig 8 Scatter diagrams of FF values of Screening Dixon and multi-echo (ME) Dixon and Histo groups |
3 讨论
NAFLD不仅是西方国家最常见的慢性肝病,目前也已成为我国常见的慢性肝病之一,并有低龄化的趋势。Arulanandan等[5]指出,NAFLD与心血管疾病风险有一定的关联。相当一部分代谢性或感染性疾病都以肝内脂肪的累积(即肝细胞脂肪变性)为前期信号。此外,肝脏脂肪变性的程度指导着活体肝移植术前评估(排除标准:脂肪变性>30%),亦提示肝脏手术患者的预后效果(肝脂肪变性将降低肝细胞功能储备,易导致术后肝衰竭)[6]。故而,定量分析肝脏脂肪含量对掌握NAFLD的早期诊断、动态监测、疗效评估及评价肝脏储备功能有重要价值。2015年2月,日本胃肠病学会(JSGE)发布了《非酒精性脂肪性肝病/非酒精性脂肪性肝炎循证临床实践指南》,指出NAFLD的诊断是基于以下3个标准:(1)影像学或组织学检测出肝脏脂肪变性;(2)无饮酒史或饮酒量女性 < 20 g/d、男性 < 30 g/d;(3)排除如病毒性肝炎、自身免疫性肝脏疾病以及代谢性或遗传性肝病在内的其他可导致脂肪肝的慢性肝病。
虽然细针肝穿刺活检仍然是判断脂肪肝程度及定量分析的金标准,但是其作为创伤性检查,对于大部分NAFLD初期患者以及临床随访并不适用;同时由于穿刺活检的局限性,对于不均匀脂肪肝患者,其结果有一定的片面性。而影像学检查作为非创伤性检查,对NAFLD的脂肪定量分析的作用日趋显著。超声检查是一种行之有效和具有成本效益的脂肪肝的诊断成像技术,特别是用于筛查大量人口中的NAFLD患者。但是,过于依赖操作者[7]、无法明确量化脂肪[8]以及对于轻微NAFLD患者的低敏感性限制了其临床随访功能[9]。CT检查虽可通过绝对肝衰减值(huliver)和肝脾衰减差值(ctl-s)的测量来测定肝脏脂肪含量,且其与病理程度有较强的相关性[10],但仅对于中、重度NAFLD的准确性较高,而对于轻度NAFLD的测定是不准确的,而且结果取决于使用方法和受检群体的差异[11]。到目前为止,双能量CT也尚未被证明在临床具有NAFLD脂肪定量的价值。某动物研究表明,双源、双能量CT相对于常规单能量CT并没有提高NAFLD患者脂肪含量评价的准确性[12]。能谱CT可以通过物质分离技术及单能量成像来鉴别正常肝和轻度脂肪肝并定量。但是,能谱CT配对的基物质并不是组织真实所含有的物质,且能谱CT尚未明确解决肝脏内铁质沉积因素造成的脂肪定量测量的误差。同时,虽然能谱CT称为低辐射的绿色CT,但其仍旧存在射线辐射问题。
MR检查已被认为是一种很敏感的NAFLD检测方法,特别是水脂分离技术和MRS。MRS和MRI均用来测量脂肪中相关细胞的质子数,彼此可直接比较。FF值可以直接计算光谱,确定质子密度直接相关的分子三酰甘油含量,结果中可以明确剔除铁质沉积造成的影响。MRS检查能利用磁共振现象和化学位移作用进行特定原子核及化合物定量分析,主要测定水峰、脂质峰及其峰下面积,是可无创研究活体组织代谢、生化改变及化合物定量的方法,具有空间定位准确、数据分析可靠、对呼吸运动不敏感、图像信噪比高等优点。有文献认为MRS检查可评价脂肪肝的严重程度,诊断效能要高于常规梯度回波化学位移MRI,有望替代肝穿刺活检[13]。常规水脂分离技术(双回波Dixon技术)是利用水和脂肪的共振频率的差异,借助向量运算,得出水、脂分量,实现水、脂分离。通过不同时间点水、脂之间产生的不同相位差,可以得到IP图像、OP图像,还可以得到独立的脂肪信号图(脂像)和水信号图(水像),从而通过公式FF=(SIIP—SIOP)/(2×SIIP)计算得出FF值(SIIP:同相位图信号值;SIOP:反相位图信号值)。普通的双回波因为磁场不均匀造成的T2*衰减效应、T1偏移以及脂质谱的复杂性等因素的影响,其最终计算出得的FF值存在一定的偏移,并不能够确切反映出真实的肝脏脂肪含量[14]。
本研究使用的改良后ME Dixon技术对磁场不均匀性不敏感,其回波时间可以灵活设定,并通过增加回波数减少T2*衰减导致的偏移;可以利用低翻转角度进行数据采集,使T1偏移几乎可以忽略不计;亦可以通过定义扫描仪上的配置文件,对脂肪复杂的失相位因素进行灵活建模。这些优势使得ME Dixon技术的定量分析结果与MRS得到的分析结果具有高度的正相关性,表明运用该技术进行肝脏脂肪定量分析是可行的。同时,虽然MRS的结果能较为真实地反映NAFLD患者肝脏的脂质含量,但同时也暴露出明显的缺陷,MRS单体素成像,其运用的ROI≤3 cm×3 cm×3 cm;虽然相对于活检穿刺而言,其范围大得多,但所得到的结果仍旧具有局限性,并不能反映全肝的脂质含量。ME Dixon技术可以在FF图像上自由选取ROI,不限大小与位置,相较而言更具有临床价值。有学者运用与ME Dixon技术原理相仿的磁共振IDEAL(Iterative Decomposition of water and fat with Echo Asymmetry and Least-squares estimation)技术对49例供体肝脏进行了MRI检查评估及病理学的对照研究,结果显示IDEAL检测脂肪沉积的灵敏度为100%,特异度为91%[15],从侧面证实了ME Dixon技术成像原理的可行性。且ME Dixon技术可以通过一次采集同时获得6回波数据,相较IDEAL技术的两次采集共获得6回波数据[16],缩短了检查时间,减少了呼吸运动造成的误差,提高了该检查的可重复性。此外,本研究使用的ME Dixon技术在提供ME Dixon的精确脂质含量测定之前,还可以通过Screening Dixon扫描技术迅速进行初筛,初步判断受试者是否为NAFLD患者,并给出参考脂像含量报告和直观的伪彩脂质分布图。本研究显示,Screening Dixon结果与波谱和ME Dixon也具有高度相关性,特别是脂质含量较高的NAFLD患者。其扫描简单,通过一次屏气,全肝扫描时间只需要约13 s,使临床医师可以在得到精确的FF值之前,迅速对NAFLD患者的肝脏脂肪含量进行初步且较为准确的判断。
总之,运用经过改良的ME Dixon技术,可一次采集获得ME图像,并可在FF图中自由测得任何所需的FF值,对于肝脏脂肪含量的定量测定, 特别是不均匀脂肪浸润的NAFLD患者的肝脏脂肪测定,其结果较为真实、可信。该检查快速、可靠、无创,对于NAFLD的诊断、随访和干预监测均具有一定的临床价值。
| [1] | 杨伟, 王奇志. 游离脂肪酸与老年2型糖尿病合并原发性非酒精性脂肪肝临床研究[J]. 中华实用诊断与治疗杂志 , 2011, 25 :88–89. |
| [2] | 胡良凯, 孟健, 张建民, 葛军, 孙晓岚, 陈建清, 等. 2型糖尿病合并非酒精性脂肪肝患者颈动脉粥样硬化临床分析[J]. 中华实用诊断与治疗杂志 , 2011, 25 :436–438. |
| [3] | LABRECQUE D R, ABBAS Z, ANANIA F, FERENCI P, KHAN A G, GOH K L, et al. World Gastroenterology Organisation global guidelines:nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. Clin Gastroenterol , 2014, 48 :467–473. |
| [4] | 陈克敏, 林晓珠, 柴维敏. 脂肪性肝病的影像学检查[J]. 诊断学理论与实践 , 2014, 13 :444–445. |
| [5] | ARULANANDAN A, ANG B, BETTENCOURT R, HOOKER J, BEHLING C, LIN G Y, et al. Association between quantity of liver fat and cardiovascular risk in patients with nonalcoholic fatty liver disease independent of nonalcoholic steatohepatitis[J]. Clin Gastroenterol Hepatol , 2015, 13 :1513–1520. DOI:10.1016/j.cgh.2015.01.027 |
| [6] | ANGELICO M. Donor liver steatosis and graft selection for liver transplantation:a short review[J]. Eur Rev Med Pharmacol Sci , 2005, 9 :295–297. |
| [7] | LEE S S, PARK S H, KIM H J, KIM S Y, KIM M Y, KIM D Y, et al. Non-invasive assessment of hepatic steatosis:prospective comparison of the accuracy of imaging examinations[J]. J Hepatol , 2010, 52 :579–585. DOI:10.1016/j.jhep.2010.01.008 |
| [8] | KURODA H, KAKISAKA K, KAMIYAMA N, OIKAWA T, ONODERA M, SAWARA K, et al. Non-invasive determination of hepatic steatosis by acoustic structure quantification from ultrasound echo amplitude[J]. World J Gastroenterol , 2012, 18 :3889–3895. DOI:10.3748/wjg.v18.i29.3889 |
| [9] | LEE S S, PARK S H. Radiologic evaluation of nonalcoholic fatty liver disease[J]. World J Gastroenterol , 2014, 20 :7392–7402. DOI:10.3748/wjg.v20.i23.7392 |
| [10] | PICKHARDT P J, PARK S H, HAHN L, LEE S G, BAE K T, YU E S. Specificity of unenhanced CT for non-invasive diagnosis of hepatic steatosis:implications for the investigation of the natural history of incidental steatosis[J]. Eur Radiol , 2012, 22 :1075–1082. DOI:10.1007/s00330-011-2349-2 |
| [11] | VAN WERVEN J R, MARSMAN H A, NEDERVEEN A J, SMITS N J, TEN KATE F J, VAN GULIK T M, et al. Assessment of hepatic steatosis in patients undergoing liver resection:comparison of US, CT, T1-weighted dual-echo MR imaging, and point-resolved 1H MR spectroscopy[J]. Radiology , 2010, 256 :159–168. DOI:10.1148/radiol.10091790 |
| [12] | ARTZ N S, HINES C D, BRUNNER S T, AGNI R M, KVHN J P, ROLDAN-ALZATE A, et al. Quantification of hepatic steatosis with dual-energy computed tomography:comparison with tissue reference standards and quantitative magnetic resonance imaging in the ob/ob mouse[J]. Invest Radiol , 2012, 47 :603–610. |
| [13] | 赵黎明, 宋彬, 陈光文, 袁放. 3.0T 1H-MRS和梯度回波化学位移MRI在定量分析肝脏脂肪含量的价值[J]. 实用放射学杂志 , 2010, 26 :1452–1456. |
| [14] | KANG B K, YU E S, LEE S S, LEE Y, KIM N, SIRLIN C B, et al. Hepatic fat quantification:a prospective comparison of magnetic resonance spectroscopy and analysis methods for chemical-shift gradient echo magnetic resonance imaging with histologic assessment as the reference standard[J]. Invest Radiol , 2012, 47 :368–375. DOI:10.1097/RLI.0b013e31824baff3 |
| [15] | JOE E, LEE J M, KIM K W, LEE K B, KIM S J, BAEK J H, et al. Quantification of hepatic macrosteatosis in living, related liver donors using T1-independent, T2*-corrected chemical shift MRI[J]. J Magn Reson Imaging , 2012, 36 :1124–1130. DOI:10.1002/jmri.v36.5 |
| [16] | 焦志云, 李澄, 何玲, 王礼同, 杜芳, 颜虹.运用3.0T磁共振IDEAL-IQ技术进行肝脏脂肪定量分析的可行性研究[J/CD].中华临床医师杂志:电子版, 2015, 9:30-33. http://d.wanfangdata.com.cn/Periodical/zhlcyszz201519008 |
 2016, Vol. 37
2016, Vol. 37


