2. 南昌大学第一附属医院肝胆胰外科, 南昌 330000;
3. 第二军医大学东方肝胆外科医院肝外三科, 上海 200438;
4. 南昌大学附属新余医院肿瘤中心, 新余 338000
2. Department of Hepatobiliary and Pancreatic Surgery, The First Affiliated Hospital, Nanchang University, Nanchang 330000, Jiangxi, China;
3. Department of Hepatobiliary Surgery(Ⅲ), Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
4. Cancer Center, Xinyu People's Hospital Affiliated to Nanchang University, Xinyu 338000, Jiangxi, China
原发性肝癌(hepatocellular carcinoma,HCC)是一种常见的消化系统恶性肿瘤,预后差,死亡率位居世界常见肿瘤的第3位[1], 在我国位居第2位[2]。手术治疗是肝癌最有效的治疗方式[3],然而有多种因素会影响肝癌的预后[4]。研究表明,合并2型糖尿病(T2DM)能够增加肝癌患者的死亡率[5-7]。T2DM是一种全球范围内的常见的慢性病,近年来随着我国人民生活水平的提高,其发病率正在逐年增加,有研究预测我国将成为世界糖尿病第一大国[8-9]。同时随着社会老龄化的加速,将会有更多合并T2DM的老年人接受手术治疗,年龄成为手术前必须考虑的因素。本研究回顾性分析250例行肝癌根治性切除的乙型肝炎病毒相关肝癌合并糖尿病患者的临床资料,根据年龄将其分为老年组(≥60岁)58例和非老年组(<60岁)192例,应用倾向值匹配(propensity score matching,PSM)法对两组的协变量进行均衡化处理,对匹配前后肝癌的术后生存情况进行对比分析,探讨年龄对乙型肝炎病毒相关肝癌合并糖尿病患者预后的影响。
1 资料和方法 1.1 一般资料回顾性分析2000年1月至2013年12月期间在南昌大学第一附属医院和第二军医大学东方肝胆外科医院住院的250例乙型肝炎病毒相关肝癌合并糖尿病患者的临床资料。病例纳入标准:(1) 肝癌的首次治疗为根治性切除术;(2) 肝功能Child-Pugh评分A级或B级;(3) 年龄30~80岁;(4) 术后病理诊断为肝细胞癌;(5) 乙肝表面抗原阳性。排除标准:(1) 术前接受过经肝动脉化疗栓塞术、射频消融或其他抗肿瘤治疗;(2) 合并门静脉主干及一级分支、总肝管及一级分支、肝静脉主干及下腔静脉癌栓;(3) 肝外转移;(4) 同期罹患其他器官恶性肿瘤或其他严重疾病;(5) 肝癌破裂。本研究获得医院伦理委员会批准,并取得患者知情同意书。根据患者年龄是否≥60岁分组,将患者分为老年组和非老年组,其中老年组58例,非老年组192例。
1.2 诊断标准及随访方法肝癌和糖尿病的诊断标准分别符合欧洲肝病学协会标准[10]和1999年世界卫生组织(WHO)糖尿病诊断标准[11]。肝癌根治性切除术定义为:完整切除肉眼可见肿瘤,切缘距肿瘤为1 cm,病理证实切缘无癌残留[12]。肝硬化的诊断由术后病理证实。糖尿病治疗包括饮食调整、口服双胍类及磺酰脲类降糖药物、胰岛素注射和中药治疗。肝癌复发包括肝内和肝外复发,复发定义为:CT或MRI检查发现肝内外新发病灶,或者甲胎蛋白水平持续性升高。患者出院后每3个月随访1次,随访截止时间为2014年7月30日。
1.3 PSM方法PSM方法用于减少老年组和非老年组患者基线特征之间的差异,使两组间协变量平衡分布,减少混杂因素影响。以老年组为基准,按1:2比例进行匹配,卡钳值为0.2。进入倾向评分模型的协变量有:性别、术前糖尿病病程、体质量指数、血红蛋白、血小板、凝血酶原时间、空腹血糖、白蛋白、总胆红素、丙氨酸转氨酶、天冬氨酸转氨酶、乙肝表面抗原、肝癌病理分级、肿瘤最大直径、肿瘤数量、肿瘤包膜是否完整、复发后治疗、肝硬化、BCLC分期、术后并发症。
1.4 统计学处理采用SPSS 21.0统计软件进行数据的统计分析。正态分布的计量资料用x±s表示,组间比较采用t检验;非正态分布的计量资料用中位数和范围表示,组间比较采用Mann-Whitney U检验。计数资料用例数(百分比)表示,组间率的比较采用χ2检验。总体生存(overall survival, OS)率用Kaplan-Meier法估计,两组间的差异用Log-rank检验进行比较。术后生存危险因素的多因素分析采用Cox比例风险模型。检验水准(α)为0.05。
2 结果 2.1 两组患者匹配前后基线资料分析由表 1可见,匹配前的协变量中血红蛋白、丙氨酸转氨酶、空腹血糖、肝硬化、术前糖尿病病程5个协变量在组间分布不平衡(P<0.05);老年组和非老年组患者在包括肝功能衰竭、术后大出血、腹腔感染和肺部感染等术后严重并发症发生率方面总体比较差异无统计学意义(P=0.96);全组患者术后90 d内死亡3例,均为非老年组(肝功能衰竭死亡2例,术后大出血死亡1例)。在采用1:2最近邻居匹配法,卡钳值取0.2,以老年组为基准组进行匹配成功后,老年组为53例,非老年组为85例,匹配后组间所有协变量均达到平衡。
|
|
表 1 匹配前后患者临床资料分布情况 |
2.2 匹配前后生存分析 2.2.1 匹配前后的生存率
匹配前老年组和非老年组术后累积中位生存时间分别是70个月和53个月,1、3、5年OS率分别为:94.8% vs 93.7%; 75.6% vs 66.9%; 55.3% vs 45.2% (图 1)。匹配后老年组和非老年组术后累积中位生存时间分别是67个月和45个月,1、3、5年OS率分别为:94.5% vs 90.6%; 73.2% vs 61.2%; 52.9% vs 43.7%(图 2)。经Log-rank检验比较,匹配前后两组OS率差异均无统计学意义(P>0.05)。
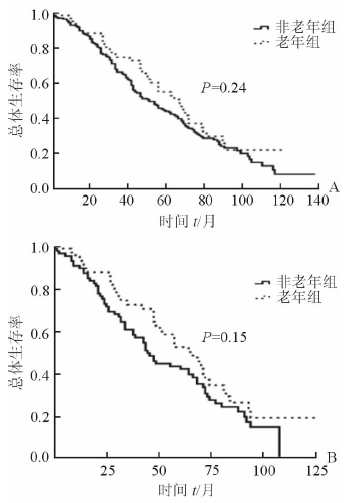
|
图 1 匹配前和匹配后两组总体生存率比较 A:匹配前,老年组n=58,非老年组n=192; B:匹配后,老年组n=53,非老年组n=85 |
2.2.2 术后生存危险因素分析
Cox回归单因素分析显示:肿瘤数量、甲胎蛋白水平、血红蛋白、复发后治疗均与肝癌术后生存有关。进一步多因素分析显示:血红蛋白、复发后治疗和肿瘤数量是影响肝癌患者术后总体生存的独立预后因素(表 2),年龄≥60岁不是影响肝癌患者术后总体生存的危险因素。
|
|
表 2 138例匹配后肝癌患者预后多因素分析 |
3 讨论
肝功能Child分级和心肺功能储备是影响肝癌手术成败的重要因素,尤其是合并糖尿病的老年人,因其主要器官功能储备下降和免疫能力减弱,手术风险也随之增大,但研究认为高龄并不增加肝癌手术的并发症和死亡率[13-15]。本研究显示,合并糖尿病的老年肝癌患者(≥60岁,58例)和非老年肝癌患者(<60岁,192例)在术后并发症发生率方面差异无统计学意义(P=0.96),全组术后90 d内死亡3例,均为非老年组(肝功能衰竭死亡2例,术后大出血死亡1例);老年组患者血红蛋白低于非老年组(P=0.00),丙氨酸转氨酶和肝硬化等指标优于非老年组(P=0.01,P=0.04),术前糖尿病病程明显长于非老年组(P=0.01),但血糖控制优于非老年组(P=0.03),提示非老年组患者存在糖代谢紊乱和肝功能储备低下,这增加了非老年组患者术后出现肝功能衰竭的可能性。与Kim等[13]的研究结果一致,老年组的累积中位生存时间和1、3、5年OS率与非老年组比较差异无统计学意义(P=0.24),这提示年龄不影响肝癌患者OS率,但2项来自国内的最新研究结果并不支持这一结论[16-17]。为了进一步检验该初步结论,本研究使用了PSM法对两组进行合理匹配,该方法能降低偏倚,保证组间基线资料的均衡可比,达到近似随机对照临床研究的结果[18],在西方等发达国家,PSM法已被广泛应用于非随机的观察性研究中[19]。
本研究有53例老年组患者和85例非老年组患者成功匹配,组间所有协变量的标准差异(绝对值)均在0.1以内,保证了组间基线资料的可比性和研究结果的可靠性。本研究发现,匹配后,老年组和非老年组患者的OS率比较差异仍无统计学意义(P=0.15);多因素分析显示:血红蛋白、复发后治疗和肿瘤数量是影响合并糖尿病的肝癌患者术后总体生存的独立预后因素, 年龄≥60岁不是合并糖尿病的肝癌患者术后总体生存的危险因素。黄锦龙等[20]通过对721例行手术切除的原发性肝癌患者的预后因素分析发现,肿瘤数量是影响肝癌预后的独立危险因素(HR:1.811, 95%CI:1.232~2.661),而年龄并非是影响肝癌预后的独立危险因素,这与本研究结果一致。
总之,在匹配前后,本研究都得出了一致的研究结果,这表明年龄≥60岁确实不影响接受了肝癌根治性手术、合并糖尿病的乙型肝炎病毒相关肝癌患者的术后生存率,对于符合手术指征的老年肝癌患者应积极行手术治疗。
| [1] | SHERMAN M. Epidemiology of hepatocellular carcinoma[J]. Oncology , 2010, 78 (Suppl 1) :7–10. |
| [2] | 中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作委员会, 中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治专家共识[J]. 临床肿瘤学杂志 , 2009, 14 :259–269. |
| [3] | OMATA M, LESMANA L A, TATEISHI R, CHEN P J, LIN S M, YOSHIDA H, et al. Asian Pacific Association for the study of the liver consensus recommendations on hepatocellular carcinoma[J]. Hepatol Int , 2010, 4 :439–474. DOI:10.1007/s12072-010-9165-7 |
| [4] | TANDON P, GARCIA-TSAO G. Prognostic indicators in hepatocellular carcinoma:a systematic review of 72 studies[J]. Liver Int , 2009, 29 :502–510. DOI:10.1111/liv.2009.29.issue-4 |
| [5] | YANG W S, VA P, BRAY F, GAO S, GAO J, LI H L, et al. The role of pre-existing diabetes mellitus on hepatocellular carcinoma occurrence and prognosis:a meta-analysis of prospective cohort studies[J]. PLoS One , 2011, 6 :e27326. DOI:10.1371/journal.pone.0027326 |
| [6] | WANG W M, XU Y, YANG X R, WANG Y H, SUN H X, FAN J. Prognostic role of diabetes mellitus in hepatocellular carcinoma patients after curative treatments:a meta-analysis[J]. Hepatobiliary Pancreat Dis Int , 2011, 10 :346–355. DOI:10.1016/S1499-3872(11)60059-3 |
| [7] | RAFFETTI E, PORTOLANI N, MOLFINO S, BAIOCCHI G L, LIMINA R M, CACCAMO G, et al. Role of aetiology, diabetes, tobacco smoking and hypertension in hepatocellular carcinoma survival[J]. Dig Liver Dis , 2015, 47 :950–956. DOI:10.1016/j.dld.2015.07.010 |
| [8] | 中华医学会糖尿病分会. 中国2型糖尿病防治指南(2007版)[J]. 中华医学杂志 , 2008, 88 :1227–1245. |
| [9] | Summary of revisions for the 2008 Clinial Practice Recommendations[J].Diabetes Care, 2008, 31(Suppl 1):S3-S4. http://care.diabetesjournals.org/content/31/Supplement_1/S3.extract?cited-by=yes&legid=diacare;31/Supplement_1/S3 |
| [10] | BRUIX J, SHERMAN M. Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma[J]. Hepatology , 2005, 42 :1208–1236. DOI:10.1002/hep.v42:5 |
| [11] | World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1:Diagnosis and classification of diabetes mellitus:WHO/NCD/NCS/99.2[S]. Geneva:World Health Organization, 1999. https://www.staff.ncl.ac.uk/philip.home/who_dmc.htm |
| [12] | 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肿瘤学杂志 , 2011, 16 :929–946. |
| [13] | KIM J M, CHO B I, KWON C H, JOH J W, PARK J B, LEE J H, et al. Hepatectomy is a reasonable option for older patients with hepatocellular carcinoma[J]. Am J Surg , 2015, 209 :391–397. DOI:10.1016/j.amjsurg.2013.06.010 |
| [14] | KONDO K, CHIJⅡWA K, FUNAGAYAMA M, KAI M, OTANI K, OHUCHIDA J. Hepatic resection is justified for elderly patients with hepatocellular carcinoma[J]. World J Surg , 2008, 32 :2223–2229. DOI:10.1007/s00268-008-9688-4 |
| [15] | TSUJITA E, UTSUNOMIYA T, OHTA M, TAGAWA T, MATSUYAMA A, OKAZAKI J, et al. Outcome of repeat hepatectomy in patients with hepatocellular carcinoma aged 75 years and older[J]. Surgery , 2010, 147 :696–703. DOI:10.1016/j.surg.2009.10.054 |
| [16] | XU X S, CHEN W, MIAO R C, ZHOU Y Y, WANG Z X, ZHANG L Q, et al. Survival analysis of hepatocellular carcinoma:a comparison between young patients and aged patients[J]. Chin Med J (Engl) , 2015, 128 :1793–1800. DOI:10.4103/0366-6999.159356 |
| [17] | 苗润晨, 许鑫森, 陈伟, 周延岩, 万永, 吕毅, 等. 年龄因素对肝癌肝切除术患者长期预后的影响[J]. 现代肿瘤医学 , 2014, 22 :1123–1126. |
| [18] | AUSTIN P C. Optimal caliper widths for propensity-score matching when estimating differences in means and differences in proportions in observational studies[J]. Pharm Stat , 2011, 10 :150–161. DOI:10.1002/pst.v10.2 |
| [19] | AUSTIN P C. A critical appraisal of propensity-score matching in the medical literature between 1996 and 2003[J]. Stat Med , 2008, 27 :2037–2049. DOI:10.1002/(ISSN)1097-0258 |
| [20] | 黄锦龙, 王清, 于勇, 姜小清, 罗祥基. 解剖性肝切除对肝细胞癌预后的影响[J]. 第二军医大学学报 , 2015, 36 :492–499. |
 2016, Vol. 37
2016, Vol. 37


