2. 宜春学院化学与生物工程学院, 宜春 336000;
3. 沈阳药科大学中药学院, 沈阳 110015
2. College of Chemical and Biological Engineering, Yichun University, Yichun 336000, Jiangxi, China;
3. College of Traditional Chinese Pharmacology, Shenyang Pharmaceutical University, Shenyang 110015, Liaoning, China
环磷酰胺(cyclophosphamide,CTX)作为一种烷化剂类抗肿瘤药物,临床上常用于治疗多发性骨髓瘤、急性或慢性淋巴细胞白血病等疾病[1-2]。CTX原型无活性,主要通过代谢酶CYP2B6、CYP2C9/19及CYP3A作用生成磷酰胺氮芥并与DNA发生交叉连接,阻断DNA的合成,抑制肿瘤细胞的生长繁殖[3]。据报道,临床上相同剂量CTX在不同个体间的代谢速度差异很大(15~50倍不等);另外,临床上使用高剂量CTX(>1.0 g/m2)进行冲击治疗时,其代谢比常规剂量(0.12~0.24 g/m2)更为复杂,主要表现为CTX及其代谢物的药代动力学行为不同于常规剂量,并且毒性代谢物生成量相对较高,不良反应发生率上升[4]。
关于CTX及其代谢物含量的监测方法在国内外已有诸多报道,近年来常规的检测方法有HPLC、GC-MS/MS或LC-MS/MS法,多数检测方法仅检测其中1种或2种化合物,并且大多数是测定常规剂量或小剂量CTX给药后的血药浓度[5-9]。Kalhorn等[10]和Sadagopan等[11]虽然对CTX的活性代谢产物4-羟基环磷酰胺和磷酰胺氮芥进行了测定,但由于这两种化合物十分不稳定(其中4-羟基环磷酰胺的消除半衰期仅4 min),对实验环境和实验者要求很高,实际应用较为局限。因此,本课题通过监测其他4种化合物来间接反映这些活性及毒性产物的生成情况。为了有效监测CTX及其代谢产物的浓度,本研究采用UHPLC-MS/MS系统建立了快速、灵敏的检测方法,为CTX高剂量给药后大鼠的药代动力学研究及临床安全用药提供参考依据。
1 仪器和试药 1.1 仪器设备Agilent 1290超高效液相色谱仪、G6460型三重四级杆串联质谱仪、Agilent Masshunter B.06.00工作站(Agilent公司,美国);CPA225D十万分之一天平(Sartorius公司,德国);labnet VX-200漩涡混合仪(Labnet公司,美国);5810R型低温高速离心机、微量移液器(Eppendorf公司,德国);真空浓缩离心机(Gene公司,中国香港);DAS 2.0统计学软件(中国药理学会)。
1.2 实验试剂羧基磷酰胺(carboxy phosphamide,CPM)对照品(批号:C181350,纯度:96%)、4-酮基环磷酰胺(4-ketocyclophosphamide,4-Keto CTX)对照品(批号:O849900,纯度:98%)、脱氯乙基环磷酰胺(dechloroethylcyclophosphamide,DC-CTX)对照品(批号:D226400,纯度:96%)均购自加拿大TRC公司;CTX对照品(批号:079K1569,纯度:99%)购自美国Sigma-Aldrich公司;替硝唑(tinidazole,TNZ;批号:10036-200703,纯度>98%)购自中国食品药品检定研究院。CTX粉针(规格:0.2 g/瓶,批号:5A047B)购自德国Baxer公司;医用生理盐水(第二军医大学长征医院);甲醇、乙腈及乙酸铵为色谱纯,其他试剂为分析纯。
2 方法和结果 2.1 UHPLC-MS/MS条件 2.1.1 色谱条件色谱柱:Agilent poroshell SB-C18(75 mm×2.1 mm,2.7 μm);流动相:10 mmol/L乙酸铵溶液(A)-甲醇(B),梯度洗脱程序如下:0~0.5 min,10%~15%(B);0.5~0.6 min,15%~30%(B);0.6~3.7 min,30%~90%(B);流速:0.25 mL/min;柱温:25℃;进样量:5 μL;分析时间:3.7 min。
2.1.2 质谱条件离子源参数:电喷雾离子源(ESI);鞘流气:350℃,12 L/min;干燥气:325℃,10 L/min;碰撞气压力:40 psi(1psi=6 894.8 pa);毛细管电压:4 000 V;监测模式:多重反应离子监测(multiple reaction monitoring,MRM)正离子模式;离子通道:CTX [M+H]+ m/z 261.10→140.10,碰撞诱导解离电压(F)=135 V,碰撞能量(CE)=22 eV;CPM [M+H]+ m/z 293.10→221.10,F=90 V,CE=15 eV;4-Keto CTX [M+H]+ m/z 275.10→142.10,F=125 V,CE=27 eV;DC-CTX [M+H]+ m/z 199.20→78.00,F=120 V,CE=21 eV;内标TNZ [M+H]+ m/z 248.10→121.10,F=90 V,CE=14 eV。
2.2 实验溶液制备 2.2.1 对照品溶液制备分别精密称取CTX、CPM、4-Keto CTX、DC-CTX及TNZ适量,加甲醇溶解制成浓度均为2 mg/mL的储备液。以10%乙腈作为稀释剂制备8个水平的标准曲线工作溶液:CTX、4-Keto CTX及CPM浓度均为80、40、20、8、4、2、0.8、0.4 μg/mL,DC-CTX浓度为20、10、5、2、1、0.5、0.2、0.1 μg/mL;3个水平的质控(quality control, QC)工作液:CTX、4-Keto CTX及CPM浓度均为0.8、4、20 μg/mL,DC-CTX浓度为0.2、1、5 μg/mL。储备液贮藏于-20℃冰箱,工作液贮藏于4℃冰箱。TNZ用乙腈溶解配制成6 ng/mL的溶液备用。
2.2.2 标准曲线血浆添加样品和QC样品配制分别精密移取50 μL各对照品8个水平的标准曲线工作溶液于1.5 mL的离心管中,再精密移取950 μL大鼠空白血浆于各管中,涡旋混匀即得8个水平的标准曲线血浆添加样品:CTX、4-Keto CTX及CPM(4 000、2 000、1 000、400、200、100、40、20 ng/mL),DC-CTX(1 000、500、250、100、50、25、10、5 ng/mL)。低、中、高3个水平的QC样品浓度如下:CTX、4-Keto CTX及CPM均为40、200、1 000 ng/mL,DC-CTX为10、50、250 ng/mL。
2.3 血浆样品预处理大鼠血浆样品取出后置于室温条件下融化。取血浆30 μL加870 μL生理盐水进行稀释。涡旋混匀30 s,取100 μL稀释样品置于1.5 mL的离心管中,加入内标TNZ(6 ng/mL)的乙腈溶液400 μL,涡旋混匀1.5 min。4℃ 21 912.8×g离心15 min,取上清100 μL加10%乙腈400 μL稀释后,涡旋混匀30 s。4℃ 21 912.8×g离心15 min,离心5 min,取上清进样分析。
2.4 方法学考察 2.4.1 质谱条件取储备液用10%乙腈稀释制备成浓度均为200 ng/mL的CTX、CPM、4-Keto CTX、DC-CTX及TNZ标准品溶液,按照2.1项下条件进样分析,经过对质谱参数的优化使各化合物响应最佳,同时各化合物之间不产生相互干扰,在质谱product ion监测模式下,各化合物的二级产物离子图见图 1。
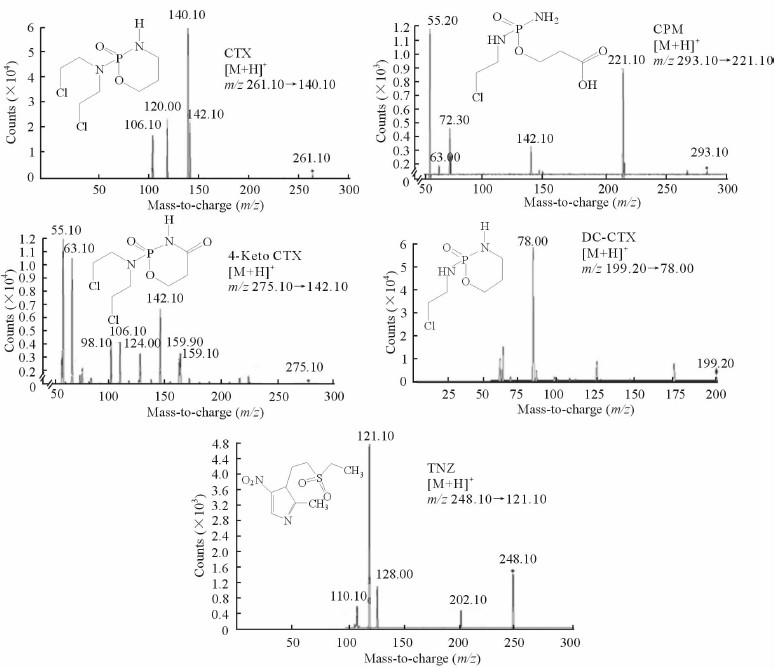
|
图 1 CTX、CPM、4-Keto CTX、DC-CTX及TNZ的二级产物离子图 Fig 1 MS 2 scan mass spectra of CTX, CPM, 4-Keto CTX, DC-CTX and TNZ |
2.4.2 方法专属性
分别取6份大鼠空白血浆(blank plasmas),CTX、CPM、4-Keto CTX浓度为400 ng/mL及DC-CTX浓度为100 ng/mL的标准血浆添加样品(blank plasma spiked with standards)和大鼠给药后的血浆样品(test samples),按2.3项下方法处理后进样分析,CTX、CPM、4-Keto CTX、DC-CTX及内标TNZ的保留时间分别为3.29、2.20、2.75、2.35和2.38 min。MRM提取色谱图见图 2,实验结果表明空白血浆中的杂质对待测化合物无干扰,该方法专属性良好。
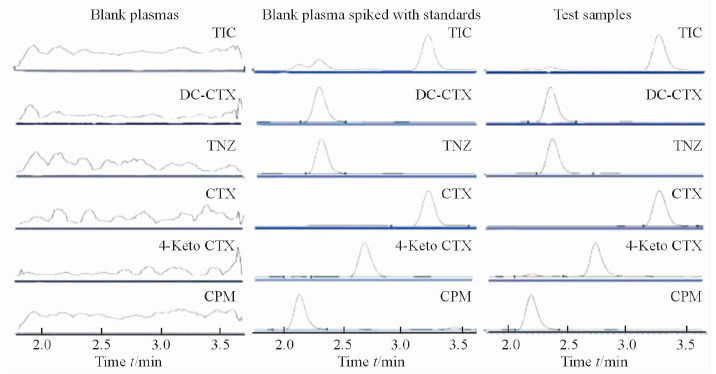
|
图 2 CTX、CPM、4-Keto CTX、DC-CTX及TNZ的MRM提取色谱图 Fig 2 MRM extracted chromatograms of CTX, CPM, 4-Keto CTX, DC-CTX and TNZ in rat plasma |
2.4.3 标准曲线、线性范围及最低检测限
分别取各浓度CTX、CPM、4-Keto CTX及DC-CTX的标准曲线血浆添加样品在室温下放置融化,按2.3项下方法操作,每一浓度取3个样本进行平行分析。以待测物浓度为横坐标(x),待测物与内标的峰面积比为纵坐标(y)进行加权线性回归,权重系数为1/x2,得各标准曲线血浆添加样品的标准曲线方程、最低定量限(lower limit of quantification,LLOQ)及检测限(limit of detection,LOD),见表 1。
|
|
表 1 CTX、CPM、4-Keto CTX和DC-CTX的线性回归方程 Tab 1 Regression equation of CTX, CPM, 4-Keto CTX and DC-CTX |
2.4.4 精密度与准确度
取3个浓度水平的CTX、CPM、4-Keto CTX及DC-CTX的QC样品和标准曲线最低浓度点的样品,按照2.3项下方法操作,每个浓度样品平行制备5份,连续测定3 d。根据当天的标准曲线计算每一样本实测浓度,计算各化合物在每个浓度下的日内、日间相对标准差(RSD)及准确度,结果表明各样品的精密度及准确度均符合血浆生物样本测定要求,见表 2。
|
|
表 2 CTX、CPM、4-Keto CTX和DC-CTX的日内、日间精密度和准确度 Tab 2 Intra-day and inter-day precision of CTX, CPM, 4-Keto CTX and DC-CTX |
2.4.5 稀释效应
取大鼠空白血浆配制CTX浓度为150 μg/mL及CPM、4-Keto CTX和DC-CTX浓度均为20 μg/mL的标准血浆添加样品,再用空白血浆将其稀释50倍,然后按照2.3项下方法操作制备5份,进样分析。结果显示各样品稀释效应的准确度和精密度分别为CTX(-6.63%,7.53%)、CPM(12.62%,8.93%)、4-Keto CTX(-12.02%,12.10%)和DC-CTX(-1.91%,4.21%),均符合测定要求。
2.4.6 稳定性精密制备3个水平的CTX、CPM、4-Keto CTX及DC-CTX的QC样品,考察各样品室温放置6 h、进样室(4℃)放置24 h、循环冻融3次及冻存(-20℃)15 d的稳定性。所有样品均平行制备3份,按2.3项下方法进样分析。结果显示所有QC样品的准确度均在标示值的-15%~15%之间,RSD均小于15%,符合测定要求,表明CTX、CPM、4-Keto CTX及DC-CTX在上述条件下均稳定性良好。
2.4.7 提取回收率和基质效应分别取高、中、低3个水平的各样品工作溶液,以相同体积(950 μL)的水代替空白血浆进行添加,其他操作与2.3项相同,样品进样分析得峰面积A1;另取3个浓度水平的QC样品按2.3项下方法处理后进样得峰面积B1,即得提取回收率(%)=(B1/A1)×100%,结果表明各化合物的提取回收率均在(66.44±5.53)%~(96.66±1.73)%之间。另取部分空白血浆并提取获取上清液,4℃真空条件下高速离心挥干,分别用高、中、低3个水平的各样品工作溶液复溶,制得终浓度与标准血浆添加样品相同的溶液,3个水平的样品各制备6份,进样得峰面积C1,即得基质因子(%)=(C1/A1)×100%,设定分析物基质因子为m,内标基质因子为n,则m/n即为内标归一化基质因子,结果显示各化合物归一化基质因子偏差均在-15%~15%之间,表明血浆基质不干扰测定。
2.5 大鼠血浆药动学研究 2.5.1 实验动物给药及采血8只成年雄性SD大鼠,体质量(220±20)g,由上海斯莱克实验动物有限责任公司提供[许可证号:SCXK(沪)2007-0005]。所有动物均在第二军医大学药学院动物房环境[12 h黑暗/12 h光照,温度(25±2)℃]正常饲养1周时间,在实验开始前禁食12 h。第2天分别按300 mg/kg的剂量尾静脉注射CTX溶液,于给药后5、15、30 min和1、2、3、4、6、8、12、24 h从大鼠眼眶静脉丛采血0.2~0.3 mL,置于1.5 mL肝素化的离心管中,轻轻混匀,随即1 006.2×g离心10 min分离血浆,置于-20℃冰箱中保存,并在2周内完成测定。
2.5.2 实验数据处理及实验结果大鼠血浆2.1项下的方法进行测定,4种化合物的原始血药浓度数据采用DAS 2.0软件进行二房室模型法拟合,不加权。Cmax 、Tmax均为实测值,其他药动学参数均采用梯形拟合。各化合物的血药浓度-时间曲线见图 3,药代动力学参数见表 3。
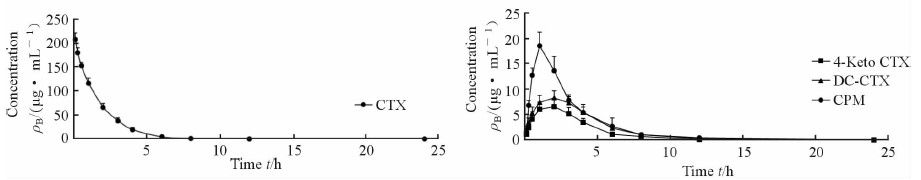
|
图 3 CTX、CPM、4-Keto CTX及DC-CTX的平均血药浓度-时间曲线图 Fig 3 Mean plasma concentration-time curves of CTX, CPM, 4-Keto CTX and DC-CTX |
|
|
表 3 CTX、CPM、4-Keto CTX及DC-CTX的药代动力学参数 Tab 3 Pharmacokinetic parameters of CTX, CPM, 4-Keto CTX and DC-CTX |
3 讨论 3.1 色谱及质谱条件的优化
由于粒径为2.7 μm的实心poroshell色谱柱对分析物具有较好的分离度,近年来常用于生物样品分析。本研究参考相关文献[4-7]考察了乙腈/甲醇-甲酸水溶液、乙腈/甲醇-乙酸铵水溶液以及乙腈/甲醇-甲酸与乙酸铵混合水溶液等不同流动相,结果发现甲醇-10 mmol/L乙酸铵水溶液为流动相时待测物的响应、峰形较好。此外,本研究发现,在分析CTX浓度较高的样品时,CTX表现出微小残留,但均未超过20%的LLOQ,因此可在每进样10次样品后增进1针空白溶剂,减少CTX的系统残留。
3.2 样品前处理本研究中样品前处理采用了简单、快速的蛋白沉淀法。预实验结果表明,相对于甲醇,乙腈的沉淀效果更好,并且采用甲醇沉淀后的样品容易导致仪器系统压力升高,因此选择乙腈进行沉淀。而在优化沉淀剂比例时,本研究也尝试了不同比例的V血浆:V沉淀剂(1:2,1:3,1:4,1:5,1:6),结果发现当二者比例超过1:4后,提取回收率均无明显差异,故最终选择血浆与乙腈体积比为1:4的方案。获得的上清液需要进行稀释后进样,以获得较好的基质效应和色谱图,由于稀释会耗费较多的大鼠空白血浆,本研究对比了血浆和生理盐水作为稀释剂对待测物质色谱响应及相应的基质效应、提取回收率的影响,结果发现两种稀释剂的结果差别不大,故最终选择生理盐水作为稀释剂。预实验结果表明CTX的Cmax>200 μg/mL,其代谢物CPM、4-Keto CTX及DC-CTX的浓度也均较高,而UHPLC-MS/MS方法灵敏度较高,因此本实验考察了稀释效应,且结果符合方法学要求。
综上所述,本文建立的UHPLC-MS/MS法测定血浆中CTX及其代谢产物CPM、4-Keto CTX及DC-CTX的血药浓度符合生物样本分析要求,方法操作简单、检测耗时少、灵敏度高、重现性好,样品前处理简便,适用于CTX高剂量给药后血浆的药代动力学研究。
| [1] | 韦凤华. 环磷酰胺临床应用研究进展[J]. 中国药事 , 2013, 27 :324–326. |
| [2] | QUACH H, JOSHUA D, HO J, SZER J, SPENCER A, HARRISON S, et al. Treatment of patients with multiple myeloma who are eligible for stem cell transplantation:position statement of the Myeloma Foundation of Australia Medical and Scientific Advisory Group[J]. Intern Med J , 2015, 45 :335–343. DOI:10.1111/imj.12688 |
| [3] | 陈玲燕, 王雪丁, 黄民. 环磷酰胺的药物基因组学研究进展[J]. 药学学报 , 2014, 49 :971–976. |
| [4] | DE JONGE M E, HUITEMA A D, RODENHUIS S, BEIJNEN J H. Clinical pharmacokinetics of cyclophosphamide[J]. Clin Pharmacokinet , 2005, 44 :1135–1164. DOI:10.2165/00003088-200544110-00003 |
| [5] | 国家药典委员会.中华人民共和国药典[S].四部.北京:中国医药科技出版社, 2015:363-368. |
| [6] | KASEL D, JETTER A, HARLFINGER S, GEBHARDT W, FUHR U. Quantification of cyclophosphamide and its metabolites in urine using liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom , 2004, 18 :1472–1478. DOI:10.1002/(ISSN)1097-0231 |
| [7] | BAI F, FRAGA C H, TAGEN M, SCHAIQUEVICH P, HAGEDORN N, STEWART C F. Simultaneous determination of cyclophosphamide and carboxyethylphosphoramide mustard in human plasma using online extraction and electrospray tandem mass spectrometry(HTLC-ESI-MS/MS)[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2009, 877 (18-19) :1709–1715. DOI:10.1016/j.jchromb.2009.04.025 |
| [8] | ATTIÉDE CASTRO F, SCATENA GDOS S, CASS Q B, SIMÕES B P, LANCHOTE V L. Analysis of cyclophosphamide and carboxyethylphosphoramide mustard enantiomers in human plasma and application to clinical pharmacokinetics[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2014, 971 :14–19. DOI:10.1016/j.jchromb.2014.09.008 |
| [9] | YANG L, FENG J, ZHANG F, JIANG B, GAO S, CHEN W. Fast quantification of cyclophosphamide and its N-dechloroethylated metabolite 2-dechloroethylcyclophosphamide in human plasma by UHPLC-MS/MS[J]. Biomed Chromatogr , 2014, 28 :1303–1305. DOI:10.1002/bmc.v28.10 |
| [10] | KALHORN T F, HOWALD W N, COLE S, PHILLIPS B, WANG J, SLATTERY J T, et al. Rapid quantitation of cyclophosphamide metabolites in plasma by liquid chromatography-mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2006, 835 :105–113. DOI:10.1016/j.jchromb.2006.03.022 |
| [11] | SADAGOPAN N, COHEN L, ROBERTS B, COLLARD W, OMER C. Liquid chromatography-tandem mass spectrometric quantitation of cyclophosphamide and its hydroxyl metabolite in plasma and tissue for determination of tissue distribution[J]. J Chromatogr B Biomed Sci Appl , 2001, 759 :277–284. DOI:10.1016/S0378-4347(01)00243-2 |
 2016, Vol. 37
2016, Vol. 37


