牙周病是口腔两大类主要疾病之一,在世界范围内均有较高的患病率,我国牙周病的患病率更居于龋病之上;此外,种植体周围炎也是由牙周致病菌引起的炎症性疾病[1]。这两类疾病的共同特点是牙齿或种植体周围的骨破坏缺失,最终导致牙齿或种植体脱落[1-2],实现牙齿或种植体周围的骨再生是目前的研究热点。成纤维细胞表型细胞具有较强的胶原合成能力,成骨细胞表型细胞能发育为成骨细胞或成牙骨质细胞[1, 3],因此人牙周膜成纤维细胞(human periodontal ligament fibroblasts, HPDLFs)是用于口腔组织工程的较好选择。声诺维(SonoVue)是现临床上应用的一种超声造影剂,其同时具有靶向运输药物及DNA的功能,但运用声诺维将骨形态发生蛋白2(BMP2)转染至HPDLFs以期促进其骨向诱导分化的研究较为少见,现将本研究报告如下。
1 材料和方法 1.1 材料与试剂RNA提取、反转录、RT-PCR试剂盒均购自日本TaKaRa公司,质粒提取试剂盒购自北京康为世纪生物科技有限公司,CCK-8试剂盒购自日本Dojindo公司。DMEM/F12培养基、PBS购自美国Hyclone公司,胎牛血清(FBS)、青霉素+链霉素购自美国Gibco公司,Ⅰ型胶原酶购自美国Sigma公司,胰蛋白酶购自上海碧云天生物技术有限公司,声诺维购自意大利Bracco公司,角蛋白单克隆抗体、波形蛋白单克隆抗体购自北京中杉金桥生物技术有限公司。超声基因转染治疗仪由重庆医科大学超声影像学研究所研制。
1.2 HPDLFs的原代培养及鉴定取因正畸需拔牙的11~14岁患者的健康前磨牙(患者及家属已知情同意),用含双抗的DMEM培养液冲洗后快速带回实验室,于超净台中用刀片刮取根中1/3的牙周膜组织,加入Ⅰ型胶原酶在37℃水浴箱中消化30 min。将消化后的组织块均匀平铺在用FBS润洗后的一次性培养瓶底部,翻转培养瓶后加入4 mL完全培养液,拧松瓶盖并置入37℃ CO2孵箱中,24 h后翻转培养瓶[4]。待细胞生长到80%时传代,将第4代细胞用于后续实验研究。取部分细胞制作细胞爬片,4%多聚甲醛固定20 min,分别用角蛋白单克隆抗体和波形蛋白单克隆抗体行免疫组织化学染色。
1.3 质粒的扩增提取按照比例配制固体和液体LB培养基并高压灭菌,加入卡拉霉素。将已转化pEGFP-N1-BMP2的大肠杆菌接种于含固体LB培养基的培养皿上,挑取单克隆菌落放入液体LB培养基中,恒温摇菌14~16 h后,使用质粒提取试剂盒提取质粒并测定浓度。
1.4 实验分组及转染实验参数:声诺维微泡浓度(微泡体积占总体积比例)分别为10%、20%、30%,超声辐照时间为60、90、120 s,超声功率为0.6、0.8、1.0 W/cm2;以不同声诺维微泡浓度、超声强度和辐照时间为参数筛选出细胞转染率较高、细胞状态相对较好的参数组合,并根据该参数组合进行后续实验。转染前取生长较好的第4代HPDLFs以1×105/孔的密度接种于24孔板中,待细胞生长到80%时更换为无血清无双抗的培养液,将细胞随机分为4组:声诺维+质粒+超声组、脂质体+质粒组、超声组和空白对照组。声诺维+质粒+超声组:根据声诺维使用说明书将5 mL生理盐水与声诺维粉剂用力震荡混合,加入质粒后37℃孵育30 min,将质粒(1 μg/孔)与声诺维微泡混合物加入孔板中,在孔板底部涂上一层耦合剂,使超声紧贴孔板底部,按设置参数组合进行辐照;脂质体+质粒组:质粒与脂质体按照比例为1:2.5混合后室温孵育20 min,吸出孔板内原有培养液后加入质粒脂质体混合物;超声组:根据设置参数组合对细胞进行辐照,不做其他处理。各组细胞在转染6 h后均更换为完全培养液,继续培养用于后续实验。
1.5 细胞转染率及活性检测转染48 h后于荧光倒置显微镜下观察细胞绿色荧光表达情况,在100倍视野下抽取10个非重复视野计数细胞,按公式计算细胞转染率:细胞转染率(%)=表达荧光的细胞数/细胞总数×100%。并取部分细胞接种于96孔板中,按1.4项下方法操作,48 h后各组均更换为含10% CCK-8的无血清及双抗培养基,培养3 h后酶标仪检测光密度(D)值,计算细胞存活率:细胞存活率(%)=[(D实验孔-D空白孔)/(D对照孔-D空白孔)]×100%。每组设6个孔,实验重复3次。
1.6 碱性磷酸酶及钙化检测分别于细胞转染3、5、7、9 d时用0.2%Triton裂解细胞收样,在96孔板中按碱性磷酸酶检测说明书操作,每个样本设置3个复孔,37℃孵育30 min后加入反应终止液,用分光光度计检测波长为405 nm时各组的D值。细胞转染21 d后用PBS冲洗细胞,4%多聚甲醛固定20 min,PBS清洗后2%茜素红染色,倒置显微镜下观察各组细胞钙化结节形成情况。
1.7 RT-PCR检测成骨相关基因的表达细胞转染7、10、14 d后收集样本,RT-PCR检测各组细胞成骨相关基因骨钙素(osteocalcin,OCN)、成骨特异性转录因子(runt-related transcription factor-2,Runx2)、骨涎蛋白(bone sialoprotein,BSP)、骨桥素(osteopontin,OPN)、Ⅰ型胶原蛋白(type Ⅰ collagen,Col Ⅰ)的mRNA表达情况,内参为GAPDH。引物序列见表 1。
|
|
表 1 RT-PCR所用引物序列 Tab 1 Primer sequences for RT-PCR |
1.8 统计学处理
采用SPSS 19.0软件进行统计分析。计量资料以x±s表示;组间比较采用单因素或多因素方差分析,两两比较采用q检验。检验水准(α)为0.05。
2 结果 2.1 HPDLFs的生长情况及来源鉴定原代培养的HPDLFs大约在培养5 d后开始爬出,呈梭形生长,生长密集时表现为围绕组织块的放射状排列,生长迅速。1~5代细胞形态及生长速度均无明显变化,取第4代细胞进行后续实验。免疫组织化学染色示角蛋白阴性、波形蛋白阳性,表明该细胞来源于中胚层,见图 1。
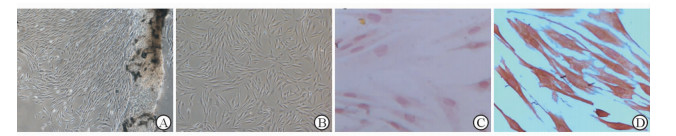
|
图 1 原代HPDLFs的生长情况及来源鉴定 Fig 1 Primary culture and identification of HPDLFs |
2.2 细胞转染率及活性测定
多因素方差分析结果显示,不同的声诺维浓度、超声强度及辐照时间对细胞的转染率均有交互影响作用(P<0.01),其中不同的声诺维浓度对细胞的转染率影响明显,首先确定声诺维浓度为20%时细胞转染率相对较高;以该条件进一步筛选分析,结果发现超声强度为0.8 W/cm2、辐照时间为90 s时细胞转染率与存活率均较佳,故选择此实验参数,见表 2、3。在此参数下检测各组细胞转染率,结果发现声诺维+质粒+超声组细胞转染率为(17.57±1.02)%,脂质体+质粒组为(18.76±0.57)%,两组差异具有统计意义(P<0.05);而超声组和空白对照组细胞几乎无转染现象。表明声诺维+超声和脂质体均能有效转染质粒进入HPDLFs,但脂质体对细胞的转染效率高于声诺维+超声处理。
|
|
表 2 不同声诺维浓度、超声强度及辐照时间条件下细胞的转染率 Tab 2 Transfection efficiency of HPDLFs under different SonoVue concentrations, ultrasound exposure intensities and time |
|
|
表 3 声诺维浓度为20%时不同超声强度及辐照时间条件下细胞的存活率 Tab 3 Survival rate of HPDLFs with 20% SonoVue solution under different ultrasound exposure intensities and time |
2.3 碱性磷酸酶活性及茜素红染色结果
各组细胞碱性磷酸酶活性在3~7 d内均呈上升趋势,7 d时达到最高峰。3~9 d内声诺维+质粒+超声组细胞的碱性磷酸酶活性均高于超声组和空白对照组(P<0.05);5、7 d时超声组与空白对照组相比差异有统计学意义(P<0.05),见图 2。茜素红染色结果示超声组和空白对照组细胞中仅有较零散的少量钙结节形成,明显少于声诺维+质粒+超声组和脂质体+质粒组细胞中钙结节的形成量(图 3)。
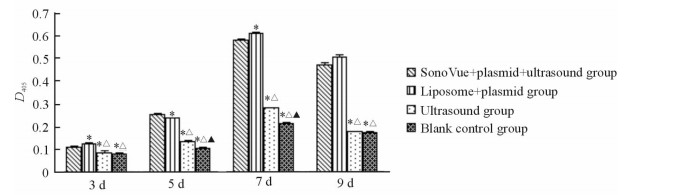
|
图 2 各组细胞碱性磷酸酶活性 Fig 2 Alkaline phosphatase activity in each group |
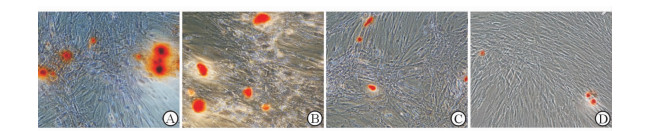
|
图 3 各组细胞茜素红染色结果 Fig 3 Alizarin red staining in each group |
2.4 成骨相关基因的表达变化
RT-PCR结果显示,转染7、10、14 d时声诺维+质粒+超声组细胞中早、中、晚成骨分化重要标志蛋白OPN、BSP、OCN mRNA的表达量均升高,成骨相关的重要因子Col Ⅰ和Runx2 mRNA的表达量也升高,与超声组和空白对照组相比差异均有统计学意义(P<0.05,图 4)。
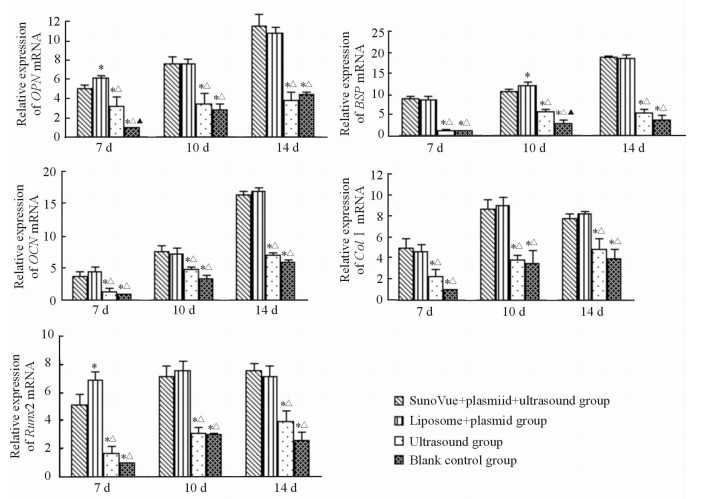
|
图 4 各组细胞成骨相关基因的表达变化 Fig 4 Relative expression of osteogenic genes in each group |
3 讨论
基因治疗需要安全有效的转染载体和转染方式[5]。非病毒载体在体内会很快被单核吞噬细胞系统吞噬;而病毒载体具有免疫原性、致瘤性,在体内会被肝Kuppfer细胞清除,这都将产生严重的肝毒性。此外,由于非病毒载体和病毒载体的作用均不具有靶向性,只有加大剂量才能达到作用目的,这与其肝毒性相矛盾。超声微泡因其安全有效且在转染基因或转运药物时具有时间和空间靶向性而成为目前国内外的研究热点[6-9]。声诺维是目前运用于临床的第二代微泡造影剂,平均直径为7.5 μm,实验研究和临床应用均发现其具有较好的稳定性及生物安全性。Wang等[10]将声诺维与其他两种超声造影剂Optison及Levovist进行对比研究,分别注入小鼠骨骼肌中进行基因转染,结果发现声诺维具有更高的转染率及更好的稳定性。声诺维现主要作为造影剂应用于临床,而其作为基因载体的应用仍处于研究阶段,但其较好的生物性和临床应用基础为其应用于临床基因治疗提供了良好前景。声诺维转染基因的机制主要是在超声作用下其微泡产生空化效应,使细胞表面产生小孔从而使转染基因进入细胞内[11];也有研究人员发现一定强度的超声也能有效促进细胞的内吞作用从而达到转染目的[12]。
声诺维在心肌细胞、骨骼肌细胞、血管内皮细胞等细胞中的研究报道较为常见,而在口腔方面的研究相对较少。本次研究将声诺维作为基因转染载体转染具有成骨诱导活性的BMP2基因进入HPDLFs中,结果显示在一定条件下应用声诺维转染HPDLFs可以得到较理想的转染率而同时对细胞活性无明显影响。BMP2具有较强的成骨诱导活性,在骨形成与重塑方面具有重要作用。重组骨形成蛋白2(rhBMP2)在体内半衰期较短,需要超剂量运用[13],从而可能会带来一定的不良反应。本实验成功将BMP2基因通过声诺维转染至HPDLFs,证实了该转染方式的可行性及有效性,为以后牙周组织工程研究奠定了良好基础。本研究将声诺维转染与目前运用较多的脂质体转染进行对比,结果发现两者的转染率相近,成骨相关基因的表达差异也无统计学意义,表明此种转染方式应用于HPDLFs能够达到较理想的结果。
碱性磷酸酶为细胞早期的成骨向分化标志,本实验检测结果显示,3、5、7 d时各组细胞碱性磷酸酶的表达量逐渐增高,在7 d时达到高峰,在第9天时呈下降趋势,与Ye等[14]研究报告结果基本一致。声诺维+质粒+超声组细胞OPN、Runx2、BSP、ColⅠ、OCN mRNA的表达量与超声组、空白对照组相比均升高,而与脂质体+质粒组相比差异无统计学意义,表明通过声诺维能够将BMP2基因成功转染进入细胞内并发挥理想的诱导作用。
本实验结果显示各时间点声诺维+质粒+超声组HPDLFs的成骨活性均较高,与脂质体+质粒组相比无明显差异,这提示使用超声微泡转染HPDLFs具有较好的效果,同时对远期成骨向诱导无明显干扰。研究表明低强度超声辐照可以刺激新骨形成[15]、促进种植体的骨整合[16]、促进细胞增殖和诱导细胞成骨向分化[17],也有研究表明在低强度脉冲超声作用下HPDLFs表达BMP2的能力增强[18]。但本研究发现超声组与空白对照组细胞的成骨向分化能力基本一致,表明在声诺维+质粒+超声组中发挥成骨向诱导分化作用的主要是转染进入HPDLFs的BMP2基因,可排除超声干扰。这可能是因为在本实验中超声辐照时间较短,而成骨方面的研究大多需超声连续辐照至少1周,短时间超声作用不足以诱导细胞成骨向分化。
综上所述,BMP2基因可以通过声诺维以较可观的转染率转染进入HPDLFs中,并对细胞没有明显毒性。转染后的HPDLFs成骨活性明显增强,这为声诺维在牙周组织工程中的应用提供了依据,且因超声微泡造影剂的靶向性将更有利于其在体内的定向作用。但本次研究未能进行体内实验,声诺维在体内应用时的参数及成骨的量和结构等均需进一步实验研究证实。
| [1] | PARK S Y, KIM K H, GWAK E H, RHEE S H, LEE J C, SHIN S Y, et al. Ex vivo bone morphogenetic protein 2 gene delivery using periodontal ligament stem cells for enhanced re-osseointegration in the regenerative treatment of peri-implantitis[J]. Biomed Mater Res A , 2015, 103 :38–47. DOI:10.1002/jbm.a.v103.1 |
| [2] | HEITZ-MAYFIELD L J, LANG N P. Comparative biology of chronic and aggressive periodontitis vs peri-implantitis[J]. Periodontology 2000 , 2010, 53 :167–181. DOI:10.1111/prd.2010.53.issue-1 |
| [3] | YUDA A, MAEDA H, FUJⅡ S, MONNOUCHI S, YAMAMOTO N, WADA N, et al. Effect of CTGF/CCN2 on osteo/cementoblastic and fibroblastic differentiation of a human periodontal ligament stem/progenitor cell line[J]. J Cell Physiol , 2015, 230 :150–159. DOI:10.1002/jcp.24693 |
| [4] | 李颖, 谷子芽, 吕秋峰, 尤金彪, 刘芳菲. 酶解组织块法原代培养人牙周膜干细胞和牙髓干细胞[J]. 中国组织工程研究 , 2012, 16 :5993–5998. |
| [5] | 李燕, 阳俊, 刘桂英, 张欣. 基因治疗药物输递系统的研究现状及发展趋势[J]. 生物化学与生物物理进展 , 2013, 40 :998–1007. |
| [6] | CHEN Z Y, LIN Y, YANG F, JIANG L, GE S P. Gene therapy for cardiovascular disease mediated by ultrasound and microbubbles[J]. Cardiovasc Ultrasound , 2013, 11 :11. DOI:10.1186/1476-7120-11-11 |
| [7] | LI X H, ZHOU P, WANG L H, TIAN S M, QIAN Y, CHEN L R, et al. The targeted gene (KDRP-CD/TK) therapy of breast cancer mediated by SonoVue and ultrasound irradiation in vitro[J]. Ultrasonics , 2012, 52 :186–191. DOI:10.1016/j.ultras.2011.08.002 |
| [8] | ARVANITIS C D, BAZAN-PEREGRINO M, RIFAI B, SEYMOUR L W, COUSSIOS C C. Cavitation-enhanced extravasation for drug delivery[J]. Ultrasound Med Biol , 2011, 37 :1838–1852. DOI:10.1016/j.ultrasmedbio.2011.08.004 |
| [9] | YE J, HE H, GONG J, DONG W, HUANG Y, WANG J, et al. Ultrasound-mediated targeted microbubbles:a new vehicle for cancer therapy[J]. Frontiers Chem Sci Eng , 2013, 7 :20–28. DOI:10.1007/s11705-013-1311-z |
| [10] | WANG X, LIANG H D, DONG B, LU Q L, BLOMLEY M J. Gene transfer with microbubble ultrasound and plasmid DNA into skeletal muscle of mice:comparison between commercially available microbubble contrast agents[J]. Radiology , 2005, 237 :224–229. DOI:10.1148/radiol.2371040805 |
| [11] | REVATHI S, DHANARAJU M D. Microbubble-arbitrated novel drug delivery system for ultrasound therapy:a review[J]. Innoriginal Int J Sci , 2015, 2 :1–6. |
| [12] | MEIJERING B D, JUFFERMANS L J, VAN WAMEL A, HENNING R H, ZUHORN I S, EMMER M, et al. Ultrasound and microbubble-targeted delivery of macromolecules is regulated by induction of endocytosis and pore formation[J]. Circ Res , 2009, 104 :679–687. DOI:10.1161/CIRCRESAHA.108.183806 |
| [13] | KAIGLER D, CIRELLI J A, GIANNOBILE W V. Growth factor delivery for oral and periodontal tissue engineering[J]. Expert Opin Drug Deliv , 2006, 3 :647–662. DOI:10.1517/17425247.3.5.647 |
| [14] | YE G, LI C, XIANG X, CHEN C, ZHANG R, YANG X. Bone morphogenetic protein-9 induces PDLSCs osteogenic differentiation through the ERK and p38 signal pathways[J]. Int J Med Sci , 2014, 11 :1065–1072. DOI:10.7150/ijms.8473 |
| [15] | 周嘉辉, 吕红斌, 胡建中, 杨颖, 曾驰, 秦岭. 兔胫骨骨延长模型在低强度脉冲超声刺激条件下的骨再生与成熟[J]. 中国组织工程研究与临床康复 , 2010, 14 :1141–1145. |
| [16] | 吴雪林, 何浩, 黄浩原, 陈科屺, 刘柳, 牟雁东. 低强度脉冲超声对去势大鼠种植体早期骨整合的影响[J]. 实用医院临床杂志 , 2014, 11 :25–28. |
| [17] | 于海生, 陈文直, 王嫣, 丁晓燕, 刘政, 罗月萍. 不同参数低强度脉冲超声促进骨髓间充质干细胞增殖的实验研究[J]. 中国超声医学杂志 , 2011, 27 :967–990. |
| [18] | 杨尊, 任蕾西, 宋锦璘, 邓峰, 赵纯亮, 王志彪. 低强度脉冲超声刺激对人类牙周膜细胞BMP-2表达效应的研究[J]. 中国美容医学 , 2011, 20 :767–770. |
 2016, Vol. 37
2016, Vol. 37


