2. 湖南医药学院基础医学院, 怀化 418000;
3. 南华大学医学院心血管疾病研究所, 衡阳 412000;
4. 南华大学实验动物学部, 衡阳 412000;
5. Neurim Pharmaceuticals Ltd., Tel-Aviv 69710, Israel
2. Division of Basic Medical Sciences, Hunan University of Medicine, Huaihua 418000, Hunan, China;
3. Institute of Cardiovascular Disease, University of South China Medical College, Hengyang 412000, Hunan, China;
4. Department of Experimental Animal, University of South China, Hengyang 412000, Hunan, China;
5. Neurim Pharmaceuticals Ltd., Tel-Aviv 69710, Israel
2型糖尿病为影响人类生存质量的主要病因之一,在过去十年里,2型糖尿病在全球范围的发病率显著增加[1]。其主要特征是胰岛素相对不足和存在胰岛素抵抗。2型糖尿病的胰岛素抵抗作用和人体肝脏、骨骼肌及脂肪组织中的胰岛素信号转导通路紊乱关系密切[2]。经典的胰岛素信号转导有胰岛素受体底物1(insulin receptor substrate 1, IRS-1) /磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)和丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)两条途径,但主要是通过胰岛素受体后IRS-1/PI3K途径来调节其代谢。研究表明,胰岛素抵抗产生的最主要原因是由于胰岛素受体后蛋白信号转导通路的改变,导致胰岛素刺激的信号不能向下游按程序传递[3]。
已有研究表明, 褪黑素(melatonin, Mel)可以通过调节胰岛素分泌进而纠正糖尿病引发的代谢紊乱[4]。但Mel被人体吸收后在体内迅速代谢,其半衰期通常为20~30 min,若直接药用则效果甚微,而剂量过高又会产生不良反应;此外,提取与合成Mel也相对较难,因此亟需开发具有持续作用的长半衰期Mel替代品。Neu-P11是由以色列Neurim制药公司开发合成的一种新式Mel非选择性受体激动剂,其具有体外合成易、作用时间持久、不良反应小的特点,并且还能代替Mel与其受体作用,从而发挥一系列的生物学作用[5]。本课题组前期研究表明,Neu-P11可以和Mel受体结合来发挥生物学效应,降低细胞,最终提高胰岛素抵抗脂肪细胞胰岛素受体后信号转导的重要通道蛋白IRS-1、葡萄糖转运体4(glucose transporter 4, GLUT4)、蛋白激酶B (protein kinase B, PKB)的蛋白表达[6-7]。为了更深入研究Neu-P11在胰岛素抵抗模型中对胰岛素受体后系列信号通路的影响,本研究对脂肪细胞胰岛素受体后信号通路的其他重要信号转导通路蛋白p-IRS-1、PI3K、磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase 3β, p-GSK3β)也进行了分析,以深入探讨Neu-P11与胰岛素受体后信号转导通道蛋白之间的关系,为开发Neu-p11作为新的治疗糖尿病的药物提供理论基础。
1 材料和方法 1.1 实验材料与试剂Mel、Neu-P11由以色列Neurim制药公司提供。3T3-L1小鼠成纤维细胞株由中国医学科学院基础医学研究所提供;p-IRS-1、p-GSK3β一抗购自美国Cell Signaling Technology公司;PI3K一抗购自Santa Cruz公司;胎牛血清、DMEM低糖/高糖培养基、胰蛋白酶购自美国Gibco公司;3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松(DEX)、牛胰岛素、luzindole购自Sigma公司。
1.2 3T3-L1细胞的培养与分化将3T3-L1小鼠成纤维细胞置于37℃、5%CO2细胞培养箱中,用含10%胎牛血清的低糖DMEM培养基培养,至细胞生长占培养瓶的80%~90%时进行传代,每隔2 d换液一次,等细胞长满培养瓶2 d后进行诱导分化。“鸡尾酒法”(含10%胎牛血清、1 μmol/L DEX、0.5 mmol/L IBMX、5 mg/L牛胰岛素的低糖DMEM培养基)诱导细胞48 h后,换含10%胎牛血清和5 mg/L牛胰岛素的低糖DMEM培养基培养4 d,中间换液一次;再用含10%胎牛血清的低糖DMEM培养基继续培养,隔天换液一次,诱导分化10~12 d;至显微镜下观察到90%以上的细胞呈现出脂肪细胞表型时,即可用于下一步研究。
1.3 油红O染色[6]诱导成功后,取部分细胞用PBS洗2次,甲醛(浓度3.7%~4.0%)固定15 min;后加PBS洗3次,油红O染液密封染色30 min;倒掉染液,PBS洗至透明,显微镜下观察并记录细胞分化情况,图像分析系统采集并分析图像。
1.4 胰岛素抵抗模型的建立与鉴定诱导成功后,取部分细胞接种于6孔培养板并分为两组:用含1% BSA和1%FBS的低糖DMEM培养基作用脂肪细胞24 h,即为胰岛素敏感组(IS组);用含1%BSA、1 μmol/L胰岛素和1%FBS的高糖DMEM培养基作用脂肪细胞24 h,即为胰岛素抵抗组。胰岛素抵抗模型的鉴定:用50、100、200 nmol/L的胰岛素分别作用于各组脂肪细胞,6 h后收集细胞培养液,葡萄糖氧化酶法测定其葡萄糖浓度,计算糖消耗量,根据脂肪细胞糖消耗量的变化来判定模型是否建立成功。当两组细胞糖消耗量差异具有统计学意义时表明建模成功[6],将建模成功的脂肪细胞用于后续药物分析。
1.5 实验分组与处理将建模成功的胰岛素抵抗组脂肪细胞分为未加药对照组(IR组)、Neu-P11组(10 nmol/L Neu-P11)、Mel组(10 nmol/L Mel)、Mel+luzindole组(10 nmol/L Mel+100 nmol/L luzindole)、Neu-P11+luzindole组(10 nmol/L Mel+100 nmol/L luzindole)5组,培养6 h后,再分别用50、100、200 nmol/L的胰岛素作用各组脂肪细胞6 h,收集各组培养液,葡萄糖氧化酶法测定葡萄糖浓度。
1.6 各组细胞p-IRS-1、PI3K、p-GSK3β蛋白的表达收集各组脂肪细胞,制备蛋白质样品,用蛋白质印迹法检测信号转导通路p-IRS-1、PI3K、p-GSK3β蛋白的表达水平[8],实验重复3次。
1.7 统计学处理采用SPSS 19.0统计软件进行数据处理。数据以x±s表示。各独立样本比较采用t检验,各组蛋白表达差异比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 3T3-L1细胞诱导分化情况油红O染色结果可见,诱导分化8~10 d后细胞胞质内有大量的红色脂滴,表明大部分3T3-L1细胞被诱导分化为成熟的脂肪细胞。
2.2 胰岛素抵抗模型建立情况采用葡萄糖氧化酶法测定两组细胞的糖消耗量,结果发现胰岛素敏感组与胰岛素抵抗组细胞的糖消耗量差异具有统计学意义,表明胰岛素抵抗细胞模型建立成功,可用于后续药物分析。
2.3 各组脂肪细胞p-IRS-1、PI3K、p-GSK3β蛋白的表达水平结果(图 1)表明,Mel组和Neu-P11组脂肪细胞p-IRS-1、PI3K、p-GSK3β蛋白表达高于IR组(P<0.05);而Mel+luzindole组、Neu-P11+luzindole组p-IRS-1、PI3K、p-GSK3β蛋白表达均分别低于Mel组和Neu-P11组(P<0.05),与IR组相比则差异无统计学意义。上述结果说明加入luzindole后,Mel、Neu-P11上调p-IRS-1、PI3K、p-GSK3β蛋白表达的作用受到抑制。
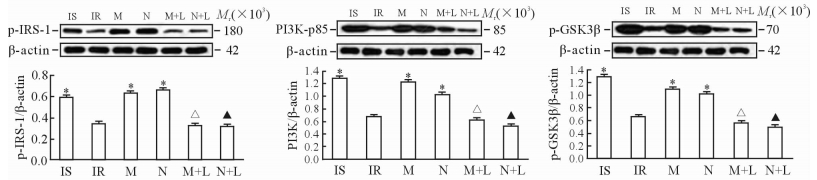
|
图 1 各组3T3-L1脂肪细胞p-IRS-1、PI3K、p-GSK3β蛋白的表达 IS:胰岛素敏感组;IR:未加药对照组;M: 10 nmol/L Mel组;N: 10 nmol/L Neu-P11组;M+L: 10 nmol/L Mel+100 nmol/L luzindole组;N+L: 10 nmol/L Neu-P11+100 nmol/L luzindole组. p-IRS-1:磷酸化胰岛素受体底物1;PI3K:磷脂酰肌醇3-激酶;p-GSK3β:磷酸化糖原合成酶激酶3β;Mel:褪黑素. *P<0.05与IR组比较; △P<0.05与M组比较;▲P<0.05与N组比较. n=3,x±s |
3 讨论
Mel主要是通过IRS-1/PI3K途径刺激骨骼肌细胞的葡萄糖转运,其机制与增强PI3K的活性有关[9]。有研究显示,Mel减少或完全消失可导致胰岛素的敏感性降低并使GLUT-4基因表达下调[10]。在胰岛素刺激下细胞膜上的胰岛素底物与胰岛素迅速结合,底物中酪氨酸(主要是IRS-l和IRS-2)迅速磷酸化,信号下传并通过PI3K刺激下游的蛋白激酶C (protein kinase C,PKC)、PKB活化,从而使GLUT-4转位,导致葡萄糖摄取完成。当GLUT-4出现表达异常致使活性下调、移位发生阻碍时,骨骼肌细胞葡萄糖跨膜转运可能出现障碍,导致细胞摄取、利用葡萄糖的效率降低[11-12]。胰岛素刺激PKB磷酸化,从而使GSK3β上9/21丝氨酸位点磷酸化和失活,阻止GSK3对糖原合成酶活性的抑制,引起糖原合成酶去磷酸化等一系列胞内级联磷酸化反应[11],促进糖原和蛋白合成。
本课题组前期实验研究发现,胰岛素抵抗组脂肪细胞GLUT-4、IRS-1、PKB蛋白的表达水平和胰岛素抵抗密切相关,而Mel、Neu-P11能够上调GLUT-4、IRS-1、PKB的蛋白表达,改善胰岛素抵抗[6-7]。本研究进一步分析发现,Mel组和Neu-P11组脂肪细胞p-IRS-1、PI3K、p-GSK3β的蛋白表达高于IR组(P<0.05),表明Mel、Neu-P11能上调p-IRS-1、PI3K、p-GSK3β蛋白的表达。而加入Mel受体拮抗剂luzindole后,p-IRS-1、PI3K、p-GSK3β的蛋白表达水平下降,说明Mel、Neu -P11上调p-IRS-1、PI3K、p-GSK3β蛋白表达的作用也主要是通过与Mel受体2结合实现的。
综上所述,Mel、Neu-P11能够提高胰岛素抵抗脂肪细胞重要信号转导蛋白p-IRS-1、PI3K和p-GSK3β的表达,且其表达都能被Mel受体拮抗剂luzindole阻断,表明Mel、Neu-P11能够提高胰岛素抵抗脂肪细胞中胰岛素受体后信号重要通路蛋白的表达,改善因信号通路蛋白异常所致的胰岛素抵抗,提高胰岛素的敏感性。Mel、Neu-P11可能是通过与Mel受体2结合来上调胰岛素受体后信号重要通路蛋白的表达。本研究结果将为开发Neu-P11作为新的治疗糖尿病的药物进一步提供理论和实验基础,也为将来开发新的改善胰岛素抵抗的药物提供价值较高的参数。
| [1] | CHAKRABORTY C, DOSS C G, BANDYOPADHYAY S, AGORAMOORTHY G. Influence of miRNA in insulin signaling pathway and insulin resistance:micro-molecules with a major role in type-2 diabetes[J]. Wiley Interdiscip Rev RNA , 2014, 5 :697–712. |
| [2] | TAYLOR R, HOLMAN R R. Normal weight individuals who develop type 2 diabetes:the personal fat threshold[J]. Clin Sci (Lond) , 2015, 128 :405–410. DOI:10.1042/CS20140553 |
| [3] | 何明.胰岛素受体后信号通路与妊娠期糖尿病发病机制的研究[D].武汉:华中科技大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10487-2009173505.htm |
| [4] | ESPINO J, PARIENTE J A, RODRIGUEZ A B. Role of melatonin on diabetes-related metabolic disorders[J]. World J Diabetes , 2011, 2 :82–91. DOI:10.4239/wjd.v2.i6.82 |
| [5] | SHE M, DENG X, GUO Z, LAUDON M, HU Z, LIAO D, et al. NEU-P11, a novel melatonin agonist, inhibits weight gain and improves insulin sensitivity in high-fat/high-sucrose-fed rats[J]. Pharmacol Res , 2009, 59 :248–253. DOI:10.1016/j.phrs.2009.01.005 |
| [6] |
李秀平, 尹卫东, 胡晓波, 佘美华, 王平平, 张素君, 等. 褪黑素受体激动剂Neu-P11对胰岛素抵抗3T3-L1脂肪细胞IRS-1和GLUT-4表达的影响[J]. 第二军医大学学报 , 2013, 34 :561–564.
LI X P, YIN W D, HU X B, SHE M H, WANG P P, ZHANG S J, et al. Effect of melatonin receptor agonist Neu-P11 on expression of IRS-1 and GLUT-4 in insulin-resistant adipocytes[J]. Acad J Sec Mil Med Univ , 2013, 34 :561–564. |
| [7] |
李秀平, 蔡世昌, 尹卫东, 张素军, 胡蓉, 李兴, 等. 褪黑素受体激动剂Neu-P11对3T3-L1小鼠脂肪细胞蛋白激酶B及其磷酸化的影响[J]. 第二军医大学学报 , 2015, 36 :802–804.
LI X P, CAI S C, YIN W D, ZHANG S J, HU R, LI X, et al. Effect of melatonin receptor agonist Neu-P11 on phosphorylation of protein kinase B in mouse 3T3-L1 adipocytes[J]. Acad J Sec Mil Med Univ , 2015, 36 :802–804. DOI:10.3724/SP.J.1008.2015.00802 |
| [8] | 李秀平, 蔡世昌, 尹卫东, 胡晓波, MosheLaudon. Neu-P11/luzindole在胰岛素抵抗脂肪细胞模型中对脂联素/内脏脂肪素的影响[J]. 生物物理学报 , 2013, 29 :422–432. |
| [9] | HA E, YIM S V, CHUNG J H, YOON K S, KANG I, CHO Y H, et al. Melatonin stimulates glucose transport via insulin receptor substrate-1/phosphatidylinositol 3-kinase pathway in C2C12 murine skeletal muscle cells[J]. J Pineal Res , 2006, 41 :67–72. DOI:10.1111/jpi.2006.41.issue-1 |
| [10] | ZANQUETTA M M, SERAPHIM P M, SUMIDA D H, CIPOLLA-NETO J, MACHADO U F. Calorie restriction reduces pinealectomy-induced insulin resistance by improving GLUT4 gene expression and its translocation to the plasma membrane[J]. J Pineal Res , 2003, 35 :141–148. DOI:10.1034/j.1600-079X.2003.00067.x |
| [11] | TSAI Y L, HOU C W, LIAO Y H, CHEN C Y, LIN F C, LEE W C, et al. Exercise training exacerbates tourniquet ischemia-induced decreases in GLUT4 expression and muscle atrophy in rats[J]. Life Sci , 2006, 78 :2953–2959. DOI:10.1016/j.lfs.2005.11.021 |
| [12] | JAMES D E. MUNC-ing around with insulin action[J]. J Clin Invest , 2005, 115 :219–221. DOI:10.1172/JCI200524158 |
 2016, Vol. 37
2016, Vol. 37


