2. 上海交通大学陆伯勋食品安全研究中心, 上海 200240
2. Bor S. Luh Food Safety Research Center, Shanghai Jiaotong University, Shanghai 200240, China
结直肠癌是常见消化道恶性肿瘤之一,其发病率在全世界范围内处于恶性肿瘤第3位,在西方发达国家中处于第2位[1-2]。在我国,随着近年来居民生活水平的提高和饮食习惯的改变,结直肠癌的发病率也呈上升趋势,位居恶性肿瘤和致死因素的第4位[3]。结直肠癌早期诊断率低,术后易复发,具有高侵袭性和高病死率的特点,所以从膳食营养干预的角度寻找能有效抑制结直肠癌细胞增殖的功能性物质具有重要意义。
研究发现氢分子具有良好的选择性抗氧化及抗炎作用[4]。富氢水(hydrogen-rich water,[H]H2O)含有较高浓度的氢气,目前关于富氢水的研究大多围绕其良好的抗氧化及抗炎活性,及其在缺血再灌注损伤、糖尿病等代谢性疾病的应用[5-6],将其应用于肿瘤的预防及治疗方面的研究较少。有研究表明富氢水可显著抑制放疗引起的氧化应激反应,减轻放疗的不良反应,有效改善接受放疗的肝癌患者的生活质量,提示富氢水可辅助用于恶性肿瘤患者的放化疗[7];Li等[8]证明富氢水可减轻化学毒性物质所致的大鼠肾脏损伤,并抑制早期肿瘤的发生。我们前期在动物实验中发现,富氢水对葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的慢性结直肠炎及结直肠癌具有较好的预防作用,能显著抑制肿瘤的发生(未发表数据)。本研究利用皮下接种人结直肠癌细胞系SW480细胞建立荷瘤小鼠动物模型,初步探讨富氢水对肿瘤形成、生长的抑制作用及其分子机制。
1 材料和方法 1.1 材料BALB/c雄性裸鼠购于上海斯莱克实验动物有限公司[动物许可证号:SYXK(沪)2010-0101],4周龄,体质量(20±2) g;结直肠癌细胞系SW480购于中国科学院上海细胞库;DMEM培养基购于上海源培生物科技有限公司;胎牛血清(FBS)购于Gibco公司;鼠抗人Ki-67单克隆抗体工作液及EnVisionTM二抗均购于上海长岛生物技术有限公司;TUNEL试剂盒购于瑞士罗氏公司;活性氧(ROS)检测试剂盒(S0033)、谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)检测试剂盒(S0053)均购于上海碧云天生物技术研究所;焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)购自上海索宝生物科技有限公司;TRIzol®试剂购于Life Technologies公司;无水乙醇、三氯甲烷、异丙醇均为国产优级纯,购自上海晶纯生化科技股份有限公司;引物由Invitrogen公司合成;荧光定量PCR(qRT-PCR)试剂盒PrimeScript® RT Reagent Kit (Perfect Real Time,RR037A)购于宝生物工程(大连)有限公司;富氢水(0.8 mg/kg, 还原电位500 mV)由北京活力氢源饮品有限公司提供。
1.2 实验动物分组及模型建立将16只4周龄的BALB/c雄性裸鼠随机分为对照组(Ctrl, n=8)和富氢水干预组([H]H2O, n=8)。首先,取对数生长期的SW480细胞,于裸鼠右腋皮下接种(4×106/只)。接种后,为保证水中氢气浓度,富氢水干预组每天早、中、晚3次更换新鲜富氢水供小鼠自由饮用;对照组给予普通水。观察肿瘤的生长情况,用直尺测量肿瘤长度(a)、宽度(b),用公式V=ab2π/6计算其体积。荷瘤28 d后处死小鼠,取肿瘤组织,称质量后进行后续实验。
1.3 免疫组化检测Ki-67表达Ki-67是反映肿瘤细胞增殖活性、判断肿瘤侵袭力的重要参考指标[9-10]。取裸鼠肿瘤组织,多聚甲醛固定、脱水、石蜡包埋。蜡块连续切片,切片厚度4 μm,脱蜡、水化,加3%过氧化氢溶液阻断内源性过氧化物酶,PBS冲洗,用EDTA(pH=8)高温高压修复抗原。滴加鼠抗人Ki-67单克隆抗体工作液,37℃水浴箱内孵育1 h,PBS冲洗;加EnVisionTM二抗,37℃水浴箱内孵育30 min,PBS冲洗;加新配制的DAB显色液,显微镜下观察,阳性显色为棕黄色。自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗返蓝。梯度乙醇脱水干燥,中性树脂封片。由专职病理科医师盲法独立阅片。根据细胞核染色定义为淡黄至棕黄色为Ki-67阳性细胞,随机选择10个视野,于400倍镜视野进行计数,每个视野计数500个细胞,计算Ki-67阳性细胞数占总细胞数的百分数。Ki-67阳性细胞数0~20%为Ki-67低表达,大于20%为Ki-67高表达。
1.4 TUNEL染色检测细胞凋亡取裸鼠肿瘤组织,冰冻切片,用4%多聚甲醛常温下固定20 min,PBS漂洗30 min,细胞通透液0.1%Triton X-100冰上通透2 min,PBS漂洗; 加TUNEL反应液(TdT+荧光素标记的dUTP),37℃湿盒中避光孵育1 h,PBS漂洗; 加DAPI,4 min后用PBS漂洗,防荧光淬灭封片剂封片。对照TUNEL反应液中不加TdT,其余反应同前。荧光显微镜下观察,选取5个非重叠400高倍镜视野观察,计算凋亡细胞数。
1.5 氧化应激相关指标的检测冰冻切片加入5 μmol/L DCFH-DA荧光探针溶液,37℃避光孵育90 min,用缓冲液清洗切片,显微镜下观察细胞荧光强度。用“+”或“-”表示荧光强弱:(-)无荧光;(±)极弱的可疑荧光;(+)荧光较弱,但清楚可见;(
取肿瘤组织制备裂解液,按照试剂盒操作说明测定GSH和GSSG含量,计算GSSG/GSH的比值,实验重复3次。
1.6 差异表达基因检测富氢水干预组和对照组各随机取3个移植瘤组织,送欧易生物科技有限公司进行基因表达谱检测。简述如下:抽提肿瘤组织RNA,利用Agilent Bioanalyzer进行毛细管电泳检测RNA质量。利用Affymetrix GeneChip® Human Genome U133 Plus 2.0 Array (包含47 000个转录本,代表 38 500个明确的人类基因)基因表达谱芯片进行检测、分析。
1.7 qRT-PCR方法验证部分基因的表达按照TRIzol试剂盒操作说明抽提肿瘤组织总RNA,按照PrimeScript® RT Reagent Kit (Perfect Real Time)试剂盒操作说明进行反转录操作合成cDNA,按照SYBR® Premix Ex TaqTMⅡ试剂盒说明进行qRT-PCR。目的基因引物序列如表 1所示。PCR反应液体系(20 μL):SYBR® Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×) 10.0 μL,PCR上游引物(10 μmol/L) 0.8 μL, PCR下游引物(10 μmol/L) 0.8 μL, cDNA ( < 100 ng) 2.0 μL, ddH2O 6.4 μL。PCR反应参数:95℃变性30 s;95℃ 5 s、60℃ 20 s,40个循环。熔解曲线分析:95℃ 15 s,65℃ 15 s,95℃ 15 s。基因扩增结果采用相对定量法分析对照组和富氢水干预组中目的基因相对表达量,计算表达水平比率(2-ΔΔCt)。
|
|
表 1 PCR扩增引物序列 Tab 1 PCR amplification primer sequence |
1.8 统计学处理
采用SPSS 19.0软件进行统计学分析。数据结果以x±s表示,采用one-way ANOVA进行组间比较。检验水准(α)为0.05。
2 结果 2.1 富氢水对荷瘤小鼠肿瘤体积和质量的影响与饮用普通水的对照组相比,富氢水干预组小鼠整体成瘤情况受到抑制(图 1A、1B),具体表现为富氢水干预组小鼠的肿瘤体积和质量均低于对照组(图 1C、1D; P < 0.01, P < 0.05);第28天时,富氢水干预组小鼠的肿瘤体积为(587±64) mm3,质量为(0.262±0.028)g,均低于对照组[平均肿瘤体积为(892±108) mm3,质量为(0.438±0.034)g;P < 0.01]。
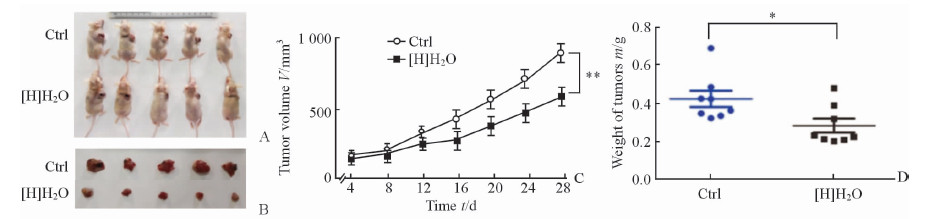
|
图 1 富氢水对裸鼠体内成瘤能力的影响 Fig 1 Inhibitory effects of hydrogen-rich water on the growth of tumor in nude mice |
2.2 富氢水对荷瘤小鼠结直肠癌组织中Ki-67蛋白表达及细胞凋亡的影响
富氢水干预组Ki-67蛋白表达阳性细胞率为(11.0±2.8)%,而对照组为(28.0±3.6)%,两组比较差异有统计学意义(P < 0.05),说明富氢水干预后小鼠结直肠癌细胞的增殖能力减弱。采用TUNEL法检测两组小鼠结肠癌组织的细胞凋亡情况,结果表明,富氢水干预组凋亡细胞率为(14.8±2.2)%,而对照组仅为(2.6±0.4)%,两组比较差异有统计学意义(P < 0.05),表明富氢水可促进结肠癌细胞凋亡,见图 2。
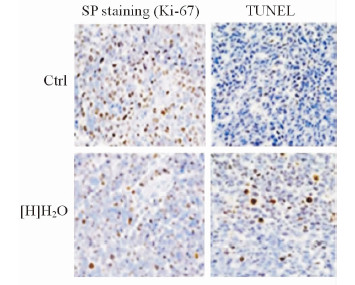
|
图 2 富氢水对荷瘤小鼠结肠癌组织Ki-67蛋白表达及细胞凋亡的影响 Fig 2 Expression of Ki-67 protein and the apoptosis in colon tumor tissues of [H]H2O and Ctrl groups |
2.3 富氢水对荷瘤小鼠结直肠癌组织氧化应激状态的影响
如图 3所示,与对照组相比,富氢水干预后并未显著降低小鼠结肠癌细胞内ROS的含量,而是通过降低GSH和升高GSSG水平(P < 0.05)发挥抗肿瘤作用。与饮用普通水的对照组相比,富氢水干预组GSH水平降低了22%,而GSSG含量升高了38%,从而显著提高了GSSG/GSH的比值(P < 0.05)。

|
图 3 富氢水对荷瘤小鼠结肠癌组织氧化应激状态的影响 Fig 3 Effects of hydrogen-rich water on oxidative stress in tumor bearing mice |
2.4 富氢水对荷瘤小鼠结直肠癌组织部分基因表达的影响
为了进一步探究富氢水抑制结肠癌细胞增殖、促进其凋亡的分子机制,本研究利用基因芯片对比了富氢水干预组与饮用普通水的对照组小鼠肿瘤组织的差异表达基因(图 4A、4B),其差异表达基因的验证结果如图 4C所示。从图中可以看出,与对照组相比,富氢水干预可上调Mmp9、II12rb1、Csf2rb、Tnfaip8l2、Cxcl9(P < 0.05),下调Cdk6、Nrp2及Cldn24等γ-干扰素相关基因(P < 0.05)。
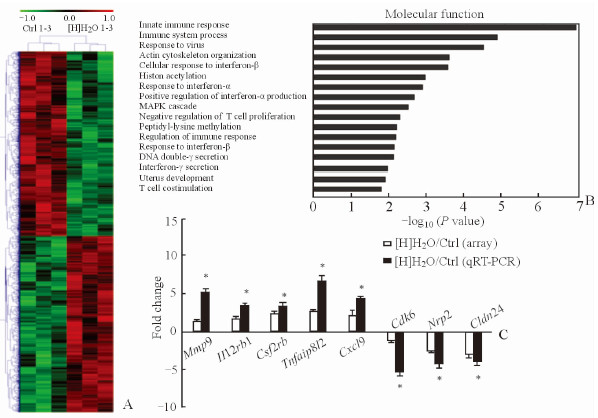
|
图 4 富氢水对荷瘤小鼠结直肠癌组织部分基因表达的影响 Fig 4 Effects of hydrogen-rich water on gene expression profiles in colon tumor tissues of [H]H2O and Ctrl groups |
3 讨论
早在1975年,Dole等[11]将患有鳞状细胞癌的无毛小白鼠放于高压氢气舱内(8 MPa,2.5%氧气,97.5%氢气),发现氢气可使皮肤肿瘤消退。但由于高压氢气用于临床治疗存在安全隐患,此类研究并未引起广泛注意。直至2007年,日本学者采用化学反应、细胞学等手段,证明氢气溶解在液体中可选择性中和羟自由基和亚硝酸阴离子(两者皆为氧化损伤的重要介质)[12]。这一发现引起了研究氢气治疗疾病的热潮,大量研究相继发现氢在脑组织缺血再灌注损伤[13]、炎症[14]、电离辐射损伤[15]、神经系统损伤以及代谢综合征[16-17]等疾病中均发挥一定的作用。
近年来,通过采用增加压强等技术将氢气溶解于水中,制备获得了给予方便且安全的富氢水,推动了氢在临床研究中的应用。研究发现富氢水可减轻组织氧化应激和炎症反应[18-19]。另有少量研究表明,富氢水对肾癌[8]及非酒精性脂肪肝引发的肝癌具有一定的预防作用[20]。本研究利用结肠癌荷瘤小鼠动物模型,研究了富氢水对结肠癌肿瘤细胞增殖、凋亡及氧化应激状态的影响,结果表明富氢水可有效抑制肿瘤细胞的增殖,抑制肿瘤的生长,诱导肿瘤细胞凋亡,并进一步证明了富氢水抗肿瘤生物学活性的发挥与其对肿瘤组织氧化应激状态的调节作用有关。
机体尤其是线粒体产生的ROS在各种细胞信号转导中扮演重要角色。一方面,危险因素如吸烟、环境污染物、辐射、病毒感染等可通过诱导产生大量ROS引发慢性病如恶性肿瘤的发生;另一方面ROS可通过激活NF-κB、AP-1(activator protein-1)等转录因子,调控炎症反应以及肿瘤细胞增殖、侵袭、转移及血管生成等。ROS还可调控抑癌基因如p53、PTEN及Rb基因的表达;然而肿瘤的放、化疗又是通过产生大量ROS发挥杀伤肿瘤细胞的作用,另外一些功能性抗肿瘤活性物质又通过清除ROS减轻氧化应激状态,以发挥预防肿瘤的活性。这提示ROS的功能类似于TNF-α、炎症反应及NF-κB,具有“抑癌”及“促癌”的“双刃剑”效应,提示机体氧化应激状态的调控在肿瘤治疗中可能具有重要的作用[21]。已有研究表明GSH的损耗对细胞氧化应激平衡的调节及细胞死亡通路的激活发挥重要的中枢调控作用[22],本研究发现富氢水干预后,虽然并未降低结肠癌组织细胞内ROS的含量,但可降低GSH水平、升高GSSG水平,提高GSSG/GSH的比值,从而打破细胞内的氧化还原平衡,使肿瘤组织处于ROS应激状态,这可能是富氢水发挥抗肿瘤活性的机制之一。
为了进一步探究富氢水抑制肿瘤细胞增殖、促进其凋亡的分子机制,本研究还利用基因芯片对比研究了富氢水干预组与对照组的差异表达基因,发现富氢水干预后可影响γ-干扰素相关基因的表达。干扰素是一类重要的抗病毒、抗肿瘤和免疫调节细胞因子,广泛用于造血系统恶性肿瘤、淋巴瘤及多种实体瘤的临床治疗。研究表明干扰素与细胞表面受体结合后,主要通过JAK/STAT信号途径,调节如凋亡相关分子Fas/FasL、TRAIL/APO-2、抑癌基因bax、bak及p53等一系列干扰素刺激基因(IFN-stimulated genes, ISGs)的表达,这些ISGs与细胞凋亡及细胞周期密切相关[23]。此外,干扰素还可放大由caspase诱导的线粒体功能紊乱效应,诱导线粒体途径的细胞凋亡。因而,干扰素可通过调节细胞周期、抑癌基因的表达及增强肿瘤细胞对凋亡信号的敏感性,诱导肿瘤细胞凋亡,发挥其抗肿瘤生物学活性。本研究结果表明富氢水干预可上调Mmp9、II12rb1、Csf2rb、Tnfaip812、Cxcl9,下调Cdk6、Nrp2及Cldn24等γ-干扰素相关基因的表达(P < 0.05),其中Mmp9基因参与肿瘤的转移及血管生成[24];Csf2rb基因参与JAK/STAT信号通路、调控细胞凋亡等[25];Cxcl9基因参与Notch信号通路,从而参与调控细胞凋亡及细胞周期[26];Nrp2基因不仅与血管生成相关,还可调控细胞增殖、细胞周期、细胞运动和细胞迁移、细胞分化、细胞凋亡等[27]。上述研究结果提示富氢水可能通过影响多个靶基因发挥肿瘤的抑制作用,对上述基因的具体调控机制和途径尚需要进一步研究。
| [1] | PETO J. Cancer epidemiology in the last century and the next decade[J]. Nature , 2001, 411 :390–395. DOI:10.1038/35077256 |
| [2] | TSUKUMA H, AJIKI W. [Descriptive epidemiology of colorectal cancer-international comparison][J]. Nihon Rinsho , 2003, 61 (Suppl 7) :25–30. |
| [3] | 周晓东, 吕农华. 大肠癌的流行病学研究现状[J]. 现代消化及介入诊疗 , 2006, 11 :149–151. |
| [4] | CHEN X, ZHAI X, SHI J, LIU W W, TAO H, SUN X, et al. Lactulose mediates suppression of dextran sodium sulfate-induced colon inflammation by increasing hydrogen production[J]. Dig Dis Sci , 2013, 58 :1560–1568. DOI:10.1007/s10620-013-2563-7 |
| [5] | ICHIHARA M, SOBUE S, ITO M, ITO M, HIRAYAMA M, OHNO K. Beneficial biological effects and the underlying mechanisms of molecular hydrogen-comprehensive review of 321 original articles[J]. Med Gas Res , 2015, 5 :12. DOI:10.1186/s13618-015-0035-1 |
| [6] | KAJIYAMA S, HASEGAWA G, ASANO M, HOSODA H, FUKUI M, NAKAMURA N, et al. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance[J]. Nutr Res , 2008, 28 :137–143. DOI:10.1016/j.nutres.2008.01.008 |
| [7] | KANG K M, KANG Y N, CHOI I B, GU Y, KAWAMURA T, TOYODA Y, et al. Effects of drinking hydrogen-rich water on the quality of life of patients treated with radiotherapy for liver tumors[J]. Med Gas Res , 2011, 1 :11. DOI:10.1186/2045-9912-1-11 |
| [8] | LI F Y, ZHU S X, WANG Z P, WANG H, ZHAO Y, CHEN G P. Consumption of hydrogen-rich water protects against ferric nitrilotriacetate-induced nephrotoxicity and early tumor promotional events in rats[J]. Food Chem Toxicol , 2013, 61 :248–254. DOI:10.1016/j.fct.2013.10.004 |
| [9] | 郜文秀, 丰建国, 杨艳芳, 梁小波, 李耀平, 李佩珍. 增殖细胞核抗原在大肠癌中的表达及预后[J]. 现代预防医学 , 2007, 34 :225–226. |
| [10] | 林妙霞, 文卓夫, 冯智英, 何丹. Bmi-1、Ki-67在大肠肿瘤组织中的表达及其意义[J]. 癌症 , 2008, 27 :1321–1326. |
| [11] | DOLE M, WILSON F R, FIFE W P. Hyperbaric hydrogen therapy:a possible treatment for cancer[J]. Science , 1975, 190 :152–154. DOI:10.1126/science.1166304 |
| [12] | OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med , 2007, 13 :688–694. DOI:10.1038/nm1577 |
| [13] | ONO H, NISHIJIMA Y, ADACHI N, TACHIBANA S, CHITOKU S, MUKAIHARA S, et al. Improved brain MRI indices in the acute brain stem infarct sites treated with hydroxyl radical scavengers, Edaravone and hydrogen, as compared to Edaravone alone. A non-controlled study[J]. Med Gas Res, 2011, 1:12. |
| [14] | CAI W W, ZHANG M H, YU Y S, CAI J H. Treatment with hydrogen molecule alleviates TNFα-induced cell injury in osteoblast[J]. Mol Cell Biochem , 2013, 373 (1/2) :1–9. |
| [15] | QIAN L, CAO F, CUI J, HUANG Y, ZHOU X, LIU S, et al. Radioprotective effect of hydrogen in cultured cells and mice[J]. Free Radic Res , 2010, 44 :275–282. DOI:10.3109/10715760903468758 |
| [16] | KAMIMURA N, NISHIMAKI K, OHSAWA I, OHTA S. Molecular hydrogen improves obesity and diabetes by inducing hepatic FGF21 and stimulating energy metabolism in db/db mice[J]. Obesity (Silver Spring) , 2011, 19 :1396–1403. DOI:10.1038/oby.2011.6 |
| [17] | IGNACIO R M, KANG T Y, KIM C S, KIM S K, YANG Y C, SOHN J H, et al. Anti-obesity effect of alkaline reduced water in high fat-fed obese mice[J]. Biol Pharm Bull , 2013, 36 :1052–1059. DOI:10.1248/bpb.b12-00781 |
| [18] | CAI J, KANG Z, LIU K, LIU W, LI R, ZHANG J H, et al. Neuroprotective effects of hydrogen saline in neonatal hypoxia-ischemia rat model[J]. Brain Res , 2009, 1256 :129–137. DOI:10.1016/j.brainres.2008.11.048 |
| [19] | CHEN H, SUN Y P, LI Y, LIU W W, XIANG H G, FAN L Y, et al. Hydrogen-rich saline ameliorates the severity of L-arginine-induced acute pancreatitis in rats[J]. Biochem Biophys Res Commun , 2010, 393 :308–313. DOI:10.1016/j.bbrc.2010.02.005 |
| [20] | KAWAI D, TAKAKI A, NAKATSUKA A, WADA J, TAMAKI N, YASUNAKA T, et al. Hydrogen-rich water prevents progression of nonalcoholic steatohepatitis and accompanying hepatocarcinogenesis in mice[J]. Hepatology , 2012, 56 :912–921. DOI:10.1002/hep.25782 |
| [21] | GUPTA S C, HEVIA D, PATCHVA S, PARK B, KOH W, AGGARWAL B B. Upsides and downsides of reactive oxygen species for cancer:the roles of reactive oxygen species in tumorigenesis, prevention, and therapy[J]. Antioxid Redox Signal , 2012, 16 :1295–1322. DOI:10.1089/ars.2011.4414 |
| [22] | FRANCO R, CIDLOWSKI J A. Glutathione efflux and cell death[J]. Antioxid Redox Signal , 2012, 17 :1694–1713. DOI:10.1089/ars.2012.4553 |
| [23] | 靳淑黎, 李保军, 王一平. γ-干扰素对人结肠癌细胞增殖的影响[J]. 临床内科杂志 , 2006, 23 :636–637. |
| [24] | 叶立群, 张谢夫, 赵春临, 刘涛, 顾世敏. 结直肠癌组织STAT3和MMP-9表达及其与血管生成相关性的研究[J]. 中华肿瘤防治杂志 , 2011, 18 :949–952. |
| [25] | ALEXANDER S P, BENSON H E, FACCENDA E, PAWSON A J, SHARMAN J L, SPEDDING M, et al. The Concise Guide to PHARMACOLOGY 2013/14:catalytic receptors[J]. Br J Pharmacol , 2013, 170 :1676–1705. DOI:10.1111/bph.12449 |
| [26] | HARTH-HERTLE M L, SCHOLZ B A, ERHARD F, GLASER L V, DÖLKEN L, ZIMMER R, et al. Inactivation of intergenic enhancers by EBNA3A initiates and maintains polycomb signatures across a chromatin domain encoding CXCL10 and CXCL9[J]. PLoS Pathog , 2013, 9 :e1003638. DOI:10.1371/journal.ppat.1003638 |
| [27] | 毛东, 付晓光, 陆航. Adv-shRNA抑制NRP2表达对胃癌SGC7901细胞增殖的影响[J]. 中国老年学杂志 , 2012, 11 :2309–2311. |
 2016, Vol. 37
2016, Vol. 37


