2. 上海交通大学附属第一人民医院骨科, 上海 200080
2. Department of Orthopaedics, Shanghai General Hospital, Shanghai Jiaotong University, Shanghai 200080, China
肾盂癌多为上尿路上皮癌,其发病率较低,约占泌尿生殖系统恶性肿瘤的5%~7%,但其进展迅速,病死率高,因此对其侵袭性的判断具有重要的临床意义[1]。输尿管镜检查因取材的局限性会导致术前组织学分级准确度不高,分级偏低可导致肿瘤切除不完整;而分级过高则会导致治疗过度,使患者生存率下降。研究表明,弥散加权成像(diffusion-weighted imaging,DWI)能反映生理或病理状态下水分子的运动特性,这种技术较传统的T1WI及T2WI能提供更鲜明的组织对比度,而且可通过测量表观弥散系数(apparent diffusion coefficient,ADC)进行定量分析。文献报道DWI及ADC值与肿瘤的侵袭程度呈负相关[2-3],但其结果仍存在争议。Ki-67蛋白是目前检测肿瘤增殖活性和增殖速率最可靠的指标,有研究表明肿瘤分化程度越低、ADC值越低、T分期越高,Ki-67标记指数(Ki-67 labelling index,Ki-67 LI)也越高[4],目前肾盂癌中ADC值与Ki-67的关系尚未见详尽报道。本研究通过对33例肾盂癌患者的DWI资料与临床、病理及Ki-67免疫组化结果的对比分析,探讨DWI ADC值评估肾盂癌侵袭性的价值。
1 资料和方法 1.1 研究对象回顾性分析2008年1月至2015年6月在同济大学附属同济医院接受磁共振(MR)DWI检查并行手术切除、经病理证实的68例肾盂肿块性病变患者的临床资料,其中肾盂癌33例,良性病变35例。33例肾盂癌患者中男20例、女13例,年龄39~81岁,平均(65±6)岁,肿瘤均为单侧发生。初诊时3例主诉腰痛,28例无痛性肉眼血尿,2例体检时发现,无明显全身或泌尿系症状。其中10例有泌尿系结石史。
1.2 检查方法使用Siemens公司生产的Magnetom Verio 3.0T磁共振成像(MRI)系统,体部相控阵表面线圈。行常规横断位T1WI(TR/TE=140/2.46 ms,层厚7 mm,层距1.4 mm,FOV 400 mm×300 mm,矩阵320×240)和T2WI(TR/TE=3 600/103 ms,层厚6 mm,层距1.2 mm,FOV 400 mm×280 mm,矩阵320×192)扫描。DWI扫描采用自旋回波-平面回波序列,b值为0、800 s/mm2。TR/TE=1 800/69 ms,层厚5 mm,层距1.4 mm,FOV 380 mm×296 mm,矩阵128×102。采用常规抑脂技术(减少化学位移伪影)与全局自动校准部分并行采集技术,并在扫描野上下各加1个预饱和带,以消除心脏搏动及胃肠蠕动的影像,同时完成0、800 s/mm2不同b值的图像重组,生成ADC图。
1.3 MRI分析由2名具有丰富腹部影像诊断经验的高年资影像医师共同进行观察和分析,对诊断结论意见不统一时,经共同讨论取得一致结果。分别测量正常肾实质及病变组织的平均ADC值,根据需要选取圆形或椭圆形感兴趣区(region of interest, ROI)。病变区域选取3组ROI。第1组ROI:小ROI,直径约0.5~0.8 cm,避开囊变坏死区,将ROI置于病灶的实质部分测量,共测量3次;第2组ROI:大ROI,选取病变最大层面中心区域进行测量;第3组ROI:最小ADC(minADC), 多次测量,选取其minADC值作为测量值,取b值=800 s/mm2的ADC均值(图 1)。对于未受累的正常肾实质,选取3组正常肾实质的上极、中极及下极的值,计算其平均值。
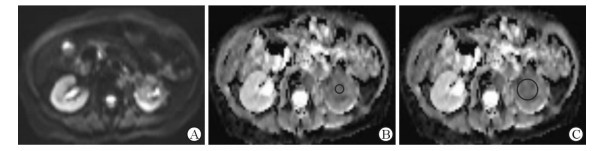
|
图 1 不同大小ROI的选择及测量 Fig 1 Selection and measurement of ROI of different sizes |
1.4 免疫组织化学染色分析Ki-67的表达
术后组织标本用10%多聚甲醛溶液固定24 h,常规石蜡4 μm厚连续切片并行苏木精-伊红(H-E)染色,使用EnVision系列试剂盒(购于DAKO公司)进行检测,严格按照说明书步骤操作。使用DAB显色法显色。随机选择5~10个高倍镜(400倍)视野进行计数,计算Ki-67阳性细胞数占总细胞数的百分比,结果用Ki-67 LI表示。
1.5 肿瘤组织学分级及T分期依据2004年世界卫生组织(WHO)制定的肾脏肿瘤组织学分类分级标准进行组织学分级。依据2002年国际抗癌联盟提出的TNM系统进行分期,参照文献[5]将肿瘤分为2大类:≥T3及≤T2,第1类是局部晚期肿瘤,第2类是局限性的肿瘤。
1.6 统计学处理收集所有患者的MRI DWI诊断资料并与病理结果进行对照,计算DWI诊断肾盂癌的敏感性、特异性、准确率、阳性预测值、阴性预测值。所有数据均应用SPSS 17.0软件进行分析。不同部位ADC值比较采用配对t检验,不同性别、正常肾实质与肾盂癌的ADC值的比较采用独立样本t检验,3组不同ROI、不同病理分级、不同临床分期的ADC值的比较采用单因素方差分析(one-way ANOVA),ADC值与Ki-67的相关性用Spearman相关系数分析。检验水准(α)为0.05。
2 结果 2.1 DWI ADC值对病灶的定性鉴别对68例肾盂肿块性病变患者均行病理学检查,结果见表 1。DWI诊断的敏感性为90.9%、特异性91.4%、准确率91.2%、阳性预测值90.9%、阴性预测值91.4%。
|
|
表 1 DWI诊断结果与病理结果比较 Tab 1 Comparison between DWI and pathological examination |
2.2 手术病理结果及病变基本情况
33例肾盂肿瘤均为单侧发生,病理结果均是上尿路移行上皮癌,无一例发生囊变坏死,其分期分级结果为:原位癌1例,Ta 2例,T1 6例,T2 6例,T3 18例; G1 5例,G2 9例,G3 19例。
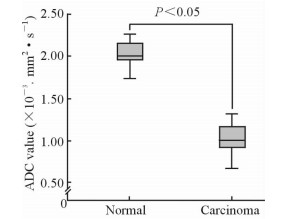
2.3 ADC值对肾盂癌的诊断价值典型肾盂癌病例的DWI及ADC值测量图像资料见图 2。经测量,肾盂癌的ADC值[(1.04±0.13)×10-3mm2/s]低于正常肾实质[(2.00±0.19)×10-3mm2/s]的ADC值(P < 0.05, 图 3)。3种方法测量ROI(10-3 mm2/s)分别为第1组1.08±0.13、第2组1.01±0.23、第3组0.98±0.10,组间差异无统计学意义(P>0.05)。
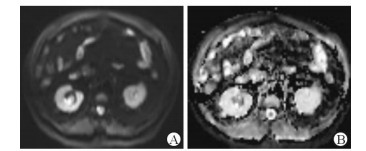
|
图 2 1例65岁男性右肾盂原位癌患者的DWI及ADC值测量图像 Fig 2 DWI and ADC of right renal pelvic carcinoma in situ in a 65-year-old male patient |
|
图 3 肾盂癌和正常肾实质ADC值比较 Fig 3 Comparison of ADC values between normal renal parenchyma and renal pelvic carcinoma |
2.4 ADC值对肾盂癌临床病理分期分级的价值
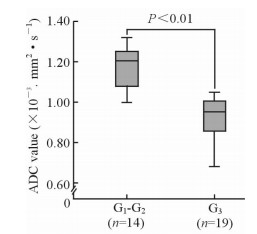
结果(表 2)显示,不同性别、不同部位肾盂癌的ADC值差异无统计学意义(P>0.05);有局部侵犯(T3)肾盂癌的ADC值低于局限于肾盂(Ta~T2)的肾盂癌的ADC值,差异有统计学意义(P<0.05)。组织学高级别(G3)肾盂癌的ADC值低于低级别(G1~G2)肾盂癌的ADC值,差异有统计学意义(P < 0.01,表 2、图 4)。
|
|
表 2 不同性别、部位、分期分级肾盂癌的ADC值比较 Tab 2 Comparison of ADC values of renal pelvic carcinoma of different genders, locations, stages and grades |
|
图 4 不同组织学分级肾盂癌的ADC值比较 Fig 4 Comparison of ADC values between low grade (G1-G2) and high grade (G3) renal pelvic carcinoma |
2.5 肾盂癌组织Ki-67的表达及与ADC值的关系
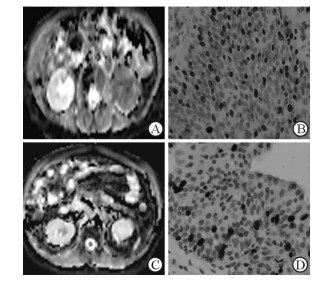
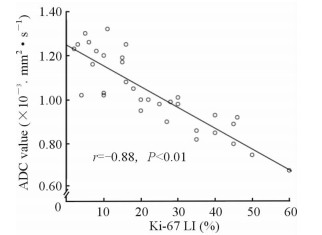
高级别(G3)及低级别(G1~G2)肾盂癌的ADC值测量影像图及Ki-67免疫组化结果见图 5。T3期肾盂癌的Ki-67 LI高于Ta~T2期肾盂癌(P < 0.01),高级别肾盂癌的Ki-67 LI高于低级别肾盂癌(P < 0.01,表 3)。相关分析结果(图 6)显示,ADC值与Ki-67呈负相关(r=-0.88, P < 0.01)。
|
图 5 肾盂癌的ADC值测量图及相应的Ki-67免疫组织化学染色图 Fig 5 ADC maps of renal pelvic carcinoma and the corresponding maps of Ki-67 immunohistochemical staining |
|
|
表 3 不同分期分级肾盂癌Ki-67的表达 Tab 3 Expression of Ki-67 in renal pelvic carcinoma with different stages and grades |
|
图 6 ADC值与Ki-67表达的关系 Fig 6 Relationship between ADC value and Ki-67 expression |
3 讨论
以往学者利用计算机断层尿路造影(computed tomography urography, CTU)及MR增强扫描对上尿路肿瘤的鉴别诊断进行了深入研究[6-8],由于离子型对比剂及钆剂对肾功能有潜在的危害,故寻找一种无创且能替代造影剂的方法具有重要的意义。DWI是通过分析病理状态下细胞外间隙和细胞内外水分子的扩散变化来诊断疾病,Akita等[1]将增强扫描与DWI序列进行比较,认为DWI诊断病变的敏感性更高。因此,本研究的主要目的是评估DWI对肾盂癌病变分期分级的诊断价值。
3.1 DWI对肾盂癌病变的诊断价值 3.1.1 高b值DWI有助于发现病变既往研究表明,高b值DWI具有较高的敏感性及特异性[1, 9-10]。本研究发现当b=800 s/mm2时,肿瘤组织DWI呈相对低信号,与周围高信号的尿液形成鲜明对比,即使是直径为0.6 cm的肿瘤也能清楚显示。
3.1.2 ROI的选择对病变部位ADC值的影响ADC值是一个反映水分子弥散的量化指标,而肾脏肿瘤的ADC值在以往文献报道中表现出明显的差异[11-12]。有研究者认为ADC值不同可能与ROI的选取位置及大小有关;也有人提出测量恶性肿瘤的ADC值应该选择minADC值作为“热点区域”,认为minADC值对应于肿瘤细胞密度最高的部分[13-14]。故我们认为ROI的选择可能会对ADC值产生影响,因此本研究分别采用大小2个ROI及测量minADC值3种方法进行比较,结果提示3组ROI差异无统计学意义,即ROI的选取对ADC值的影响不大。这可能是因为肾盂癌为尿路上皮癌,囊变坏死少见,信号较为均一,本组病例中无一例出现明显的囊变,故3种ROI选择方法对ADC值的测量结果影响不大,提示ROI的选择对肾盂癌影响基本可以忽略。本研究测量的ADC值考虑更全面,保证了测量数据的可靠性。
3.2 ADC值对肾盂癌病变分级分期的诊断价值临床上40%的尿路上皮癌患者在确诊时已发现肌层侵犯,一般存活率不超过5年[15]。因此,移行上皮癌的早期诊断及其侵袭性的评估直接关系到患者的治疗及预后。本研究发现,ADC值不但与肾盂癌的组织学分级有关,还与临床分期有关。组织学高级别及临床分期较早(Ta~T2)的肾盂癌的ADC值较低级别及晚期(T3期)的肾盂癌低(P < 0.01,P < 0.05),这与Kobayashi等[16]和Yamada等[17]关于膀胱癌的研究结果相似。而Sufana Iancu等[3]认为上尿路上皮癌的ADC值与临床分期并没有相关性,可能与其样本量不足(共18例)有关。我们认为高度恶性肿瘤的生物学特性及其结构在水分子弥散受限中起着重要的作用,高级别肿瘤往往细胞密度更高,细胞排列紊乱致细胞外水分子运动减慢,这是其ADC值更低的根本原因。本研究结果初步表明,ADC值可能有助于预测肿瘤的恶性程度及评价预后,对于肿瘤活检取样困难的患者或肿瘤太小无法取样的患者提供了新的评估方法。
Ki-67蛋白检测是目前检测肿瘤增殖活性和增殖速率最可靠的方法,日本有学者报道Ki-67 LI与肾盂及输尿管癌的分期及分级高度相关[18]。还有学者发现Ki-67表达水平越高,越易发生侵袭及淋巴结转移[12, 19]。本研究发现,Ki-67表达量不但与肾盂癌的分期分级有关,且与ADC值呈负相关,进一步证实ADC值可以作为肾盂癌恶性程度的评估及预后指标,结合肿瘤分期分级可提高对预后评估的准确性。研究表明输尿管镜活检有约60%组织学分级低估[20], 而ADC值也许可以作为肿瘤侵犯性的一个新的量化指标,是对常规MR的有益补充。
本研究结果表明DWI ADC值与肿瘤的分期分级有关,可以作为肾盂癌术前危险分层的有力工具,对患者的个体化治疗方案的制定及预后评估有重要价值。由于本研究病例数少,T分期及组织学分级不够详尽,需要扩大样本进一步研究。
| [1] | AKITA H, JINZAKI M, KIKUCHI E, SUGIURA H, AKITA A, MIKAMI S, et al. Preoperative T categorization and prediction of histopathologic grading of urothelial carcinoma in renal pelvis using diffusion-weighted MRI[J]. Am J Roentgenol , 2012, 188 :67–68. |
| [2] | 胡翼江, 贾迪, 徐正道, 王姣, 蔡惠芳, 杨伟, 等. 磁共振扩散加权成像在鉴别良恶性胆囊息肉样病变中的价值[J]. 中华医学杂志 , 2015, 95 :3201–3204. |
| [3] | SUFANA IANCU A, COLIN P, PUECH P, VILLERS A, OUZZANE A, FANTONI J C, et al. Significance of ADC value for detection and characterization of urothelial carcinoma of upper urinary tract using diffusion-weighted MRI[J]. World J Urol , 2013, 31 :13–19. DOI:10.1007/s00345-012-0945-7 |
| [4] | SUN Y, TONG T, CAI S, BI R, XIN C, GU Y. Apparent diffusion coefficient (ADC) value:a potential imaging biomarker that reflects the biological features of rectal cancer[J]. PLoS One , 2013, 9 :e109371. |
| [5] | YOSHIDA S, KOBAYASHI S, KOGA F, ISHIOKA J, ISHⅡ C, TANAKA H, et al. Apparent diffusion coefficient as a prognostic biomarker of upper urinary tract cancer:a preliminary report[J]. Eur Radiol , 2013, 23 :2206–2214. DOI:10.1007/s00330-013-2805-2 |
| [6] | XU A D, NG C S, KAMAT A, GROSSMAN H B, DINNEY C, SANDLER C M. Significance of upper urinary tract urothelial thickening and filling defect seen on MDCT urography in patients with a history of urothelial neoplasms[J]. Am J Roentgenol , 2010, 195 :959–965. DOI:10.2214/AJR.09.4177 |
| [7] | RAMAN S P, HORTON K M, FISHMAN E K. MDCT evaluation of ureteral tumors:advantages of 3D reconstruction and volume visualization[J]. Am J Roentgenol , 2013, 201 :1239–1247. DOI:10.2214/AJR.13.10880 |
| [8] | GANDRUP K L, NORDLING J, BALSLEV I, THOMSEN H S. Upper urinary tract tumors:how does the contrast enhancement measured in a split-bolus CTU correlate to histological staging[J]. Acta Radiol , 2013, 55 :761–768. |
| [9] | 梁宇霆, 靳二虎, 张艺, 邓立刚, 付静媛. 磁共振扩散加权成像在前列腺癌检出和鉴别诊断中的价值[J]. 磁共振成像 , 2010, 1 :272–276. |
| [10] |
吕琦, 王培军, 邵志红, 倪炯, 王国良. CT增强扫描及磁共振DWI序列对肿块型胰腺炎与胰腺癌的鉴别诊断价值[J]. 第二军医大学学报 , 2013, 34 :974–979.
LÜ Q, WANG P J, SHAO Z H, NI J, WANG G L. CT enhancement scanning and diffusion-weighted magnetic resonance imaging for differential diagnosis between chronic mass-forming pancreatitis and pancreatic carcinoma[J]. Acad J Sec Mil Med Univ , 2013, 34 :974–979. |
| [11] | ZHANG Y D, WU C J, WANG Q, ZHANG J, WANG X N, LIU X S, et al. Comparison of utility of histogram apparent diffusion coefficient and R2* for differentiation of low-grade from high-grade clear cell renal cell carcinoma[J]. Am J Roentgenol , 2015, 205 :193–201. DOI:10.2214/AJR.14.13802 |
| [12] | KANG S K, ZHANG A, PANDHARIPANDE P V, CHANDARANA H, BRAITHWAITE R S, LITTENBERG B, et al. DWI for renal mass characterization:systematic review and meta-analysis of diagnostic test performance[J]. Am J Roentgenol , 2015, 205 :317–324. DOI:10.2214/AJR.14.13930 |
| [13] | YU X, LIN M, OUYANG H A, ZHOU C, ZHANG H. Application of ADC measurement in characterization of renal cell carcinomas with different pathological types and grades by 3.0 T diffusion-weighted MRI[J]. Eur J Radiol , 2012, 81 :3061–3066. DOI:10.1016/j.ejrad.2012.04.028 |
| [14] | MURAKAMI R, HIRAI T, KITAJIMA M, FUKUOKA H, TOYA R, NAKAMURA H, et al. Magnetic resonance imaging of pilocytic astrocytomas:usefulness of the minimum apparent diffusion coefficient(ADC) value for differentiation from high grade gliomas[J]. Acta Radiol , 2008, 49 :462–467. DOI:10.1080/02841850801918555 |
| [15] | KOJIMA K, NARUO S, KANAYAMA H, KAGAWA S. [Evaluation of Ki-67 antigen using MIB1 antibody as a prognostic factor in renal pelvic and ureteral cancer][J]. Nihon Hinyokika Gakkai Zasshi , 1996, 87 :822–830. |
| [16] | KOBAYASHI S, KOGA F, YOSHIDA S, MASUDA H, ISHⅡ C, TANAKA H, et al. Diagnostic performance of diffusion-weighted magnetic resonance imaging in bladder cancer:potential utility of apparent diffusion coefficient values as a biomarker to predict clinical aggressiveness[J]. Eur Radiol , 2011, 21 :2178–2186. DOI:10.1007/s00330-011-2174-7 |
| [17] | YAMADA Y, KOBAYASHI S, ISOSHIMA S, ARIMA K, SAKUMA H, SUGIMURA Y. The usefulness of diffusion-weighted magnetic resonance imaging in bladder cancer staging and functional analysis[J]. J Cancer Res Ther , 2014, 10 :878–882. DOI:10.4103/0973-1482.138225 |
| [18] | 陈俊星, 邓楠, 陈凌武, 李晓飞, 丘少鹏, 吴荣佩, 等. 欧洲癌症研究与治疗组织风险评分表在非肌层浸润性膀胱尿路上皮癌中的临床应用初探[J]. 中华泌尿外科杂志 , 2011, 32 :228–231. |
| [19] | YOSHIDA S, MASUDA H, ISHⅡ C, TANAKA H, FUJⅡ Y, KAWAKAMI S. Usefulness of diffusion-weighted MRI in diagnosis of upper urinary tract cancer[J]. Am J Roentgenol , 2011, 196 :110–116. DOI:10.2214/AJR.10.4632 |
| [20] | TAOULI B, THAKUR R K, MANNELLI L, BABB J S, KIM S, HECHT E M, et al. Renal lesions:characterization with diffusion-weighted imaging versus contrast-enhanced MR imaging[J]. Radiology , 2009, 251 :398–407. DOI:10.1148/radiol.2512080880 |
 2016, Vol. 37
2016, Vol. 37


