2. 第二军医大学药学院无机化学教研室, 上海 200433
2. Department of Inorganic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
5-氟尿嘧啶(5-fluorouracil,5-FU)是胸苷酸合成酶抑制剂。5-FU在细胞内经酶转化为5-氟尿嘧啶脱氧核苷酸而抑制脱氧胸苷酸合成酶的活性,阻止脱氧尿苷酸甲基化而转变成脱氧胸苷酸,从而抑制DNA的合成。此外,5-FU在体内还可以干扰RNA和蛋白质的合成,抑制成纤维细胞增殖与胶原蛋白的合成,具有抗肿瘤活性和治疗增生性瘢痕的作用[1-3]。临床上用于增生性瘢痕治疗的5-FU制剂包括口服片剂、局部注射剂和膏剂等。但口服片剂由于局部组织吸收不完全,疗效有待提高;局部注射剂因注射疼痛,患者的顺应性较差;膏剂因接触损耗等因素导致药物损失而影响其疗效。所以合理选择5-FU的药物剂型和提高其生物利用度是改善增生性瘢痕治疗效果的关键。
透皮给药系统是药物直接作用于皮肤表面并以一定的速率经皮肤角质层到达真皮层、毛细血管丛和体循环的新型药物制剂[4-5]。透皮给药系统中促进模型药物经皮渗透的方法涉及化学促渗方法、物理促渗方法和药剂学方法。化学促渗方法常用的促渗剂包括氮酮及其同系物、脂肪酸及脂类、离子型表面活性剂及醇类等[6]。氮酮和油酸乙酯是常用的化学促渗剂[7]。本课题组在前期开展的驻极体联合化学促渗剂促进水杨酸、利多卡因、美洛昔康、环孢菌素和胰岛素等药物经皮给药研究的基础上[8-14],拟对驻极体联合化学促渗剂促进5-FU经瘢痕皮肤给药及其驻极体5-FU缓控释给药制剂开展研究。本研究以5-FU为模型药物,化学促渗方式选用1%氮酮和10%油酸乙酯作为促渗剂,物理促渗方式选用-1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体作为促渗条件,离体SD大鼠瘢痕皮肤和背部皮肤为研究对象,利用Franz扩散池和高效液相色谱仪,通过检测经过大鼠皮肤5-FU的累积透皮量,比较研究1%氮酮和10%油酸乙酯以及不同表面电位负极性驻极体对5-FU的体外促渗作用,阐明氮酮和油酸乙酯以及驻极体联合应用促进5-FU经皮转运的可行性,并优选促渗剂为制备驻极体5-FU缓控释透皮给药制剂奠定实验基础,为提高增生性瘢痕的治疗效果提供新技术和新方法。
1 材料和方法 1.1 实验动物、仪器和试剂清洁级SD雄性大鼠,体质量(200±20) g,购自第二军医大学实验动物中心,动物许可证号:SCXK(沪)2013-0016。高效液相色谱仪(岛津LC-2010A),药物透皮扩散试验仪(RYJ-B型,上海黄海药检仪器有限公司),电子天平(FA2004B型,上海精科天美科学仪器有限公司),栅控电晕充电系统(上海复旦中学校办厂),ESR102A型震动电容静电计(北京华晶汇科技有限公司),数控超声波清洗器(KQ5200DE型,昆山市超声仪器有限公司),FSH-2型可调高速匀浆机(江苏省金坛市荣华仪器有限公司),BX53型荧光显微镜(深视光谷)。氮酮(北京贝里斯生物化学有限公司),油酸乙酯(上海飞祥化工厂),5-FU、水合氯醛、磷酸二氢钾、氢氧化钠等均购于中国医药集团上海化学试剂公司。
1.2 瘢痕模型及皮肤制备SD大鼠瘢痕模型制备:用体积分数为10%的水合氯醛按照3 mL/kg的剂量麻醉大鼠,俯卧位固定于鼠板,背部备皮,无菌条件下手术剪切除SD大鼠背部全皮(创面面积约为1 cm2),切口不缝合,裸露,自然愈合28 d。获取皮肤:将SD大鼠及瘢痕模型大鼠用10%水合氯醛(3 mL/kg)腹腔麻醉后,俯卧位固定于操作台上,背部(瘢痕组织周围)备皮。12 h后过量麻醉处死大鼠,立即取下背部(瘢痕)皮肤,用脱脂棉去除皮下脂肪组织及黏膜,生理盐水反复清洗干净后,-20℃冰箱保存备用。
1.3 驻极体材料及制备以PP(polypropylene)膜为驻极体材料。将双裸面PP膜裁剪成6 cm×6 cm大小置于薄铝板电极上,将放有PP膜的铝板电极常温下放置于栅控电晕充电系统中进行电晕充电。针压参数设置为+15 kV或-15 kV,栅压分别设置为-1 000 V、-1 500 V和-2 000 V,注极时间设定为10 min。注极完成后分别得到-1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体。驻极体的等效表面电位通过补偿法进行测量。
1.4 实验分组将5-FU饱和溶液渗透大鼠瘢痕皮肤设为对照一组。将分别含1%氮酮、10%油酸乙酯、-1 000 V驻极体、-1 500 V驻极体、-2 000 V驻极体的5-FU溶液渗透大鼠瘢痕皮肤分别设为1%氮酮实验一组、10%油酸乙酯实验一组、-1 000 V驻极体实验一组、-1 500 V驻极体实验一组、-2 000 V驻极体实验一组。
同理,将5-FU饱和溶液渗透大鼠背部皮肤设为对照二组,将分别含1%氮酮、10%油酸乙酯、-1 000 V驻极体、-1 500 V驻极体、-2 000 V驻极体的5-FU溶液渗透大鼠背部皮肤分别设为1%氮酮实验二组、10%油酸乙酯实验二组、-1 000 V驻极体实验二组、-1 500 V驻极体实验二组、-2 000 V驻极体实验二组。
1.5 体外透皮实验实验一组中将离体大鼠瘢痕皮肤裁剪成合适大小(约2.8 cm2)并固定在改良Franz扩散池的供给池和接受池之间,真皮层面向接受池。接受池中加入磷酸盐缓冲液(PBS,pH=7.2~7.4), 根据实验分组分别在供给池中加入3 mL 10 mg/mL 5-FU溶液(对照一组)、3 mL 10 mg/mL 5-FU溶液和体积分数为1%的氮酮(1%氮酮实验一组)、3 mL 10 mg/mL 5-FU溶液和体积分数为10%的油酸乙酯(10%油酸乙酯实验一组)、3 mL 10 mg/mL 5-FU溶液并在供给池上方平铺-1 000 V驻极体薄膜(-1 000 V驻极体实验一组)、3 mL 10 mg/mL 5-FU溶液并在供给池上方平铺-1 500 V驻极体薄膜(-1 500 V驻极体实验一组)、3 mL 10 mg/mL 5-FU溶液并在供给池上方平铺-2 000 V驻极体薄膜(-2 000 V驻极体实验一组)。水浴温度设定为37℃,磁力搅拌速度设定为1 531×g,分别于2、4、8、12、24和36 h时取样1 mL,并补充等量的PBS。每次取出的样品经0.22 μm微孔滤膜过滤后,加入到样品分析小瓶中,用高效液相色谱仪测量透过离体大鼠皮肤的5-FU的峰面积,根据制定好的标准曲线y=29 707x+200 000(r2=0.999 2)换算出样品浓度,并转换成累积透皮量(Q),以时间(t)为横坐标,Q为纵坐标作图加以分析。色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm,Dikma公司),流动相为0.15%乙酸和0.15%乙醇胺的混合液与甲醇按照体积比19:1混合,流速1 mL/min,柱温30℃,进样量10 μL,检测波长265 nm。实验二组中将离体大鼠瘢痕皮肤换成同等大小的背部皮肤,其他实验步骤同实验一组。
1.6 统计学处理体外经皮扩散实验所测得的数据用Excel 2007进行方差分析。检验水准(α)为0.05。
2 结果 2.1 SD大鼠瘢痕模型制备情况术后第28天,瘢痕模型大鼠创面面积较术后第1天创面面积明显缩小,色泽变淡,呈暗红色。创面组织处触摸后感觉硬韧,可以比较明显的区别于周围正常皮肤组织,轻轻推动愈合处组织,明显感觉到创面愈合组织处是一小块疙瘩,会一同移动。
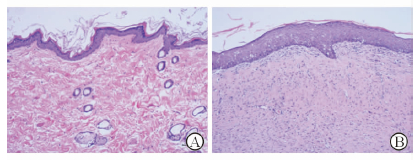
将术后第28天瘢痕模型大鼠的瘢痕皮肤取出,用PBS缓冲液、10%甲醇、蔗糖溶液处理后,石蜡包埋,-20℃冷冻,做成切片。荧光显微镜下可见表皮再生完成,并且表皮厚度较大鼠正常皮肤明显增加,没有明显的皮肤附属腺体;内部组织纤维排列紧密,组织细胞内没有清晰的囊泡,并且肥大细胞在全层中分布,以各层血管周围和胶原纤维束之间数量相对较多,瘢痕表皮下和真皮网状层也有大量肥大细胞分布(图 1)。术后28 d的皮肤组织形态符合瘢痕皮肤的特征,瘢痕组织模型建立成功。
|
图 1 正常大鼠背部皮肤(A)与瘢痕模型大鼠术后第28天时瘢痕皮肤(B)组织切片(H-E染色) Original magnification: ×100 |
2.2 化学促渗剂对5-FU经皮渗透的影响
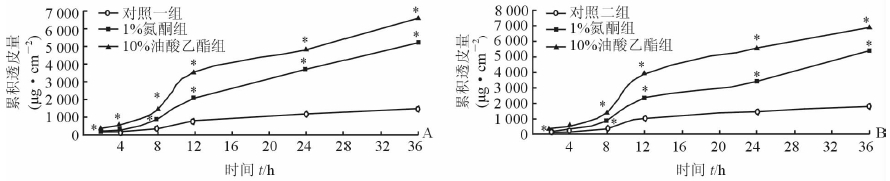
含1%氮酮和10%油酸乙酯的5-FU溶液分别连续作用离体瘢痕(背部)皮肤36 h,透过大鼠瘢痕皮肤5-FU的累积透皮量随时间的关系曲线见图 2。结果可见:(1) 5-FU溶液作用大鼠瘢痕皮肤0~8 h,透过大鼠瘢痕皮肤5-FU的累积透皮量随时间缓慢上升(近似线性),8~36 h透过大鼠瘢痕皮肤5-FU的累积透皮量随时间接近指数规律上升。(2) 1%氮酮和10%油酸乙酯分别作用大鼠瘢痕皮肤0~36 h,透过大鼠瘢痕皮肤5-FU的累积透皮量随时间的变化规律与对照一组相似。(3) 不同化学促渗剂作用大鼠瘢痕皮肤,透过大鼠瘢痕皮肤5-FU的累积透皮量较对照一组明显增加,1%氮酮和10%油酸乙酯作用大鼠瘢痕皮肤36 h时透过大鼠瘢痕皮肤5-FU的累积透皮量分别是(5 235.98±8.43) μg/cm2和(6 592.76±11.69/) μg/cm2,分别是对照一组5-FU累积透皮量[(1 459.75±2.41) μg/cm2]的3.59倍和4.52倍。其中10%油酸乙酯对5-FU的促渗效果最佳。(4) 5-FU溶液和含不同化学促渗剂5-FU溶液分别连续作用背部皮肤0~36 h,通过背部皮肤5-FU的累积透皮量随时间的变化规律与透过大鼠瘢痕皮肤的相似。(5) 1%氮酮和10%油酸乙酯分别作用背部皮肤相同时间,透过背部皮肤5-FU的累积透皮量略大于瘢痕皮肤:即1%氮酮和10%油酸乙酯分别作用背部皮肤36 h,透过背部皮肤5-FU的累积透皮量分别为(5 467.88±24.13) μg/cm2和(6 941.72±86.79) μg/cm2,分别是透过瘢痕皮肤5-FU的1.04倍和1.05倍。(6) 10%油酸乙酯作用背部皮肤36 h,5-FU的体外累积透皮量是对照二组的3.82倍,促渗效果与作用瘢痕皮肤相当。
|
图 2 化学促渗剂作用下5-FU溶液经大鼠瘢痕皮肤(A)和背部皮肤(B)的药物累积透皮量与时间的关系曲线 5-FU: 5-氟尿嘧啶. *P < 0.05与对照组比较 |
2.3 不同表面电位负极性驻极体对5-FU经皮渗透的影响
图 3示不同表面电位负极性驻极体作用5-FU溶液36 h,透过大鼠瘢痕(背部)皮肤5-FU的累积透皮量随时间的关系曲线。可见:(1) -1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体5-FU溶液作用大鼠瘢痕皮肤0~36 h,透过瘢痕皮肤5-FU的累积透皮量随时间的变化规律与对照一组相似。(2) 不同表面电位负极性驻极体作用于瘢痕皮肤一定时间均能增加5-FU的经皮渗透量,且驻极体的等效表面电位越高,渗效果越好。如-1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体5-FU溶液分别作用瘢痕皮肤36 h,透过瘢痕皮肤5-FU的累积透皮量分别是对照一组的1.61倍、2.61倍和3.12倍。(3) 化学促渗剂对5-FU经大鼠瘢痕皮肤的促渗效果略优于不同表面电位负极性驻极体。(4) 不同表面电位负极性驻极体5-FU溶液作用大鼠背部皮肤36 h,通过大鼠背部皮肤5-FU的累积透皮量随时间的变化规律与对照二组相似。-1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体分别5-FU溶液作用大鼠背部皮肤36 h,5-FU的累积透皮量分别是对照二组的1.44倍、2.51倍和3.02倍,不同表面电位负极性驻极体对5-FU具有良好的促渗效果。(5) 不同表面电位负极性驻极体作用5-FU溶液36 h,通过大鼠背部皮肤5-FU的累积透皮量随时间的变化规律与透过大鼠瘢痕皮肤的相似。(6) -1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体5-FU溶液作用大鼠背部皮肤任一时间,透过背部皮肤5-FU的累积透皮量均大于瘢痕皮肤,如-1 000 V驻极体、-1 500 V驻极体和-2 000 V驻极体5-FU溶液分别作用大鼠背部皮肤36 h,透过背部皮肤5-FU的累积透皮量分别为(2 614.15±12.78) μg/cm2、(4 551.56±62.23)μg/cm2和(5 488.15±126.59) μg/cm2,是透过瘢痕皮肤5-FU累积透皮量的1.11倍、1.20倍和1.20倍。

|
图 3 驻极体作用下的5-FU溶液经大鼠瘢痕皮肤(A)和背部皮肤(B)的药物累积透皮量与时间的关系曲线 5-FU: 5-氟尿嘧啶. *P < 0.05与对照组比较 |
3 讨论
本实验通过体外Franz扩散池透皮实验和高效液相色谱技术对不同种类化学促渗剂和不同表面电位负极性驻极体对5-FU溶液体外透皮吸收的影响进行了比较研究。结果显示,1%氮酮和10%油酸乙酯作用5-FU溶液36 h,通过大鼠瘢痕皮肤5-FU的累积透皮量分别较对照一组提高3.59倍和4.52倍。这说明1%氮酮和10%油酸乙酯对5-FU具有良好的促渗作用,且10%油酸乙酯对5-FU的促渗效果优于1%氮酮。油酸乙酯促进5-FU经大鼠瘢痕皮肤和背部皮肤吸收的主要机制是:油酸乙酯属脂肪酸类化合物,与皮肤中的脂肪酸有类似的结构。当油酸乙酯分子插入角质层类脂的双分子层疏水结构时,由于其不饱和疏水链的顺式结构,使双分子层扭转,形成微细的容易渗透的流动性通道,有效的影响了角质层脂质结构的有序排列,减少了药物的扩散阻力。此外,油酸分子的不对称空间结构可以较长时间维持角质层结构的变化,这些都大大促进了药物的扩散吸收[15]。而氮酮促进5-FU经瘢痕皮肤和背部皮肤吸收的主要原因是:氮酮作用于表皮角质层细胞间脂质,使角质层细胞疏松,细胞间距增大,从而引起角质层外层细胞脱落,皮肤角质层变薄,大大降低了皮肤对药物的屏障作用,从而促进药物的经皮渗透。氮酮还与细胞内基质作用,引起基底角质层肿胀,增加了角质细胞的水化程度和药物的储存空间。10%油酸乙酯对皮肤角质层空间结构的改变效果优于1%氮酮将角质层软化脱落的效果,从而导致10%油酸乙酯对5-FU的促渗效果优于1%氮酮。
本实验的研究结果进一步指出,同类化学促渗剂作用大鼠瘢痕皮肤和背部皮肤相同时间,5-FU经背部皮肤的体外渗透规律与经瘢痕皮肤的规律相似,且通过背部皮肤5-FU的累积透皮量多于通过瘢痕皮肤的累积透皮量。这是因为大鼠瘢痕皮肤[实验测量值为(1.55±0.06) cm]厚于背部皮肤[实验测量值为(1.38±0.03) cm], 大鼠瘢痕皮肤的厚度约为背部皮肤的1.12倍。较厚的大鼠瘢痕皮肤不仅增加了皮肤角质层的厚度,使药物的扩散阻力随之增加;而且延长了药物经皮渗透的路径,使透过大鼠瘢痕皮肤的药物累积透皮量相应减少;并且瘢痕皮肤组织内比背部皮肤有更多的胶原纤维,细胞排列更加紧密,药物渗透阻力更大,这也使得药物难以透过皮肤。此外,氮酮还可作用于大鼠背部皮肤的毛囊,使毛囊口附近的角质疏松,随着作用时间的延长,疏松的角质脱落,导致毛囊孔径拓宽,使药物经毛囊孔径渗透[16]。
促进药物经皮吸收的方法除了化学促渗法以外,还有物理促渗技术。物理促渗技术包括离子导入、电致孔、驻极体、超声波和微针等,驻极体作为促渗源促进药物的经皮吸收已应用于水杨酸、利多卡因、美洛昔康、环孢菌素和胰岛素等药物的透皮给药研究。本实验以不同表面电位负极性驻极体为物理促渗源,对5-FU体外经大鼠瘢痕皮肤和背部皮肤的促渗效果进行比较研究。结果显示,不同表面电位负极性驻极体作用于5-FU溶液均能增加5-FU透过大鼠瘢痕皮肤和背部皮肤的经皮渗透量,且驻极体的等效表面电位越高其促渗效果越好。此外,相同表面电位负极性驻极体作用5-FU溶液某一时间,透过瘢痕皮肤5-FU的累积渗透量略小于背部皮肤。这是因为:(1) 驻极体产生的外静电场作用于大鼠瘢痕皮肤和背部皮肤,可改变角质层类脂双层的排列和显微结构,使之产生更多的新生孔道,降低皮肤角质层的物理阻抗,使得更多的5-FU经角质层进入深层皮肤,增加药物的经皮渗透量。(2) 5-FU在碱性环境下呈现负电性,带负电的5-FU分子在负极性驻极体产生的外静电场作用下,受静电排斥力作用经大鼠背部皮肤(或瘢痕皮肤)角质层加速向深层组织迁移,从而提高了5-FU在皮肤内的迁移速率和经皮肤的渗透量。驻极体的等效表面电位越高,其产生的外静电场强度越大,对5-FU的静电排斥力越大,导致5-FU的经皮渗透速率越大,经皮渗透的累积药物量也越多。(3) 瘢痕皮肤较厚的角质层和致密皮肤组织减弱了驻极体外静电场对角质层物理屏障的降低作用和对5-FU的静电作用力,使体外经瘢痕皮肤5-FU的累积透皮量略少于背部皮肤。
比较化学促渗剂和不同表面电位负极性驻极体对5-FU的体外经皮实验的结果发现,1%氮酮、10%油酸乙酯和-2 000 V驻极体作用36 h,5-FU经瘢痕皮肤的累积透皮量分别是相应对照组的3.59倍、4.52倍和3.12倍,化学促渗剂和负极性驻极体对5-FU均有良好的经皮促渗作用,合理利用化学促渗剂和负极性驻极体可有效提高5-FU的经皮渗透量。此外,将化学促渗剂和负极性驻极体联合作用于5-FU,有望进一步提高5-FU经大鼠瘢痕皮肤的渗透量以及在瘢痕组织内的滞留量,可为驻极体5-FU透皮剂的研制及增生性瘢痕的临床治疗提高新技术和新方法。
| [1] | WANG J X, ZHANG L Y, ZHANG J, DING H, WANG D M, WANG Z P. The synergistic effect of organic silicone quaternary ammonium salt and 5-fluorouracil on hepatocellular carcinoma in vitro and in vivo[J]. Eur J Cancer Prev , 2014, 23 :372–384. DOI:10.1097/CEJ.0b013e328364f2c8 |
| [2] | FARIA H A, DE QUEIROZ A A. A novel drug delivery of 5-fluorouracil device based on TiO2/ZnS nanotubes[J]. Mater Sci Eng C Mater Biol Appl , 2015, 56 :260–268. DOI:10.1016/j.msec.2015.06.008 |
| [3] | TANG Q, WANG Y, HUANG R, YOU Q, WANG G, CHEN Y, et al. Preparation of anti-tumor nanoparticle and its inhibition to peritoneal dissemination of colon cancer[J]. PLoS One , 2014, 9 :e98455. DOI:10.1371/journal.pone.0098455 |
| [4] | CHEN J, JIANG Q D, WU Y M, LIU P, YAO J H, LU Q, et al. Potential of essential oils as penetration enhancers for transdermal administration of ibuprofen to treat dysmenorrhoea[J]. Molecules , 2015, 20 :18219–18236. DOI:10.3390/molecules201018219 |
| [5] | HOANG M T, ITA K B, BAIR D A. Solid microneedles for transdermal delivery of amantadine hydrochloride and pramipexole dihydrochloride[J]. Pharmaceutics , 2015, 7 :379–396. DOI:10.3390/pharmaceutics7040379 |
| [6] | 李磊, 赵秀丽, 陈大为, 师帅. 化学促渗剂在经皮给药系统中的应用进展[J]. 中南药学 , 2007, 5 :532–535. |
| [7] | MENG-LUND E, JACOBSEN J, JIN L, JANFELT C, HOLM R, MVLLERTZ A, et al. Azone® decreases the buccal mucosal permeation of diazepam in a concentration-dependent manner via a reservoir effect[J]. J Pharm Sci , 2014, 103 :1133–1141. DOI:10.1002/jps.23877 |
| [8] | NARASIMHA SATHYANARAYANA MURTHY N S, BOGUDA V A, PAYASADA K. Electret enhances transdermal drug permeation[J]. Biol Pharm Bull , 2008, 31 :99–102. DOI:10.1248/bpb.31.99 |
| [9] | 郭鑫, 崔黎丽, 梁媛媛, 黄平, 王美玲, 江键. 负极性驻极体环孢菌素A贴剂的压电性[J]. 高电压技术 , 2014, 40 :1916–1920. |
| [10] | 王美玲, 黄平, 梁媛媛, 苑旺, 郭鑫, 江键. 正极性驻极体对胰岛素降糖效果影响的动物实验研究[J]. 高电压技术 , 2014, 40 :3816–3821. |
| [11] | CUI L, LIU H, MA L, LIANG Y, JIANG J. Enhanced transdermal delivery of cyclosporine a by PP electret and ethyl oleate[J]. IEEE Trans Dielectr Electr Insul , 2012, 19 :1191–1194. DOI:10.1109/TDEI.2012.6259989 |
| [12] | JIAN J, YUANYUAN L, FAJIE D, LIN M, HONGYUE L, LI C. Penetration and stability of external electrostatic field of PP electret through rat skin[J]. IEEE Trans Dielectr Electr Insul , 2012, 19 :1137–1142. DOI:10.1109/TDEI.2012.6259981 |
| [13] | JIANG J, LIANG Y, DONG F, LIU H, TU Y, CUI L. Study of electret effect of rat skin by thermally stimulated discharge analysis[J]. J Electrost , 2012, 70 :258–263. DOI:10.1016/j.elstat.2012.03.007 |
| [14] | CUI L, LIANG Y, MA L, GUO X, LIU H, JIANG J. The combinational effect of PP electret and monoolein on transdermal delivery of cyclosporine A in vitro[J]. J Electrost , 2013, 71 :224–227. DOI:10.1016/j.elstat.2012.11.014 |
| [15] | 陈亮, 流沙, 李世荣. 增生性瘢痕中P物质神经纤维与肥大细胞关联的形态学观察[J]. 第三军医大学学报 , 2006, 28 :979–981. |
| [16] | 侯雪梅, 李国栋, 李卫华. 化学促渗剂及其机理的探讨[J]. 上海医药 , 2008, 29 :231–235. |
 2016, Vol. 37
2016, Vol. 37


