2. 第二军医大学长征医院泌尿外科, 上海 200003;
3. 第二军医大学长海医院核医学科, 上海 200433
2. Department of Urology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China;
3. Department of Nuclear Medicine, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
近年来,机器人外科手术系统辅助腹腔镜技术凭借其更加高清的手术视觉体验、更加灵活的操作模式,在前列腺癌根治术、肾脏部分切除术、肾盂输尿管离断成形术等操作空间狭小、缝合重建要求更为精准的术式中体现出更加显著的优势。2004年,美国Mayo Clinic泌尿外科医生Gettman等[1]率先报道了13例机器人辅助腹腔镜肾部分切除术(robot-assisted partial nephrectomy, RAPN)的经验,此后该技术逐渐得到推广应用。第二军医大学长海医院泌尿外科于2012年报道了应用达芬奇机器人Si完成的12例RAPN的初步经验[2],至2015年6月已实施RAPN 230例。现对上述230例患者的临床资料进行总结分析,探讨RAPN的临床价值及其对保留肾功能带来的意义。
1 资料和方法 1.1 临床资料2012年3月至2015年6月第二军医大学长海医院泌尿外科共230例患者接受了RAPN。其中男性161例,女性69例;年龄19~78岁,平均年龄(51.1±12.1)岁。左侧111例,右侧118例, 双侧1例。复杂性肾肿瘤75例,其中肾门部肿瘤13例,完全内生性肿瘤8例,大肿瘤(直径>4 cm)54例。孤立性肾肿瘤3例。因腰部胀痛等症状而就诊16例,其他患者均系体格检查时发现。既往有腹部手术史42例。所有患者术前均行血常规、胸部X线片、心电图、血糖、肝功能和肾功能等常规检查,检查结果均正常。既往无手术史及重大基础疾病史,且均无手术禁忌证。术前常规行肾小球滤过率(GFR)检查,结果均正常。肾脏CT血管造影(CTA)检查显示肾动脉单支211例,2支16例,3支3例。
1.2 手术方法 1.2.1 麻醉方式及体位采用全身麻醉,经腹腔途径取健侧70°斜卧位,经腹膜后途径取健侧90°卧位,腰部均抬高。
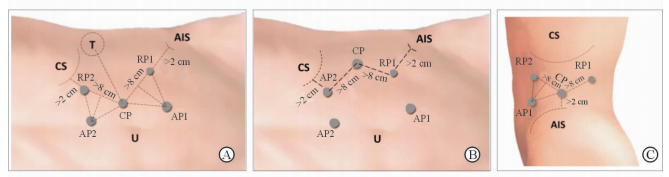
1.2.2 Trocar位置(1) 经腹腔途径分为两种布局方式。①中线布局(图 1A):12 mm镜头孔Trocar置于脐上2 cm腹直肌旁,一8 mm机器人专用Trocar置于镜头孔头侧,距离肋缘大于3 cm; 另一8 mm机器人专用Trocar置于镜头孔尾侧, 距离髂嵴大于3 cm, 三者之间距离应大于8 cm。一12 mm辅助Trocar置于腹直肌旁下腹部。一5 mm辅助Trocar置于剑突下腹正中线。镜头设置呈向下30°。②旁侧布局(图 1B):12 mm镜头孔Trocar置于锁骨中线和腋前线之间距离肋缘3~4 cm,机器人专用Trocar位置同中线布局。一12 mm辅助Trocar置于肚脐上。一5 mm辅助Trocar置于剑突下腹正中线。镜头设置呈向上30°。(2) 经腹腔后途径布局方式(图 1C):与普通腹腔镜腹膜后途径布局方式相同,但镜头孔Trocar和机器人专用Trocar之间距离要大于8 cm,在镜头孔腹侧下腹部需增加一12 mm辅助Trocar。
|
图 1 RAPN的途径和布局方式 A: RAPN经腹途径Trocar中线布局; B: RAPN经腹途径Trocar旁侧布局; C: RAPN经腹腔后Trocar布局. RAPN:机器人辅助腹腔镜肾部分切除术; U:脐; CS:肋缘; AIS:髂前上棘; CP:机器人镜头Port, 12 mm Trocar; RP1:机器人1号臂Port, 8 mm Trocar; RP2:机器人2号臂Port, 8 mm Trocar; AP1, AP2:辅助孔Port, 12 mm Trocar |
1.2.3 达芬奇Si机器人外科手术系统定位
经腹腔途径床旁机械臂手术系统的中心柱与患者背部成15°角,中心柱与脐孔、患肾呈一直线;经腹膜后途径床旁机械臂手术系统位于患者头侧正上方。3个机械臂与上述相应的Trocar连接,并分别置入镜头、单极电剪(第1机械臂)、双极马里兰电凝镊子(第2机械臂),辅助孔内置入辅助器械如吸引器或扇形牵开器等。
1.2.4 手术步骤通过上述描述的体位、Trocar布局及床旁机械臂手术系统定位完成连接,腹腔内手术操作步骤与普通腹腔镜肾部分切除手术基本相同(详见前期研究报告[2])。腹腔内手术操作完毕后解除机械臂与Trocar连接,移走机器人床旁系统,留置引流管,取出标本,缝合各切口。
1.3 观察指标观察并统计术中情况,包括手术时间、术中失血量、输血情况、热缺血时间等;记录术后住院天数、禁食天数、引流管留置天数;记录术后并发症发生情况。术后标本均送病理。随访3~43个月,观察术后复发情况,比较术后与术前肾功能的变化。
1.4 统计学处理运用SPSS 17.0进行统计分析。对于连续变量采用x±s表示,两组间比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 手术情况所有手术在达芬奇Si机器人外科手术系统下施行,均获成功。其中经腹腔入路198例, 布局方式包括中线布局191例,旁侧布局6例,混合布局1例;腹膜后入路32例。本组手术时间为75~540 min,平均(196±59) min;术中失血量为20~2 000 mL,除2例术中分别失血1 000 mL、2 000 mL外,平均失血(148.3±126.5) mL,术中输血3例;热缺血时间6~50 min,平均(20.7±9.1)min;术中1例因缝合创面出血中转开放手术。术后住院天数为5~31 d,平均(8.9±3.3) d;术后禁食天数1~5 d,平均(2.5±0.9) d;术后引流管留置天数1~20 d,平均(4.3±2.1) d。其中复杂性肾肿瘤RAPN 75例,平均手术时间(222.7±58.5) min,平均热缺血时间(26.1±8.8) min。
2.2 术后并发症3例术后出现严重肉眼血尿(均为复杂性肾肿瘤),其中1例经膀胱冲洗及止血保守治疗后治愈,2例行数字减影血管造影(DSA)肾动脉出血分支栓塞术后治愈。1例重复肾畸形上半肾切除患者术后出现尿漏,经充分引流后痊愈。1例术后发生急性脑血管栓塞,致一侧肢体偏瘫(该患者术前患有脑动脉狭窄基础病)。
2.3 术后病理恶性肿瘤195例,包括肾透明细胞癌179例,嫌色细胞癌11例, 乳头状肾细胞癌5例,分期T1N0M0 154例、T2aN0M0 41例; 良性病变35例,包括血管平滑肌脂肪瘤21例, 囊肿性病变4例, 嗜酸细胞腺瘤4例, 重复肾2例, 后肾腺瘤1例, 混合性上皮间质肿瘤1例, 肾脏炎性病变1例, 瘢痕样组织增生1例。肿瘤直径1.3~9.0 cm, 平均为(3.41±1.57) cm,肿瘤切缘均阴性。
2.4 术后随访术后随访3~43个月,未见术后复发病例。术后对125例患者进行肾功能随访,125例RAPN患者术后GFR较术前平均下降(22.8±22.0)%,其中复杂性肾肿瘤患者RAPN术后GFR平均下降(32.5±21.0)%,普通肾肿瘤患者RAPN术后GFR平均下降(17.3±20.6)%,两组差异有统计学意义(P < 0.01,表 1)。复杂性肾肿瘤中肾门部肿瘤、完全内生性肿瘤、大肿瘤患者术后GFR分别平均下降30.6%、42.2%、31.1%。
|
|
表 1 125例机器人辅助腹腔镜肾部分切除术患者手术前后GFR随访情况 |
3 讨论
2004年,美国Mayo Clinic泌尿外科医生Gettman等[1]率先报道了13例RAPN的经验,均为可选择适应证,平均肿瘤大小3.5 cm(2~6 cm)。虽然达芬奇Si机器人手术系统大大提高了肾部分切除术的操作精准性和手术安全性,但RAPN的手术量并未在短期内剧增,手术适应证多局限于外生型且直径 < 4 cm的肾肿瘤,这可能跟达芬奇Si机器人手术高昂的费用以及传统腹腔镜肾癌根治术的冲击有关[3-4]。但是随着手术经验的积累,以及保留肾单位手术较根治性肾切除术的优势进一步阐明,报道的RAPN手术量逐渐增多。基于全美2008年10月至2010年12月的数据显示,肾部分切除术中机器人辅助腹腔镜手术的比例快速上升,2010年开放手术、普通腹腔镜手术和机器人手术的年度增长率分别为7.9%、6.1%和45.4%,RAPN从总手术量上来说也已经远远超过普通腹腔镜手术[5]。
Tanagho等[6]报道了2007至2011年美国5个中心886例RAPN的临床疗效,平均肿瘤大小3.0 cm,其中孤立性肾肿瘤18例(2%);术中阻断肾蒂的比例为92.1%,平均热缺血时间为20.3 min,术中中位出血量为100 mL;术中并发症发生率为2.6%,无死亡并发症病例;总体输血率4.6%,其中10例(1.1%)患者行DSA下动脉栓塞止血。本组共完成RAPN 230例,平均肿瘤大小(3.41±1.57) cm,其中孤立性肾肿瘤3例(1.7%);术中阻断肾蒂的比例为96.9%,平均热缺血时间为(20.7±9.1) min;除2例患者术中出血量≥1 000 mL,其余术中失血量平均(148.3±126.5) mL;术中并发症发生率为2.2%(5/230),无死亡并发症病例;总体输血率为1.3%(3/230),其中2例(0.8%)患者行DSA下动脉栓塞止血。与国外大样本RAPN资料相比,本组在平均热缺血时间、肿瘤大小等方面与国外报道相仿, 术中、术后并发症方面相对较低。
RAPN手术数量增加的同时, RAPN的手术适应证逐渐扩展到高难度、高风险的复杂性肾肿瘤[肾门部肿瘤[7-9]、内生性肿瘤[10]、多发肾肿瘤[11-12] 、大肿瘤(直径>4 cm)[13-15]]。Gong等[16]对29例复杂性肾肿瘤患者实施了RAPN,平均手术时间197 min,平均热缺血时间25 min,平均术中失血量220 mL,平均肿瘤直径3.1 cm,未出现主要的相关并发症及术中输血。本组完成复杂性肾肿瘤RAPN 75例,其中肾门部肿瘤13例,完全内生性肿瘤8例,大肿瘤54例;平均手术时间(222.7±58.5) min,平均热缺血时间(26.1±8.8) min,3例术后出现明显肉眼血尿。从本组及相关报道数据可以看出,对复杂性肾肿瘤实施RAPN总手术时间及热缺血时间相对普通肾肿瘤延长,但在术中及术后并发症方面并没有明显增加。因此,RAPN治疗复杂性肾肿瘤是安全有效的。
国内外文献多采用估算肾小球滤过率(eGFR)对肾部分切除手术前后的肾功能进行评估比较。eGFR代表双侧总体肾功能的情况,一般来说肾部分切除术后患侧肾脏功能受到影响的同时健侧肾脏会发挥一定的代偿作用,因此eGFR并不能准确代表患侧肾脏手术前后的肾功能变化。本组资料着重分析患侧肾脏RAPN手术前后的肾功能变化,对复杂性肾肿瘤与普通肾肿瘤RAPN后双肾总体及单侧患肾GFR的变化进行统计分析。结果显示双肾总体GFR变化评估两组间差异无统计学意义,而仅以单侧患肾GFR变化进行比较,复杂性肾肿瘤RAPN术后患肾GFR平均下降(32.5±21.0)%,普通肾肿瘤RAPN术后患肾GFR平均下降(17.3±20.6)%,普通肾肿瘤术后GFR的降低程度明显小于复杂性肾肿瘤。分析认为与以下因素有关:(1) 大肿瘤增加切除与缝合时间导致热缺血时间延长;(2) 完全内生性肿瘤切除过程中寻找肿瘤困难导致阻断时间延长或因定位困难、远离肾肿瘤而切除过多周围正常肾脏组织;(3) 完全内生性肿瘤位置较深,或肾门部肿瘤紧贴肾蒂血管,缝合时入针过深导致基底部较大血管被缝合,术后实际肾单位因缺血而丧失。本研究同时也说明了单侧患肾GFR的检测评估更能够反应手术本身对患侧肾功能的影响程度。
本组资料中肾门部肿瘤、完全内生性肿瘤、大肿瘤术后GFR分别平均下降30.6%、42.2%、31.1%。随着RAPN技术的不断发展与推广,复杂性肾肿瘤行RAPN必然成为保肾手术的首选,相信以上数据能够为复杂性肾肿瘤术后肾功能的预测起到一定的参考作用。
充分的术前准备是十分必要的,包括实验室检查和影像学检查。术前的影像学检查可以让术者详细了解肾肿瘤的位置、大小、深度和血管及集合系统的关系。其中术前肾动脉重建是对肾部分切除手术至关重要的检查,以此来判断肾动脉的位置、数量及解剖变异,从而帮助术者在术中更为迅速、准确地分离出肾动脉。对于要进行选择性阻断的病例,其可以帮助术者判断供应肿瘤的相应动脉分支。近年国外已有更为先进的近红外显影技术,帮助术者寻找动脉及其血供范围[17-18]。
RAPN最为合适的手术入路是经腹腔入路,原因在于腹腔空间较大,有充足的空间放置镜头和机械臂,以防止三者的干扰。本组有198例(86.1%)为经腹腔入路,此入路适用于绝大多数部位的肾肿瘤。但是对于肾脏上极,尤其是上极背侧的肾肿瘤,该路有一定的视野盲区。本组1例术中中转开放病例即为右肾上极背侧肿瘤,缝合时因无法窥及背侧切缘,从而未完全缝合,导致开放血流后出血。经腹膜后入路则对此位置的肿瘤有极佳的视角,Hughes-Hallett等[19]和Tanaka等[20]认为严格把控适应证,经腹膜后途径也是RAPN的一种安全可行、疗效相当的方法,其明显缺点是操作空间小,机械臂之间相互干扰明显。本组有32例(13.9%)肾脏上极肿瘤选择经腹膜后途径, 均有良好的视角。
Trocar的布局方式对于手术是否能顺利进行至关重要。经腹途径有两种布局方式[21-22]:中线布局和旁侧布局。中线布局方式窥镜位置接近肚脐,更接近普通腹腔镜经腹途径的视野,对于有普通腹腔镜手术经验的术者更为合适,适用于绝大多数部位的肾肿瘤;但对于肾脏上极背侧的肾肿瘤视野不佳,有盲区。而旁侧布局对于这类肾脏肿瘤有良好的视角,且助手有更充足的操作空间,但其缺点在于视野范围相对较小。针对两种布局方式的优缺点,我们首创了混合布局方式,即针对需要经腹途径实施手术的肾脏上极背侧的肿瘤,分离肾脏肿瘤及血管用中线布局,切除肿瘤及缝合创面用旁侧布局。布局方式的改变只需转换镜头位置,机器臂位置不变。对于肥胖患者,整个Trocar布局的方式需要向腹外侧移动,以避开侧卧位后堆积于腹部的脂肪。既往有腹部手术史的患者,Trocar布局要尽量远离原有的手术瘢痕。
RAPN已被证实为一种有效、安全的局限性肾脏肿瘤的手术方式。它拥有更大的放大倍数、更为清晰的三位视野以及灵活的腕臂设计等特性,使该术式的学习曲线更短,术者也更容易掌握腹腔镜下肾脏肿瘤切除及创面血管、集合系统及切缘缝合等关键的腹腔镜肾部分切除技术。目前该术式的研究进展主要集中在如何减少肾脏热缺血的时间和程度,从而使患者能够得到更加理想的术后肾脏功能。有理由相信,RAPN将逐渐被更多的医生及患者所接受。
| [1] | GETTMAN M T, BLUTE M L, CHOW G K, NEURURER R, BARTSCH G, PESCHEL R. Robotic-assisted laparoscopic partial nephrectomy:technique and initial clinical experience with DaVinci robotic system[J]. Urology , 2004, 64 :914–918. DOI:10.1016/j.urology.2004.06.049 |
| [2] | 王林辉, 叶华茂, 徐斌, 刘冰, 纪家涛, 肖亮, 等. 机器人辅助腹腔镜下肾部分切除术12例报告[J]. 中华泌尿外科杂志 , 2012, 33 :814–817. |
| [3] | HOLLENBECK B K, TAUB D A, MILLER D C, DUNN R L, WEI J T. National utilization trends of partial nephrectomy for renal cell carcinoma:a case of underutilization?[J]. Urology , 2006, 67 :254–259. DOI:10.1016/j.urology.2005.08.050 |
| [4] | ABOUASSALY R, ALIBHAI S M, TOMLINSON G, TIMILSHINA N, FINELLI A. Unintended consequences of laparoscopic surgery on partial nephrectomy for kidney cancer[J]. J Urol , 2010, 183 :467–472. DOI:10.1016/j.juro.2009.10.002 |
| [5] | GHANI K R, SUKUMAR S, SAMMON J D, ROGERS C G, TRINH Q D, MENON M. Practice patterns and outcomes of open and minimally invasive partial nephrectomy since the introduction of robotic partial nephrectomy:results from the nationwide inpatient sample[J]. J Urol , 2014, 191 :907–912. DOI:10.1016/j.juro.2013.10.099 |
| [6] | TANAGHO Y S, KAOUK J H, ALLAF M E, ROGERS C G, STIFELMAN M D, KACZMAREK B F, et al. Perioperative complications of robot-assisted partial nephrectomy:analysis of 886 patients at 5 United States centers[J]. Urology , 2013, 81 :573–579. DOI:10.1016/j.urology.2012.10.067 |
| [7] | ROGERS C G, METWALLI A, BLATT A M, BRATSLAVSKY G, MENON M, LINEHAN W M, et al. Robotic partial nephrectomy for renal hilar tumors:a multi-institutional analysis[J]. J Urol , 2008, 180 :2353–2356. DOI:10.1016/j.juro.2008.08.022 |
| [8] | DULABON L M, KAOUK J H, HABER G P, BERKMAN D S, ROGERS C G, PETROS F, et al. Multi-institutional analysis of robotic partial nephrectomy for hilar versus nonhilar lesions in 446 consecutive cases[J]. Eur Urol , 2011, 59 :325–330. DOI:10.1016/j.eururo.2010.11.017 |
| [9] | KHALIFEH A, AUTORINO R, HILLYER S P, KAOUK J H. V-hilar suture renorrhaphy during robotic partial nephrectomy for renal hilar tumors:preliminary outcomes of a novel surgical technique[J]. Urology , 2012, 80 :466–471. DOI:10.1016/j.urology.2012.03.058 |
| [10] | AUTORINO R, KHALIFEH A, LAYDNER H, SAMARASEKERA D, RIZKALA E, EYRAUD R, et al. Robot-assisted partial nephrectomy (RAPN) for completely endophytic renal masses:a single institution experience[J]. BJU Int , 2014, 113 :762–768. DOI:10.1111/bju.12455 |
| [11] | BORIS R, PROANO M, LINEHAN W M, PINTO P A, BRATSLAVSKY G. Initial experience with robot assisted partial nephrectomy for multiple renal masses[J]. J Urol , 2009, 182 :1280–1286. DOI:10.1016/j.juro.2009.06.036 |
| [12] | LAYDNER H, AUTORINO R, SPANA G, ALTUNRENDE F, YANG B, KHANNA R, et al. Robot-assisted partial nephrectomy for sporadic ipsilateral multifocal renal tumours[J]. BJU Int , 2012, 109 :274–280. DOI:10.1111/j.1464-410X.2011.10319.x |
| [13] | BI L, ZHANG C, LI K, FAN X, XU K, HAN J, et al. Robotic partial nephrectomy for renal tumors larger than 4 cm:a systematic review and meta-analysis[J]. PLoS One , 2013, 8 :e75050. DOI:10.1371/journal.pone.0075050 |
| [14] | PATEL M N, KRANE L S, BHANDARI A, LAUNGANI R G, SHRIVASTAVA A, SIDDIQUI S A, et al. Robotic partial nephrectomy for renal tumors larger than 4 cm[J]. Eur Urol , 2010, 57 :310–316. DOI:10.1016/j.eururo.2009.11.024 |
| [15] | FICARRA V, BHAYANI S, PORTER J, BUFFI N, LEE R, CESTARI A, et al. Robot-assisted partial nephrectomy for renal tumors larger than 4 cm:results of a multicenter, international series[J]. World J Urol , 2012, 30 :665–670. DOI:10.1007/s00345-012-0943-9 |
| [16] | GONG Y, DU C, JOSEPHSON D Y, WILSON T G, NELSON R. Four-arm robotic partial nephrectomy for complex renal cell carcinoma[J]. World J Urol , 2010, 28 :111–115. DOI:10.1007/s00345-009-0427-8 |
| [17] | BJURLIN M A, GAN M, MCCLINTOCK T R, VOLPE A, BOROFSKY M S, MOTTRIE A, et al. Near-infrared fluorescence imaging:emerging applications in robotic upper urinary tract surgery[J]. Eur Urol , 2014, 65 :793–801. DOI:10.1016/j.eururo.2013.09.023 |
| [18] | BJURLIN M A, MCCLINTOCK T R, STIFELMAN M D. Near-infrared fluorescence imaging with intraoperative administration of indocyanine green for robotic partial nephrectomy[J]. Curr Urol Rep , 2015, 16 :20. DOI:10.1007/s11934-015-0495-9 |
| [19] | HUGHES-HALLETT A, PATKI P, PATEL N, BARBER N J, SULLIVAN M, THILAGARAJAH R. Robot-assisted partial nephrectomy:a comparison of the transperitoneal and retroperitoneal approaches[J]. J Endourol , 2013, 27 :869–874. DOI:10.1089/end.2013.0023 |
| [20] | TANAKA K, SHIGEMURA K, FURUKAWA J, ISHIMURA T, MURAMAKI M, MIYAKE H, et al. Comparison of the transperitoneal and retroperitoneal approach in robot-assisted partial nephrectomy in an initial case series in Japan[J]. J Endourol , 2013, 27 :1384–1388. DOI:10.1089/end.2012.0641 |
| [21] | CABELO J M, BHAYANI S B, FIGENSHAU R S, BENWAY B M. Camera and trocar placement for robot-assisted radical and partial nephrectomy:which configuration provides optimal visualization and instrument mobility?[J]. J Robotic Surg , 2009, 3 :155–159. DOI:10.1007/s11701-009-0152-8 |
| [22] | BENWAY B M, BHAYANI S B, ROGERS C G, PORTER J R, BUFFI N M, FIGENSHAU R S, et al. Robot-assisted partial nephrectomy:an international experience[J]. Eur Urol , 2010, 57 :815–820. DOI:10.1016/j.eururo.2010.01.011 |
 2016, Vol. 37
2016, Vol. 37


