2. 重庆市中医院药剂科, 重庆 400021
2. Department of Pharmacy, Chongqing Traditional Chinese Medicine Hospital, Chongqing 400021, China
尿酸是嘌呤代谢的产物,血液中过量积累尿酸会使尿酸单钠结晶沉积在远端关节周围相对缺乏血管的组织中,从而导致痛风性关节炎[1-2]。尿酸酶(uricase,UC)可催化氧气和尿酸生成尿囊素、二氧化碳和过氧化氢[3]。由于人体缺乏UC,只能将尿酸作为终产物由肾脏排出体外。在临床上,UC主要用于尿酸水平的诊断和与尿酸水平升高相关疾病的治疗[3]。但是UC半衰期短、生物利用度低、稳定性差,大大限制了其临床使用[3]。
脂质纳米粒(lipid nanoparticles,LP)是一种定向药物载体,属于靶向给药系统。它具有生物膜相似性,能提高被包封药物的稳定性,降低药物不良反应,降低免疫原性,提高药物生物利用度,并兼具靶向和缓释的作用[4]。透明质酸(hyaluronic acid,HA)可靶向到HA受体CD44和CD168,减少炎性细胞的数量,调整细胞因子的表达,对痛风性关节组织起保护作用[5-7]。HA还可通过促进内源性HA合成来改善病理性关节液的性状,达到持续缓解痛风性关节炎症状、延缓痛风性关节炎病情的作用[8-11]。
本研究拟将UC制备成HA修饰的UC脂质体(hyaluronic acid-uricase liposomes,UHLP),不仅希望能提高UC的活性和治疗效果;而且希望UC脂质体(uricase liposomes,ULP)经HA修饰后,在降低体内尿酸水平的同时能够靶向到HA受体CD44和CD168,减少炎性细胞的数量,起到保护关节和抗炎的作用。文献报道的UC剂型有PEG化UC、ULP[12]、UC及过氧化氢酶复合脂质体等[13-15]、白蛋白包裹在HA修饰的LP [16]。将UC包载于UHLP中尚未见报道。
1 材料和方法 1.1 材料产朊假丝酵母UC(美国Sigma-Aldrich公司);尿酸(英国Alfa Aesar公司);大豆卵磷脂(德国Lucas Meyer公司);胆固醇(广州天马精细化工厂);胰蛋白酶、PEG2000(国药集团化学试剂有限公司);HA(曲阜市广龙生物制品厂,平均相对分子质量:12 000,纯度 > 99.0%,批号:20131027);1-乙基-3-[3-(二甲胺基)丙基]碳化二亚胺盐酸盐(成都格雷西亚化学技术有限公司);D-山梨醇、吐温-80 (成都市科龙化工试剂厂);氯化钾(重庆北碚化学试剂厂);Bicine(美国Amresco公司);硼酸、氟化钠(重庆博艺化学试剂有限公司);硼砂(江苏强盛化工有限公司);其余试剂均为分析纯。
1.2 UHLP的制备称取适量的卵磷脂和胆固醇溶于氯仿中,在旋转蒸发仪上挥干氯仿,形成均匀的薄膜;加入乙醚及pH 8.5的Bicine-NaOH缓冲液(含UC),在水浴型超声仪上超声至形成均匀分散体系。将此体系在旋转蒸发仪上除去乙醚,最后形成均匀的乳白色混悬液,经0.22 μm滤膜过滤即得ULP。将含适量HA的Bicine-NaOH溶液在pH 6.0条件下用1-乙基-3-[3-(二甲胺基)丙基]碳化二亚胺盐酸盐在37℃孵育预活化。将已激活的HA加入到ULP溶液中,调节pH为8.5并在37℃条件下与ULP孵化。离心后取沉淀,用pH 8.5的Bicine-NaOH洗涤即可[17-18]。
1.3 UC活性测定方法的建立用硼酸-硼砂缓冲液(pH 8.5,50 mmol/L)配制得到75 μmol/L尿酸溶液,即为测定UC活性的底物。参照王娜等[13]的方法测定UC的活性。在1.18 mL尿酸溶液中加入20 μL的UC和20 μL UHLP破乳后的上清液,然后在293 nm处测定相应的紫外吸收变化值。
1.4 UHLP特性的考察包封率:采用凝胶柱分离-考马斯亮蓝法[16]测定包封率。吸取0.5 mL的UHLP,上Sephadex G-200层析柱,用Bicine-NaOH缓冲液(pH 8.5,50 mmol/L)洗脱分离UHLP和UC。收集UHLP部分,取100 μL,加入乙醚破乳后再加入考马斯亮蓝,在595 nm波长处测定光密度(DUHLP)值; 以同法处理未过柱的UHLP,测定光密度(D总)值。包封率(%)=DUHLP/D总×100%,重复3次。
粒径和zeta电位:取0.5 mL的UHLP,加入4.5 mL的Bicine-NaOH(pH 8.5,50 mmol/L)稀释后,混匀,立即在25℃下用激光粒度电位仪测定粒径和zeta电位。
透射电镜观察:UHLP稀释10倍,用带支持膜的铜网滴片。滴加1滴1%的磷钨酸,染色数分钟后用滤纸吸干染液。在37℃下干燥0.5 h后上机观察。
最适温度:将尿酸溶液分别在20℃、30℃、40℃、50℃、60℃和70℃水浴条件下预热10 min后,在室温(25℃)条件下分别测定游离UC和UHLP中UC的活性。最适pH:将pH 6.5、7.0、7.5、8.0、8.5、9.0、9.5的尿酸溶液在酶的最适温度条件下预热10 min后,测定游离UC和UHLP中UC的活性。热稳定性:取UC和UHLP各2 mL,分别放置于55℃的水浴中,于0、1、2、3、4和5 h时分别取样,测定游离UC和UHLP中UC的活性。贮存稳定性:将UC和UHLP放置于4℃的冰箱中,于第0、5、10、15、20天时分别取样,测定游离UC和UHLP中UC的活性。酸碱稳定性:取UC和UHLP,分别用pH 5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、8.0、9.5的Bicine-NaOH缓冲液稀释后,于40℃水浴条件下放置40 min,取出并测定游离UC和UHLP中UC的活性。抗胰蛋白酶水解能力:分别取1 mL UC和UHLP混悬液,加入Bicine-NaOH缓冲液溶解的胰蛋白酶溶液稀释,混合均匀后放置于37℃的水浴中,在0、10、20、30、40、50、60 min时分别取出并测定游离UC和UHLP中UC的活性。抗部分金属离子和有机化合物能力:取UC和UHLP,分别加入等量的D-山梨醇、吐温-80、氯化钾、氟化钠、PEG2000混匀,在25℃条件下放置1 h后,取出并测定游离UC和UHLP中UC的活性。
1.5 UHLP提高UC活性机制的初步研究 1.5.1 UC与脂质膜的相互作用精密称取1 mg UC溶解于10 mL的Bicine-NaOH缓冲液(pH 8.5,50 mmol/L)中,按1.2项下方法制备UHLP和空白UHLP(不加入UC)。分别取UC、UHLP和空白UHLP与Bicine-NaOH(pH 8.5,50 mmol/L)溶解的异硫氰酸荧光素(FITC)溶液混合后,避光孵化5 min。在激发波长为480 nm、发射波长500~600 nm的条件下,25℃恒温扫描其荧光发射图谱。
1.5.2 UC构象改变取UC,分别在25℃、55℃下孵化3 h,取上层液与FITC的Bicine-NaOH溶液(pH 8.5,50 mmol/L)混合,在激发波长为480 nm、发射波长500~600 nm下检测其荧光强度。取UHLP,分别在25℃、55℃下孵化3 h,在25℃、55℃下提取UC,取上层液与FITC的Bicine-NaOH溶液(pH 8.5,50 mmol/L)混合,同法检测其荧光强度。
1.5.3 UC构效改变取游离UC,用氯仿提取UHLP中的UC,在激发波长为280 nm、发射波长为200~400 nm的条件下,25℃恒温扫描其荧光发射图谱。
2 结果 2.1 UHLP的包封率、粒径及zeta电位制备3批UHLP,经检测,平均包封率为(57.27±3.93)%(n=3),平均粒径为(322.6±8.2)nm(n=3),zeta电位为(-19.4±1.7)mV(n=3)。UHLP的粒径分布和zeta电位见图 1。
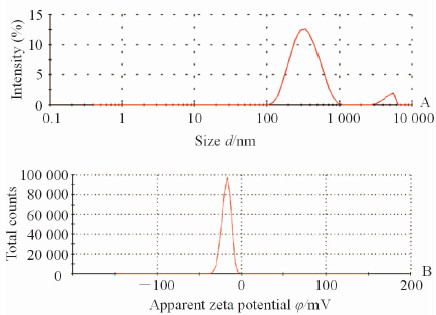
|
图 1 UHLP的粒径分布图(A)和zeta电位分布图(B) Fig 1 Particle size distribution profiles (A) and zeta potential profiles (B) of UHLP |
2.2 UHLP的透射电镜图
电镜下观察到所制备的UHLP呈分布均匀的圆形或椭圆形,见图 2。UC形成的脂质体表面附着一圈HA,说明HA已成功地修饰在脂质体表面。

|
图 2 UHLP的透射电镜图 Fig 2 The transmission electron photomicrograph of UHLP |
2.3 最适温度的测定结果
UHLP和UC最适温度皆为40℃,UHLP在其最适温度时的UC活性约是游离UC在其最适温度时活性的1.09倍。UHLP在温度20~70℃时的活性均较游离UC高,且在40~50℃条件下比游离UC在最适温度下的活性高,此时UC和UHLP中UC活性主要受温度的影响。见图 3。

|
图 3 游离UC和UHLP的最适温度 Fig 3 Optimum temperature of UC in free UC and UHLP |
2.4 最适pH的测定结果
在37℃、pH 6.5~9.5时,UHLP和UC的最适pH值分别为8.0和8.5。UHLP在其最适pH(pH=8.0)时的UC活性约是游离UC在其最适pH(pH=8.5)时活性的1.12倍。UHLP和游离UC在pH 8.5时的UC活性较为接近,pH 6.5~8.0间UHLP中UC的活性较游离UC高。结果表明在37℃条件下经过纳米粒修饰的UHLP能明显提高UC的活性,此时游离UC和UHLP中UC活性主要受pH值的影响。UHLP和UC表现出不同的最适pH,可能是因为UHLP包裹改变了UC的构象,对UC的生物活性带来了一定的影响。见图 4。

|
图 4 游离UC和UHLP的最适pH Fig 4 Optimum pH of UC in free UC and UHLP |
2.5 热稳定性的测定结果
在相同条件下,UHLP表现出了较好的热稳定性。UC活性降到90%需要约0.6 h,而UHLP中UC活性降到90%需要约1.8 h;在5 h时游离UC只保留了不到初始活性的20%,UHLP中UC保留的活性高达70%。结果说明UHLP中UC的热稳定性优于游离UC。见图 5。
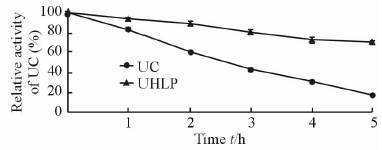
|
图 5 游离UC和UHLP在55℃条件下的热稳定性 Fig 5 Thermal stabilily of UC in free UC and UHLP at 55℃ |
2.6 贮存稳定性的测定结果
在相同条件下,UHLP表现出了更好的贮存稳定性。游离UC活性降到90%需要约1.42 d,UHLP中UC活性降到90%需要约2.79 d;游离UC活性降到50%需要约12.04 d,UHLP放置20 d后,其UC活性约为初始活性的68%。结果说明UHLP中UC的贮存稳定性好于游离UC。见图 6。
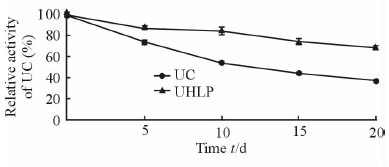
|
图 6 游离UC和UHLP在4℃条件下的贮存稳定性 Fig 6 Storage stability of UC in free UC and UHLP at 4℃ |
2.7 酸碱稳定性的测定结果
在pH 5.0~9.0条件下,UHLP中UC的活性比游离UC的活性高。根据变化趋势可以看出游离UC的活性比UHLP中UC更容易受到pH变化的影响。本结果表明UHLP较UC有更好的耐溶液酸碱变化的能力。见图 7。
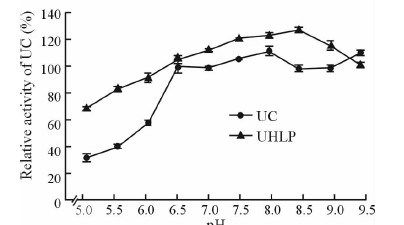
|
图 7 游离UC和UHLP的酸碱稳定性 Fig 7 pH stability of UC in free UC and UHLP |
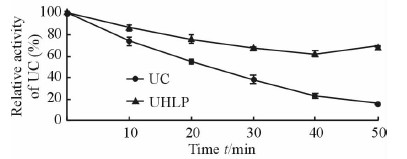
2.8 抗蛋白酶水解能力的测定结果
在蛋白酶作用下,游离UC的活性呈快速下降的趋势:游离UC活性降至90%所需的时间约为3.8 min;活性降至50%所需的时间约为22.8 min。同等条件下,UHLP中UC活性降至90%所需的时间约为7.3 min;直到50.0 min,UHLP仍有69%的活性。结果表明UHLP中UC的抗蛋白酶水解能力优于游离UC。见图 8。
|
图 8 游离UC和UHLP抗胰蛋白酶水解的稳定性 Fig 8 Trypsinase stability of UC in free UC and UHLP |
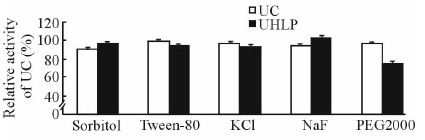
2.9 抗部分金属离子和有机化合物能力的测定结果
加入氟化钠后,UC活性保留为约94%,UHLP中UC活性约为103%;加入PEG2000后,UC活性保留为约97%,UHLP中UC活性降低至约75%;D-山梨醇、吐温-80、氟化钠对UHLP及UC影响不大。见图 9。
|
图 9 部分金属离子和有机化合物对游离UC和UHLP的活性影响 Fig 9 Effect of several metal ions and organic compounds on activity of UC in free UC and UHLP |
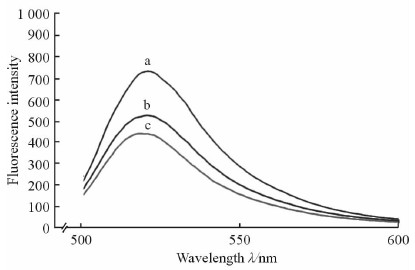
2.10 UHLP活性提高机制的初步研究 2.10.1 UC与脂质体膜作用实验结果
空白UHLP的荧光强度最小,可能是由于其zeta电位为负,导致FITC与UHLP之间出现静电排斥现象;UHLP的荧光强度增加,表明UC可能与FITC竞争性结合脂质体膜,由此可以推测,UC与UHLP的相互作用可能同时存在于UHLP内部和外部的表面区域。见图 10。
|
图 10 荧光图谱 Fig 10 FITC fluorescence spectrum |
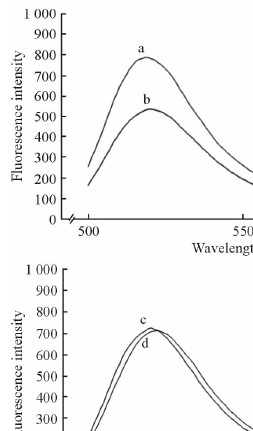
2.10.2 UC构象改变实验结果
在对UC构象改变的考察中,UC(25℃)的荧光强度为784.2,UC(55℃)的荧光强度为532.9,两者的差值为251.3;UHLP(25℃)的荧光强度为731.6,UHLP(55℃)的荧光强度为719.7,两者的差值为11.9。经过高温处理后的UHLP和游离UC的荧光强度相比处理前均明显下降,说明高温条件对酶的结构有所改变。但是,UHLP和游离UC荧光强度变化不同,由此可以推测UC与UHLP的脂质体膜有一定的相互作用,UHLP脂质体膜对UC有一定的保护作用,这也可以说明为什么UHLP的热稳定性优于游离UC。见图 11。
|
图 11 UC(A)和UHLP(B)在25℃和55℃时的荧光强度 Fig 11 Fluorescence intensity of UC (A) and UHLP (B) at 25℃ and 55℃ |
2.10.3 UC构效改变实验结果
UHLP中的UC在280 nm处的吸收强于游离UC,说明UHLP中UC的酪氨酸数量多于游离UC。由此可以推测,UC经UHLP包裹后在相同条件下活性高于游离UC与酪氨酸数量有关,酪氨酸数量越多,其活性越强。见图 12。
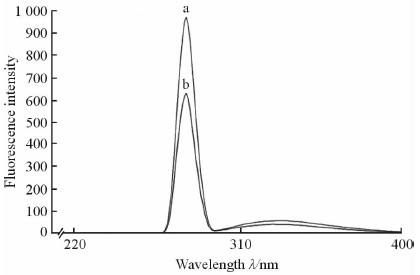
|
图 12 UC和UHLP在280 nm处的荧光强度 Fig 12 Fluorescence intensity of UC in free UC and UHLP at 280 nm |
3 讨论
本实验测定了UC和UHLP的最适温度、最适pH,结果表明UHLP中UC与游离UC相比能更有效地发挥酶促反应。而测定酸碱稳定性、部分金属离子及有机化合物对活性等的影响的目的在于考察制剂与游离酶相比是否能够提高体外稳定性。热稳定性的结果表明,UC被包封在UHLP中以后对抗外界温度变化的能力明显增强,即在相同的条件下UHLP较UC表现出了更好的热稳定性,在加热条件(55℃)和贮存条件(4℃)下,UHLP也均能很好地保持UC的活性。酸碱稳定性的结果充分说明,UHLP能很好地保护UC免受外界pH变化的干扰。抗酶解能力的结果也可充分说明,UHLP能很好地保护UC免受蛋白酶的破坏。
本实验利用FITC能与蛋白质中氨基酸(主要是酪氨酸)结合的原理[16],通过将FITC与UC结合从而使UC有一定的荧光强度。UHLP提高UC活性机制的初步研究的实验结果表明:UC经UHLP包裹后其活性发生了改变,原因与UC同UHLP脂质体膜的相互作用有关,它们的相互作用使UC的构象发生翻转,构效发生改变,UC活性中心暴露,从而导致其活性增强。通过测定酪氨酸的荧光强度来考察UC的构效,利用酪氨酸含量与其荧光吸收强度成正比的关系,当荧光强度越强时表明此时溶液体系中酪氨酸的含量越多[18-19]。由本实验数据可看出,UHLP有增强UC活性和提高UC体外稳定性的优点,本实验为UC纳米粒的体内研究奠定了良好的基础。
| [1] | SAKAI H, TSUTAMOTO T, TSUTSUI T, TANAKA T, ISHIKAWA C, HORIE M. Sermn level of uric acid, partly secreted from the failing heart is a prognostic marker in patients with congestive hean failure[J]. Circ J , 2006, 70 :1006–1011. DOI:10.1253/circj.70.1006 |
| [2] | KRISHNAN E, KWOH C K, SCHUMACHER H R, KULLER L. Hyperuricemia and incidence of hypertension among men without metabolic syndrome[J]. Hypertension , 2007, 49 :298–303. DOI:10.1161/01.HYP.0000254480.64564.b6 |
| [3] | FREITAS D S, SPENCER P J, VASSÃO R C, ABRAHÃO-NETO J. Biochemical and biopharmaceutical properties of PEGylated uricase[J]. Int J Pharm , 2010, 387 (1/2) :215–222. |
| [4] | CUI Y, WU Z, LIU X, NI R, ZHU X, MA L, et al. Preparation, safety, pharmacokinetics, and pharmacodynamics of liposomes containing Brucea javanica oil[J]. AAPS Pharm Sci Tech , 2010, 11 :878–884. DOI:10.1208/s12249-010-9454-4 |
| [5] | HUANG M H, YANG R C, LEE C L, CHEN T W, WANG M C. Preliminary results of integrated therapy for patients with knee osteoarthritis[J]. Arthritis Rheum , 2005, 53 :812–820. DOI:10.1002/(ISSN)1529-0131 |
| [6] | MORELAND L W. Intra-articular hyaluronan (hyaluronic acid) and hylans for the treatment of osteoarthritis:mechanisms of action[J]. Arthritis Res Ther , 2003, 5 :54–67. |
| [7] | ASARI A, MIYAUCHI S, MATSUZAKA S, ITO T, KOMINAMI E, UCHIYAMA Y. Molecular weight-dependent effects of hyaluronate on the arthritic synovium[J]. Arch Histol Cytol , 1998, 61 :125–135. DOI:10.1679/aohc.61.125 |
| [8] | GHOSH P. The role of hyaluronic acid (hyaluronan) in health and disease:interactions with cells, cartilage and components of synovial fluid[J]. Clin Exp Rheumatol , 1994, 12 :75–82. |
| [9] | YASUI T, AKATSUKA M, TOBETTO K, HAYAISHI M, ANDO T. The effect of hyaluronan on interleukin-1α-induced prostaglandin E2 production in human osteoarthritic synovial cells[J]. Agents Actions , 1992, 37 (1/2) :155–156. |
| [10] | MONFORT J, NACHER M, MONTELL E, VILA J, VERGES J, BENITO P. Chondroitin sulfate and hyaluronic acid (500-730 kDa) inhibit stromelysin-1 synthesis in human osteoarthritic chondrocytes[J]. Drugs Exp Clin Res , 2005, 31 :71–76. |
| [12] | 张敉, 杨林, 周云莉, 邓雪, 张景勍. 脂质纳米粒提高尿酸氧化酶体外稳定性的初步研究[J]. 重庆医科大学学报 , 2014, 39 :1452–1455. |
| [13] | 王娜, 赵春景, 黄开顺, 滕永真, 张景勍. 产朊假丝酵母尿酸酶脂质纳米粒的制备及其药效学特性分析[J]. 中国生物制品学杂志 , 2013, 26 :1147–1150. |
| [14] | 张纯.尿酸酶的聚乙二醇修饰及其成药性的初步评价[D].重庆:重庆医科大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10631-1011174001.htm |
| [15] | 周云莉, 杨林, 吴建勇, 张永红, 张景勍. 尿酸酶复合脂质体中尿酸酶的药动学考察[J]. 中国医院药学杂志 , 2014, 34 :1805–1808. |
| [16] | PEER D, MARGALIT R. Loading mitomycin C inside long circulating hyaluronan targeted nano-liposomes increases its antitumor activity in three mice tumor models[J]. Int J Cancer , 2004, 108 :780–789. DOI:10.1002/(ISSN)1097-0215 |
| [17] | 方奕巍, 尹宗宁. 透明质酸修饰的白蛋白纳米粒的制备及抗肿瘤作用的初步评价[J]. 四川大学学报(医学版) , 2011, 42 :480–484. |
| [18] | TAN Q, ZHANG J Q, WANG N, YANG H, LI X, XIONG H R, et al. Improved biological properties and hypouricaemic effects of uricase from Candida Utilis loaded in novel alkaline enzymosomes[J]. Int J Nanomedicine , 2012, 7 :3929–3938. |
| [19] | TAN Q, ZHANG J, WANG N, LI X, XIONG H, TENG Y, et al. Uricase from Bacillus fastidious loaded in alkaline enzymosomes:enhanced biochemical and pharmacological characteristics in hypouricemic rats[J]. Eur J Pharm Biopharm , 2012, 82 :43–48. DOI:10.1016/j.ejpb.2012.06.002 |
 2016, Vol. 37
2016, Vol. 37


