2. 复旦大学附属浦东医院药剂科, 上海 201399
2. Department of Pharmacy, Shanghai Pudong Hospital, Fudan University, Shanghai 201399, China
肢体痉挛是中枢神经系统损伤后常见后遗症之一。脑损伤、多发性硬化、小儿脑瘫、脊髓损伤的部分患者会出现痉挛。痉挛严重影响患者的健康状态和生活质量[1-2]。上肢痉挛造成的疼痛、卫生问题与生活质量密切相关[3]。既往认为上肢痉挛的发生率高于下肢痉挛,但最近一项系统评价结果提示,中枢神经损伤后上、下肢痉挛发生率相当,且下肢痉挛也会严重影响患者的运动功能及生活质量[4]。伴有痉挛的多发性硬化、脑卒中患者的医疗费用比无痉挛患者的医疗费用更高[5-6]。中枢神经损伤后肢体的痉挛机制包括:下行抑制系统的抑制作用减弱、周围传入增强、脊髓运动神经元兴奋性增高等[7],但具体机制仍未完全清楚。动物模型损伤中枢不同部位可模拟不同损伤机制导致的肢体痉挛,如通过栓塞大鼠大脑中动脉可模拟脑卒中后的肢体痉挛[8];通过低氧环境造成幼年大鼠脑缺血可模拟小儿脑瘫后肢体痉挛[9];通过切断锥体束模拟皮质脊髓束损伤造成的肢体痉挛[10];通过小鼠SODA93基因突变模拟肌萎缩侧索硬化症患者的痉挛[11]。为了研究皮质损伤后下肢痉挛及其机制,我们拟通过损伤大鼠单侧后肢运动皮质,观察对侧后肢的痉挛情况,为后续的修复重建手术提供合适的动物模型。
1 材料和方法 1.1 实验动物与主要试剂成年雄性SD大鼠由复旦大学实验动物中心提供[生产许可证号:SCXK(沪)2014-0004]。戊巴比妥钠、赤藓红B、巴氯芬、霍乱毒素(Cholera Toxin B Subunit fluorescein isothiocyanate conjugated,CTB)均购自美国Sigma公司。盐酸氯胺酮为江苏恒瑞医药股份有限公司生产。H-E染色试剂盒购自上海博谷生物科技有限公司。一抗稀释液购自碧云天生物技术研究所。囊泡型谷氨酸转运体1(vesicular glutamine transporter 1,VGLUT1)抗体购自美国Millipore公司。驴抗豚鼠cy3二抗购自美国Bioss公司。抗荧光淬灭封片剂购自武汉谷歌生物科技有限公司。多聚甲醛、磷酸盐缓冲液(PBS)等常规试剂由复旦大学卫生部手功能重建重点实验室提供。
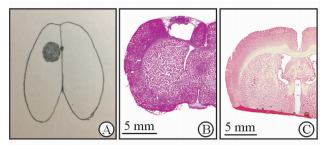
1.2 模型制作过程20只清洁级成年雄性SD大鼠,体质量220~250 g,随机分为两组:实验组(A组)和对照组(B组),每组10只。将大鼠用戊巴比妥钠(40 mg/kg)腹腔麻醉后,固定于立体定位仪上,备皮消毒后作头皮纵向切口,暴露颅骨,定位前囟点,A组大鼠尾静脉注射赤藓红B (20 mg/kg),5 min后以激光器(上海熙隆光电科技有限公司)照射单侧后肢运动皮质[12](中线左侧1~5 mm,前囟点上0.5 mm~下3 mm,见图 1A),激光波长532 nm,功率172 mW,光斑直径5 mm,持续照射10 min,激光照射之后缝合头皮。B组大鼠中5只尾静脉注射等量生理盐水后以同样方法照射激光,另5只经尾静脉注射赤藓红B后不照射激光。B组大鼠在上述两种不同对照处理后,H-E染色中未观察到脑组织的损伤,也未见H反射频率依赖性抑制(rate dependent depression,RDD)明显改变,所以在后续检测时未将两种对照处理分开检测。
|
图 1 激光损伤示意图及两组大鼠大脑H-E染色结果 Fig 1 Schematic location of photothrombotic illumination and H-E staining results of the brain tissues |
1.3 H反射RDD的检测
术前和术后3、7、14、28 d,将两组大鼠用盐酸氯胺酮(200 mg/kg)麻醉后,以俯卧位固定于实验台,双后肢常规备皮消毒,将四通道肌电图仪(荷兰Biosemi公司)的电极一端连于电脑,打开keypoint软件。将接受电极经皮插入右侧第3、4跖骨间跖肌,将刺激电极经皮插入右侧内踝神经附近,地线连于大鼠尾部。以0.1 Hz、0.2 ms、0.1 mA的方波刺激神经,以0.5 mA递增逐渐增大刺激电流,确定H波波幅最大值之后,再分别以0.1、0.5、1、2、5 Hz频率刺激神经,每个频率刺激20次,每次间隔3 s,记录不同频率刺激下H波波幅,并与0.1 Hz时H波最大波幅相比较,结果表示为与0.1 Hz刺激时最大波幅的百分比。不同频率之间电刺激间隔2 min。左后肢以相同方法检测。
1.4 巴氯芬抗痉挛作用术后28 d,在上述检测完成后,将A组大鼠随机分为巴氯芬组(A1)和生理盐水组(A2)组,每组5只;B组大鼠以同样方法分为B1、B2组。巴氯芬组大鼠腹腔注射巴氯芬9 mg/kg,生理盐水组大鼠腹腔注射等量生理盐水。注射90 min后再次以上述方法确定不同频率刺激下H波波幅,结果与0.1 Hz刺激下的最大波幅相比较。
1.5 脊髓运动神经元逆行示踪及免疫荧光化学染色H反射检测完成后,取A2、B2两组大鼠,切开右侧足部皮肤及皮下组织后,显露跖肌,用微量进样器将5 μL 1%的CTB注射入跖肌,注射持续2 min,留置针头2 min,然后用生理盐水冲洗伤口。7 d后再次将大鼠麻醉,经左心室灌注300 mL生理盐水后,再继续灌注300 mL 4%多聚甲醛。取L4、L5、L6各节段脊髓及脑组织,置于4%多聚甲醛中固定过夜,后用30%蔗糖溶液脱水。然后将脊髓组织置于冰冻切片机(德国Leica公司)中冰冻切片,层厚40 μm,每个节段随机取5张切片,用0.1% Triton ×100和3%牛血清白蛋白的混合液室温作用30 min,于4℃过夜标记VGLUT1一抗(1∶1 000),37℃复温1 h,阴性对照不加一抗。以0.01 mol/L PBS清洗切片3次,再加入驴抗豚鼠二抗(1∶200)于37℃下避光作用1 h,再次用PBS洗片,用抗荧光淬灭封片剂封片。
1.6 激光共聚焦扫描切片在63倍油镜下,观察并定位CTB标记的阳性细胞,激光共聚焦显微镜(德国Leica公司)以0.5 μm层厚扫描切片。A、B两组各选取15个CTB阳性细胞,选取标准为细胞胞体完整、突起与邻近的神经元突起无明显重叠。先以488 nm波长激光扫描CTB标记的神经元胞体及突起,再次以548 nm波长激光扫描VGLUT1标记的囊泡。将各层扫描的照片纵向叠加重建,选取直径大于1 μm的囊泡,并计数位于神经元胞体及近端突起上VGLUT1的数量,同时测量近端突起长度,结果表示为每100 μm近端突起上VGLUT1数量。
1.7 脑组织H-E染色脑组织经石蜡包埋后,以5 μm厚度切片,经二甲苯脱蜡,伊红染色5 min,盐酸乙醇分化后苏木精染色,常规脱水、透明后中性树胶封片,光学显微镜(德国Leica公司)下观察并拍照。
1.8 统计学处理用SPSS 19.0软件进行统计学分析,数据以x±s表示。两组间比较采用两样本均数比较的t检验,检验水准(α)为0.05。
2 结 果 2.1 脑组织H-E染色结果如图 1所示,A组大鼠可见左侧脑组织明显缺损,而B组两种不同对照处理中大鼠左侧脑组织均完整,未见明显组织缺损及坏死。
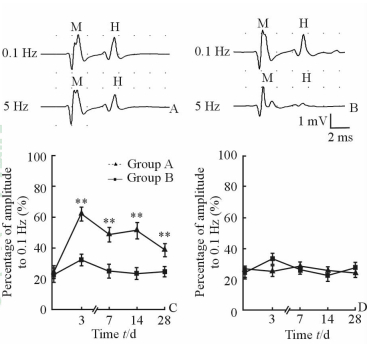
2.2 两组大鼠双后肢跖肌H反射RDD在不同时间点的变化与0.1 Hz刺激相比,A组大鼠在5 Hz刺激下右侧跖肌H反射波幅降低不明显(图 2A);而B组大鼠术前及术后5 Hz频率刺激较0.1 Hz刺激相比,H反射呈现抑制现象(图 2B)。术后3、7、14和28 d,A组大鼠在5 Hz刺激下,右后肢跖肌H反射波幅相对于0.1 Hz刺激下波幅的百分比分别为(61.8±4.5)%、(48.7±4.7)%、(51.3±5.2)%和(38.7±4.2)%;而B组大鼠右后肢跖肌这一百分比分别为(32.3±3.7)%、(25.0±4.5)%、(23.5±3.9)%和(24.7±3.3)%,各时间点两组比较差异均有统计学意义(P<0.01,图 2C)。在术后各时间点,A、B两组大鼠左后肢跖肌在5 Hz刺激下,H反射波幅两组比较差异无统计学意义(P>0.05,图 2D)。
|
图 2 两组大鼠双后肢跖肌H反射RDD在不同时间点的变化 Fig 2 H reflex RDD changes at different time points between two groups |
2.3 巴氯芬对两组大鼠抗痉挛效果观察
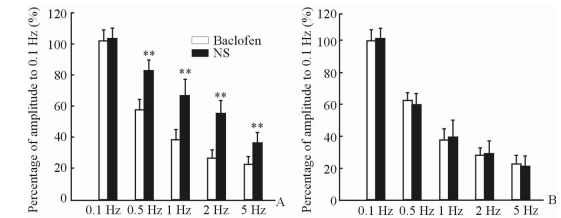
A1组大鼠注射巴氯芬后,以0.1、0.5、1、2和5 Hz刺激后的右后肢跖肌H波波幅相对0.1 Hz刺激的百分比分别为(99.5±7.0)%、(56.5±5.0)%、(37.5±7.0)%、(26.1±5.2)%和(22.0±5.5)%;注射生理盐水的A2组大鼠在0.1、0.5、1、2和5 Hz的刺激下,H波波幅相对于0.1 Hz刺激的百分比分别为(100.8±6.1)%、(80.8±7.2)%、(65.2±10.6)%、(53.7±8.6)%和(35.5±6.7)%;在大于0.1 Hz的刺激下,两者间H波波幅的差异有统计学意义(P<0.01,图 3A)。B1组注射巴氯芬的大鼠在各频率刺激下,与注射生理盐水的B2组大鼠相比,两者右后肢跖肌的H波波幅差异无统计学意义(P>0.05,图 3B)。
|
图 3 两组大鼠注射巴氯芬后H反射RDD的变化 Fig 3 H reflex RDD changes after baclofen injection in the two groups |
2.4 CTB标记的运动神经元及神经元胞体及突起上VGLUT1囊泡的计数
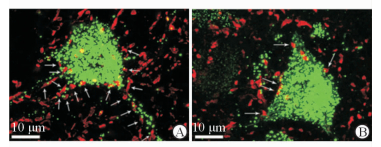
两组大鼠CTB逆行标记的运动神经元数量见表 1,两组大鼠运动神经元数量在各个脊髓节段的差异无统计学意义(P>0.05)。A组大鼠神经元上VGLUT1囊泡的数量(胞体:6.7±1.2;突起:7.3±0.9)较B组(胞体:4.5±0.9;突起:4.3±0.8)增加(P<0.01)。染色结果见图 4。
|
|
表 1 两组大鼠CTB标记的运动神经元计数 Tab 1 Quantification of CTB labeled motoneurons in different spinal segments of two groups |
|
图 4 两组大鼠脊髓前角运动神经元VGLUT1染色 Fig 4 Immunofluorescent staining of VGLUT1 positive boutons on CTB labeled motoneurons of two groups |
3 讨 论
本研究通过损伤大鼠大脑单侧运动皮质后,记录H反射RDD的变化,观察到损伤后3 d对侧肢体脊髓反射兴奋性即增高,且持续至损伤后4周,而同侧后肢H反射RDD未见明显变化。通过脑组织H-E染色可见实验组大鼠脑组织单侧运动皮质的特异性损伤。通过本体感觉传入纤维末梢VGLUT1囊泡的免疫荧光染色可见周围本体感觉传入纤维增多。说明通过单纯损伤单侧大脑皮质,造成锥体细胞的坏死,下行皮质脊髓束受损后对脊髓的抑制作用减弱,脊髓反射兴奋性增高,可造成对侧肢体痉挛。
下行传导束损伤后,其轴突发生溃变崩解,崩解产物能够激活脊髓中的小胶质细胞[10],而激活的小胶质细胞能够释放白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)以及脑源性神经营养因子(BDNF)[13]。BDNF能够使脊髓运动神经元细胞膜上的氯-钾转运体寡聚体降解为单体,从而使细胞内的氯离子浓度升高,使细胞处于去极化状态[14]。通过逐渐增加刺激频率,正常大鼠肌肉H反射波幅被抑制,痉挛时,H反射在高频率的刺激下,波幅下降不明显,RDD减弱,表明脊髓反射兴奋性增高[15]。在该模型中,脑损伤后的早期即可见后肢肌肉H反射RDD减弱。在Lee等[15]小鼠前肢运动皮质损伤后肢体痉挛的模型中,在损伤1周后,损伤同侧肢体的H反射RDD也出现减弱,而在本实验中未发现同侧肢体的H反射RDD减弱,可能的原因为皮质脊髓束部分投射至同侧脊髓,而在腰髓的比例较颈髓更低,不足以引起同侧脊髓反射增强。与脑损伤不同,在脊髓损伤后,最初的2周内脊髓反射消失,无痉挛出现,随着低级反射的出现后逐渐出现痉挛,且痉挛逐渐增强[16]。脑损伤与脊髓损伤后肢体痉挛出现的时间不同,机制亦不同。通过对痉挛的大鼠注射γ氨基丁酸(GABA) 受体激动剂(巴氯芬)后,H反射RDD增强,说明损伤后脊髓抑制性递质的作用减弱,突触前抑制作用减弱。激活GABA受体后,神经元对抑制性递质的反应增强,出现H反射RDD的恢复。
脑损伤后,可出现远离损伤部位的重塑[17]。本体感觉传入纤维与下行传导的皮质脊髓束共同维持脊髓运动神经元的兴奋性。VGLUT1为本体感觉传入末梢的标记[18],特异性损伤皮质脊髓束后,本体感觉传入纤维末梢囊泡扩张,数量增多[10]。而本实验中损伤大鼠单侧大脑皮质的锥体细胞,亦会造成锥体束的损伤,与单纯损伤锥体束的机制类似。通过对脊髓运动神经元胞体及突起上的VGLUT1计数发现,单侧皮质损伤后,其在对侧脊髓神经元胞体及突起上的数量都增加,说明皮质损伤后,周围本体感觉传入信号增强,可使脊髓单突触反射增强。
临床上可通过改良Ashworth评分量表客观地评价肢体的痉挛[19],但在大鼠,还没有相关的量表可直接用于评价中枢神经损伤后肢体痉挛。本研究通过损伤单侧后肢皮质运动中枢,可造成对侧后肢痉挛性偏瘫,伴有脊髓运动神经元兴奋性增强,突触前抑制减弱,周围本体感觉传入纤维增多,可以很好地模拟皮质损伤后下肢的痉挛。该模型可作为合适的动物模型,用于脑损伤后下肢痉挛性偏瘫的修复重建。
| [1] | FLACHENECKER P, HENZE T, ZETTL U K. Spasticity in patients with multiple sclerosis-clinical characteristics, treatment and quality of life[J]. Acta Neurol Scand , 2014, 129 :154–162. DOI:10.1111/ane.2014.129.issue-3 |
| [2] | GILLARD P J, SUCHAREW H, KLEINDORFER D, BELAGAJE S, VARON S, ALWELL K, et al. The negative impact of spasticity on the health-related quality of life of stroke survivors: a longitudinal cohort study[J]. Health Qual Life Outcomes , 2015, 13 :159. DOI:10.1186/s12955-015-0340-3 |
| [3] | DOAN Q V, BRASHERA A, GILLARD P J, VARON S F, VANDENBURGH A M, TERKEL C C, et al. Relationship between disability and health-related quality of life and caregiver burden in patients with upper limb poststroke spasticity[J]. PM R , 2012, 4 :4–10. DOI:10.1016/j.pmrj.2011.10.001 |
| [4] | MARTIN A, ABOGUNRIN S, KURTH H, DINET J. Epidemiological, humanistic, and economic burden of illness of lower limb spasticity in adults: a systematic review[J]. Neuropsychiatr Dis Treat , 2014, 10 :111–122. |
| [5] | GANAPATHY V, GRAHAM G D, DIBONAVENTURA M D, GILLARD P J, GOREN A, ZOROWITZ R D. Caregiver burden, productivity loss, and indirect costs associated with caring for patients with poststroke spasticity[J]. Clin Interv Aging , 2015, 10 :1793–1802. |
| [6] | SVENSSON J, BORG S, NILSSON P. Costs and quality of life in multiple sclerosis patients with spasticity[J]. Acta Neurol Scand , 2014, 129 :13–20. |
| [7] | MUKHERJEE A, CHAKRAVARTY A. Spasticity mechanisms-for the clinician[J]. Front Neurol , 2010, 1 :149. |
| [8] | SHI G X, YANG C Y, WU M M, GUAN L P, WANG L P, LIU C Z. Muscle hypertonia after permanent focal cerebral ischemia in rats: a qualitative and quantitative behavioral and electrophysiological study[J]. Int J Neurosci , 2013, 123 :575–581. DOI:10.3109/00207454.2013.783578 |
| [9] | MEIER C, MIDDELANIS J, WASIELEWSKI B, NEUHOFF S, ROTH-HAERER A, GANTERT M, et al. Spastic paresis after perinatal brain damage in rats is reduced by human cord blood mononuclear cells[J]. Pediatr Res , 2006, 59 :244–249. DOI:10.1203/01.pdr.0000197309.08852.f5 |
| [10] | TAN A M, CHAKRABARTY S, KIMURA H, MARTIN J H. Selective corticospinal tract injury in the rat induces primary afferent fiber sprouting in the spinal cord and hyperreflexia[J]. J Neurosci , 2012, 32 :12896–12908. DOI:10.1523/JNEUROSCI.6451-11.2012 |
| [11] | MÒDOL L, MANCUSO R, ALÉ A, FRANCOS-QUIJORNA I, NAVARRO X. Differential effects on KCC2 expression and spasticity of ALS and traumatic injuries to motoneurons[J]. Front Cell Neurosci , 2014, 8 :7. |
| [12] | SEONG H Y, CHO J Y, CHOI B S, MIN J K, KIM Y H, ROH S W, et al. Analysis on bilateral hindlimb mapping in motor cortex of the rat by an intracortical microstimulation method[J]. J Korean Med Sci , 2014, 29 :587–592. DOI:10.3346/jkms.2014.29.4.587 |
| [13] | JIA H, FENG X, LI W, HU Y, ZENG Q, LIU J, et al. Recombinant human erythropoietin attenuates spinal neuroimmune activation of neuropathic pain in rats[J]. Ann Clin Lab Sci , 2009, 39 :84–91. |
| [14] | BOULENGUEZ P, LIABEUF S, BOS R, BRAS H, JEAN-XAVIER C, BROCARD C, et al. Down-regulation of the potassium-chloride cotransporter KCC2 contributes to spasticity after spinal cord injury[J]. Nat Med , 2010, 16 :302–307. DOI:10.1038/nm.2107 |
| [15] | LEE S, TODA T, KIYAMA H, YAMASHITA T. Weakened rate-dependent depression of Hoffmann's reflex and increased motoneuron hyperactivity after motor cortical infarction in mice[J]. Cell Death Dis , 2014, 5 :e1007. DOI:10.1038/cddis.2013.544 |
| [16] | KAKINOHANA O, HEFFERAN M P, NAKAMURA S, KAKINOHANA M, GALIK J, TOMORI Z, et al. Development of GABA-sensitive spasticity and rigidity in rats after transient spinal cord ischemia: a qualitative and quantitative electrophysiological and histopathological study[J]. Neuroscience , 2006, 141 :1569–1583. DOI:10.1016/j.neuroscience.2006.04.083 |
| [17] | HAN Q, CAO C, DING Y, SO K F, WU W, QU Y, et al. Plasticity of motor network and function in the absence of corticospinal projection[J]. Exp Neurol , 2015, 267 :194–208. DOI:10.1016/j.expneurol.2015.03.008 |
| [18] | HUGHES D I, POLGAR E, SHEHAB S A, TODD A J. Peripheral axotomy induces depletion of the vesicular glutamate transporter VGLUT1 in central terminals of myelinated afferent fibres in the rat spinal cord[J]. Brain Res , 2004, 1017 :69–76. DOI:10.1016/j.brainres.2004.05.054 |
| [19] | NATALE M, D'ORIA S, NERO V V, SQUILLANTE E, GENTILE M, ROTONDO M. Long-term effects of intrathecal baclofen in multiple sclerosis[J]. Clin Neurol Neurosurg , 2016, 143 :121–125. DOI:10.1016/j.clineuro.2016.02.016 |
 2016, Vol. 37
2016, Vol. 37


