2. 上海交通大学药学院细胞工程及抗体药物教育部工程研究中心, 上海 200240;
3. 上海交通大学上海系统生物医学研究中心, 上海 200240
2. Engineering Research Center of Cell and Therapeutic Antibody of Ministry of Education, Shanghai Jiaotong University School of Pharmacy, Shanghai 200240, China;
3. Shanghai Center for System Biomedicine, Shanghai Jiaotong University, Shanghai 200240, China
灵芝(Ganoderma lucidum)属于担子菌纲(Basidiomycetes)多孔菌目(Polyporales)灵芝科(Ganodermataceae)真菌,古称“瑞草”,俗称“灵芝草”,自古就是我国名贵的中药材,被广泛应用于预防与治疗各类疾病。现代医药研究证明,灵芝中有多种活性成分,包括多糖、三萜、各类蛋白质、凝集素以及其他生物活性成分,并具有广泛的药理活性[1]。在先前的研究中,对灵芝中活性成分和药理作用的研究主要集中在多糖[2-3]和三萜[4-5]上,其中灵芝多糖是被研究的最为广泛和深入的活性成分之一。蛋白和多糖结合而成的糖蛋白是灵芝中重要的功能成分,同时灵芝中的其他蛋白质也因为其在制药工业中的潜能而得到越来越多研究者的关注[6]。灵芝菌丝体和子实体中可分泌出大量生物活性蛋白和多肽类,如真菌免疫调节蛋白[7]、外源凝集素[8]、木质素降解酶[9]、核糖体失活蛋白、核糖核酸酶和其他多种蛋白[10]。据有关分析,代料栽培的灵芝中蛋白含量仅约为14.34%,而大部分灵芝蛋白有着明显的生理活性;随着生物技术在药物研究和开发中的应用,特别是利用生物技术方法对中草药中基因、蛋白和药理作用之间关系的逐渐探索,灵芝蛋白质的研究逐渐得到重视,也展示出广阔的开发利用前景[10]。
锰过氧化物酶(manganese peroxidase,MnP;E.C.1.11.1.13)属于灵芝中的一类胞外糖蛋白,由糖基化的含Fe(s)-卟啉环(IX)血红素辅基组成,其等电点为4.2~4.5,真菌产生的MnP的相对分子质量通常大小为38 000~62 500,大多数纯化的MnP的相对分子质量约为45 000[11]。MnP的酶活中心由1个Mn2+和1个血红素基构成,还有2个Ca2+起稳定结构作用,其分子由1条短的单链及10条长的蛋白质单链构成。MnP的催化循环由H2O2或有机过氧化物与含有Fe3+的MnP相结合,经双电子氧化,形成Fe4+-过氧化络合物;随后,从血红素上转移2个电子,过氧化物的O=O键裂解,释放1分子的H2O,从而形成活性中间体化合物Ⅰ(Fe4+-氧基-卟啉-自由基-复合体);紧接着活性中间体化合物Ⅰ与底物Mn2+结合,发生还原反应,生成活性中心体化合物Ⅱ(Fe4+-氧基-卟啉-复合体)。在整个MnP的催化循环过程中,Mn2+作为电子供体,被氧化成Mn3+;活性中心体化合物Ⅱ以类似的方式与Mn2+结合,生成Mn3+并释放1分子H2O,还原到原始状态,则整个催化循环结束[12]。MnP的活性依赖于H2O2和Mn2+的存在,离体条件下能分解芳香环多聚体,因此该酶被广泛应用于造纸工业、食品工业、医药工业及绿色合成等领域[8],特别是在医药工业领域如抗生素工业废水处理[13]、激素类物质在人体内的生物降解[14]等方面有着广阔的应用前景。在前期研究中,我们从灵芝中克隆了灵芝锰过氧化物酶(Ganoderma lucidum manganese peroxidase,GlMnP)基因(GenBank: ACD44889.1),同时构建了酵母表达载体pAO815::GlMnP,通过电转化的方法转入毕赤酵母(Pichia pastoris) SMD1168,形成了GlMnP毕赤酵母工程菌(数据未报道)。本实验主要探讨利用基因工程菌生产重组GlMnP(recombinant GlMnP,rGlMnP)的最优培养条件。我们在单因素实验基础上,采用中心组合设计(central composite design,CCD)和响应面分析法(response surface methodology,RSM),分析初始pH值、温度、培养基中甲醇和血红素浓度对重组毕赤酵母生产rGlMnP的酶活力的影响,以期通过对培养条件的优化,进一步提高酶活力,为利用毕赤酵母工程菌生产rGlMnP和工业化生产应用奠定基础。
1 材料和方法 1.1 材料毕赤酵母(Pichia pastoris) SMD1168转化子带有pAO815::GlMnP质粒载体由上海交通大学农业与生物学院植物生物技术研究中心保存。
1.2 培养基酵母浸出物蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)培养基1 L:1%酵母浸出物,2%蛋白胨,2%葡萄糖,2%琼脂粉;缓冲型最小甘油复合(buffered minimal glycerol-complex,BMGY)培养基1 L: 1%酵母浸出物,2%蛋白胨,100 mmol/L磷酸钾(pH 6.0),1.34%无氨基酵母浸出物(yeast nitrogen base without amino acids,YNB),4×10%生物素,1%甘油;缓冲型甲醇复合(buffered methanol-complex,BMMY)培养基1 L: 1%酵母浸出物,2%蛋白胨,100 mmol/L磷酸钾(pH 6.0),1.34% YNB,4×10%生物素,0.5%甲醇。
1.3 试剂与主要仪器实验中的各种试剂均为分析纯化学试剂;Bradford蛋白定量检测试剂盒购于生工生物工程(上海)股份有限公司。磷酸盐缓冲液(PBS)1 L:称取磷酸二氢钾0.2 g,磷酸氢二钠2.9 g,氯化钠8.0 g,氯化钾0.2 g,加水至1 L。100 mmol/L丙二酸-丙二酸钠缓冲液(pH 4.5): 准确称取1.660 4 g丙二酸钠,溶于100 mL水中;再称取1.040 6 g 丙二酸,溶于100 mL水中,将两种溶液按比例混合,控制pH值为4.5。
恒温震荡器(DHZ-Da,太仓市实验设备厂);高压均质机(AH-2010,意大利ATS牌);酶标仪(PowerWave XS,美国BioTek公司);分光光度计(UV1102,德国Eppendorf公司)。
1.4 重组毕赤酵母菌种培养及诱导产酶培养菌种培养:在无菌超净台中挑选重组毕赤酵母阳性单克隆,于YPD固体培养基上划线,置于28℃培养。3 d后,挑取单克隆接种到3 mL BMGY液体培养基中,28℃下125×g条件下培养过夜,次日以2%~4%的比例接种于BMGY液体培养基,继续培养至600 nm处的光密度值 (D600)=2~6。培养16~24 h后,倒入无菌离心管中,2 000×g 4℃离心10 min,倒去上清液,收集细胞沉淀。
诱导产酶培养:在无菌条件下,用BMMY培养基重悬酵母细胞沉淀,至D600=1。取50 mL置于250 mL的三角瓶中,加入血红素(终浓度1 mmol/L)和硫酸锰(终浓度0.5 mmol/L)进行诱导。每24 h补加1%甲醇,用培养48 h的发酵样品进行处理,测定其总蛋白浓度和酶活力。
1.5 重组毕赤酵母破壁提取蛋白及总蛋白浓度测定将诱导发酵液倒入离心管中,2 000×g 4℃离心10 min后,弃去上清液,收集细胞沉淀。再用5倍于菌体体积的PBS重悬沉淀,将悬浮液混匀。将高压均质机冷凝至4℃,在1 000 MPa的压力下均质破壁,循环5次。处理过的菌液于4℃ 2 000×g离心10 min,得到上清液,即为含rGlMnP的总蛋白。
先取10 μL蛋白标准品(5 mg/mL BSA)用PBS稀释至100 μL,终浓度为0.5 mg/mL。再次用PBS稀释配制成BSA浓度为0、10、20、40、60、80、100、150 μg/mL的标准品溶液。分别取20 μL上述浓度的标准品加入到96孔板中(每个做3组重复)。加入20 μL稀释一定倍数的待测样品到96孔板中。每孔加入Bradford染液200 μL,小心混匀(避免产生气泡,影响读数),室温下使其静置反应3~5 min。设置美国BioTek公司酶标仪,于595 nm处测定D值。绘制标准曲线,并计算出样品中的蛋白浓度。将实验中得到的蛋白稀释一定倍数,使其浓度处于标准曲线测量范围内。样品中蛋白质浓度(μg/mL)=稀释后样品的蛋白浓度×样品的稀释倍数。
1.6 rGlMnP的酶活力测定酶活力定义:1 min内催化1 μmol底物所需的酶液量为1个酶活单位(U)。取0.5 mL 100 mmol/L丙二酸-丙二酸钠缓冲液于1.5 mL的离心管中,加入0.1 mL 10 mmol/L 硫酸锰溶液。准确加入X μL(X=0~50)待测酶液,加入(400-X) μL无菌水,30℃水浴加热30 min。加入0.01 mL 10 mmol/L H2O2溶液启动反应,于270 nm处迅速测定D值,1 min后再测一次,二者之差即为1 min内的D270变化。rGlMnP的酶活力计算公式如下:
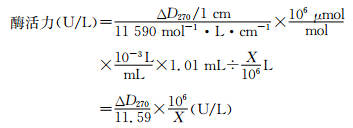
|
(1) |
其中,11 590 mol-1·L·cm-1为Mn3+与丙二酸形成的复合物在270 nm下的摩尔吸光系数。
1.7 重组毕赤酵母诱导高效产酶单因素优化pH条件优化:配制含有不同pH值(pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0)的0.1 mol/L磷酸钾缓冲液的BMMY培养基,每个pH值平行3份,诱导表达 48 h后破壁,测定其总蛋白浓度和rGlMnP的酶活力。
温度条件优化:将使用BMMY培养基重悬的菌体均分成6份,分别置于24、26、28、30、32℃摇床,每个温度平行3份,诱导表达48 h后破壁,测定其总蛋白浓度和rGlMnP的酶活力。
甲醇浓度优化:配制含有不同初始甲醇浓度(0.5%、1.0%、1.5%、2.0%)的BMMY培养基,每个浓度平行3份,每24 h添加一次甲醇,其浓度与各自初始浓度相同,诱导表达48 h后破壁,测定其总蛋白浓度和rGlMnP的酶活力。
血红素浓度优化:配制含有不同初始血红素浓度(0.5、1.0、1.5、2.0 mmol/L)的BMMY培养基,每个浓度平行3份,诱导表达48 h后破壁,测定其总蛋白浓度和rGlMnP的酶活力。
1.8 重组毕赤酵母诱导产酶酶活力响应曲面分析根据单因素实验分析,设定初始pH、温度、甲醇浓度以及血红素浓度4个因素。在此基础上,采用Box-Behnken中心组合原理进行4因素3水平的响应面设计实验,共29个实验组合。
1.9 数据分析实验采用Box-Behnken的中心组合实验设计,分析和作图软件使用Design-Expert 9.0软件。
1.10 模型的实验验证为检验模型的合理性和有效性,进行10组实验验证,每组重复3次,将得到的结果再用SPSS 17.0软件对数据进行相关性分析。
2 结 果 2.1 重组毕赤酵母诱导高效产酶单因素优化结果对重组毕赤酵母诱导产酶进行单因素实验,结果表明,在初始pH 5.5的条件下,rGlMnP的酶活力和总蛋白浓度都达到最高,分别为718.5 U/L和254.3 μg/mL;在温度为30℃诱导条件下酶活力最高,达到618.5 U/L,此时总蛋白浓度为248.8 μg/mL;在1.5%甲醇浓度诱导条件下,其酶活力最高达到574.6 U/L,此时总蛋白浓度为151.3 μg/mL;添加血红素浓度为1.0 mmol/L时,酶活力和总蛋白浓度都达到最高,分别为637. 5 U/L和137.8 μg/mL。
2.2 对重组毕赤酵母中rGlMnP的酶活力的响应面实验设计结果 2.2.1 实验因素水平编码与设计结果根据单因素实验分析结果,确定初始pH、温度、甲醇浓度以及血红素浓度4个因素均对rGlMnP的酶活力有一定的影响,而温度、甲醇浓度和血红素对总蛋白浓度影响不明显,因此不再考察总蛋白浓度。在此基础上,设计以上4个因素对毕赤酵母中rGlMnP的酶活力的相互影响实验,利用Box-Behnken中心组合方法设计4因素3水平的响应面实验。各因素和水平见表 1,实验设计与结果见表 2。
|
|
表 1 响应面的因素和水平 Tab 1 Factors and levels of response surface methodology |
|
|
表 2 响应面优化实验设计与结果 Tab 2 Experimental design and results of response surface methodology |
利用Design-Expert 9.0软件对Box-Behnken中心组合实验所得数据进行二次多项回归拟合,得到实验因子初始pH、温度(℃)、甲醇浓度(%)、血红素浓度(mmol/L)与响应值rGlMnP的酶活力之间的关系可用二次多项式回归方程表示:Y=707.38-53.38A+37.13B-6.28C-20.26D-3.92AB+20.32AC+8.07AD+15.85BC+3.48BD-1.03CD-32.86A2-31.38B2-24.10C2+5.81D2,回归模型方差分析见表 3。根据回归方差分析显著性检验,P<0.000 1表示该模型为回归显著型,其中P值越小,代表响应变量的显著程度越高。失拟误差为0.465 4>0.05,表明数据中的异常点不显著。复相关系数平方R2=0.966 8,表示响应值的96.68%变异分布于方程的14个因子中,仅3.32%的变异不能由该模型解释,说明回归方程的拟合程度较好。校正决定系数RAdj2=0.933 7,说明该模型与实际实验的拟合性较好,可以用于rGlMnP的酶活力实验预测。A、B、D、AC、BC、A2、B2及C2等因素在该模型中为显著指标。
|
|
表 3 回归模型方差分析 Tab 3 Variance analysis of regression model |
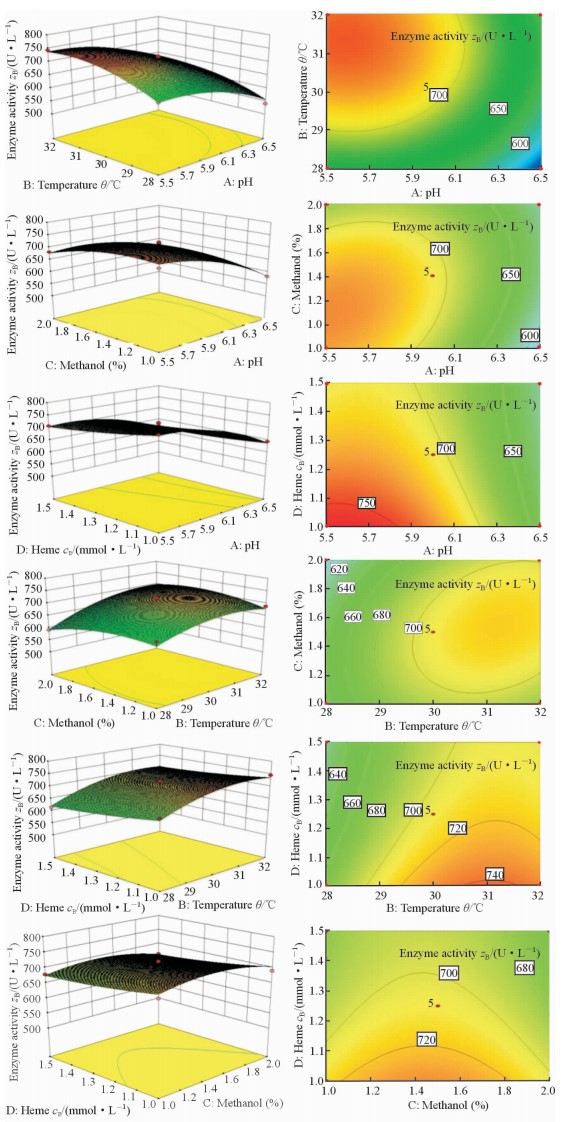
为进一步研究相关实验因子之间的交互关系,用软件做出初始pH、温度、甲醇浓度及血红素浓度对rGlMnP的酶活力影响的响应面分析图及等高线图(图 1)。交互作用的规律可从二维等高线图中看出,等高线密的方向,对应坐标表示的因素在交互作用中占主要地位。(1)交互作用AB中影响酶活力的主要方面是pH要提高酶活力,pH值应控制在5.5~6.0;pH值过高,酶活力降低。pH值一定时,一定范围内适当提高温度,酶活力增大。(2)交互作用AC中影响酶活力的主要方面是甲醇浓度。要提高酶活力,pH值要控制在5.5~6.0;pH值过高,酶活力会降低。甲醇浓度需要控制在1.4%~1.6%,甲醇浓度过高或过低,酶活力都会降低。(3)交互作用AD中影响酶活力的主要方面是血红素浓度。pH值和血红素浓度之间的交互作用不是很显著。要提高酶活力,pH值要控制在5.5~6.0;pH值过高,酶活力会降低。血红素浓度需要控制在1.2~1.4 mmol/L;血红素浓度过高或过低,酶活力都会降低。(4)交互作用BC中影响酶活力的主要方面是甲醇浓度。要提高酶活力,温度需要控制在29~31℃;温度过高或过低,酶活力都会变低。甲醇浓度要控制在1.4%~1.6%;甲醇浓度过高或过低,酶活力都会降低。(5)交互作用BD中影响酶活力的主要方面是血红素浓度。要提高酶活力,温度需要控制在29~31℃;温度过高或过低,酶活力都会降低。血红素浓度要控制在1.2~1.4 mmol/L; 血红素浓度过高或过低,酶活力都会降低。(6)交互作用CD中影响酶活力的主要方面是甲醇。要提高酶活力,甲醇浓度需要控制在1.4%~1.6%;甲醇浓度过高或过低,酶活力都会降低。血红素浓度要控制在1.2~1.4 mmol/L,血红素浓度过高或过低,酶活力都会降低。
|
图 1 实验4因子对rGlMnP的酶活力影响的响应面分析图和等高线图 Fig 1 Response surface plot and contour plot of the effects of 4 factors on the activity of rGlMnP |
2.2.2 模型的实验验证
为检验模型方程的可靠性,进行了10组验证实验 (表 4)。利用SPSS 17.0对表 4中的数据进行相关性分析,酶活力的实测值和预测值的相关系数为0.958,证明该方程模型有效。
|
|
表 4 模型的验证结果 Tab 4 Verified results of the model equation |
3 讨 论
毕赤酵母蛋白表达系统是20世纪80年代发展起来的一种真核表达系统,与其他表达系统相比,其优势在于具有强有力的醇氧化酶(alcohol oxidase,AOX1)基因启动子[15],该系统表达的外源蛋白还可进行翻译后修饰加工过程,比如蛋白水解过程、二硫键的形成以及糖基化修饰等[16]。由于毕赤酵母表达系统所具有的诸多优势使其研究价值和应用价值越来越广泛,已经成功表达了多种药用蛋白质和工业用酶[17] 。在药用蛋白的表达中,外源蛋白经过适度的糖基化修饰后,抗原性低,更适于临床应用[18-20]。在本研究中,rGlMnP在有机物降解方面的应用依赖于其酶活力,研究提高其酶活力至关重要[21]。为了降低传统方法的误差及缺陷,目前越来越多的研究者采用更加精密的计算软件及方法进行设计与实验。响应曲面法是一个非常好的生物学领域的应用工具,使得实验设计更周到与全面,实验结果更准确、可靠[22-23]。
先前文献中利用毕赤酵母生产外源蛋白的相关研究主要集中在选择表达宿主菌、表达载体及其元件(包括启动子、选择标记、信号肽序列),以及外源蛋白的表达及其影响因素(甲醇添加量、温度、初始pH、转速、装液量、接种量)等[17, 24],如Jiang等[25]研究了pH 值和温度对利用毕赤酵母生产重组MnP产量和稳定性的影响,认为pH 值为6、温度30℃时重组MnP的产量最高,pH值小于5.5时重组MnP的浓度则骤然下降。基于上述利用毕赤酵母生产MnP的报道及相关研究文献[26],本实验选择对温度、初始pH、甲醇浓度和血红素浓度进行优化,选择的初始pH区间为5.0~6.0,温度区间为28~32℃,甲醇浓度区间为1.0%~2.0%,血红素区间为0.5~1.5 mmol/L,在单因素实验的基础上,通过中心组合实验、响应曲面及等高线分析确定了主要影响因素的最佳含量。结果证明最优为初始pH 5.5、温度30℃、甲醇浓度1.5%、血红素浓度 1.0 mmol/L;在该培养条件下,预测rGlMnP最大酶活力为762.0 U/L。为检验模型方程的可靠性,本研究利用优化的条件进行了10组实验,应用SPSS分析验证实验数据,证明该实验方程模型有效。实验验证rGlMnP的酶活力为758.4 U/L,与预测结果基本一致。本实验为利用毕赤酵母生产其他药用蛋白提供了有益的参考。
| [1] | ZHOU X W, LIN J, YIN Y Z, ZHAO J Y, SUN X F, TANG K X. Ganodermataceae: natural products and their related pharmacological functions[J]. Am J Chin Med , 2007, 35 :559–574. DOI:10.1142/S0192415X07005065 |
| [2] | LÜ X, CHEN D, YANG L, ZHU N, LI J, ZHAO J, et al. Comparative studies on the immunoregulatory effects of three polysaccharides using high content imaging system[J]. Int J Biol Macromol , 2016, 86 :28–42. |
| [3] | YU Q, NIE S P, LI W J, ZHENG W Y, YIN P F, GONG D M, et al. Macrophage immunomodulatory activity of a purified polysaccharide isolated from Ganoderma atrum[J]. Phytother Res , 2013, 27 :186–191. DOI:10.1002/ptr.v27.2 |
| [4] | RUAN W, WEI Y, POPOVICH D G. Distinct responses of cytotoxic Ganoderma lucidum triterpenoids in human carcinoma cells[J]. Phytother Res , 2015, 29 :1744–1752. DOI:10.1002/ptr.v29.11 |
| [5] | RUAN W, LIM A H, HUANG L G, POPOVICH D G. Extraction optimisation and isolation of triterpenoids from Ganoderma lucidum and their effect on human carcinoma cell growth[J]. Nat Prod Res , 2014, 28 :2264–2272. DOI:10.1080/14786419.2014.938337 |
| [6] | WONG J H, NG T, CHEUNG R C, YE X, WANG H, LAM S, et al. Proteins with antifungal properties and other medicinal applications from plants and mushrooms[J]. App Microbiol Biotechnol , 2010, 87 :1221–1235. DOI:10.1007/s00253-010-2690-4 |
| [7] | HSIN I L, OU C C, WU M F, JAN M S, HSIAO Y M, LIN C H, et al. GMI, an immunomodulatory protein from Ganoderma microsporum, potentiates cisplatin-induced apoptosis via autophagy in lung cancer cells[J]. Mol Pharm , 2015, 12 :1534–1543. DOI:10.1021/mp500840z |
| [8] | U GIRJAL V, NEELAGUND S, KRISHNAPPA M. Ganoderma lucidum: a source for novel bioactive lectin[J]. Protein Pept Lett , 2011, 18 :1150–1157. DOI:10.2174/092986611797200986 |
| [9] | ZHOU X W, CONG W R, SU K Q, ZHANG Y M. Ligninolytic enzymes from Ganoderma spp: current status and potential applications[J]. Crit Rev Microbiol , 2013, 39 :416–426. DOI:10.3109/1040841X.2012.722606 |
| [10] | XU X, YAN H, CHEN J, ZHANG X. Bioactive proteins from mushrooms[J]. Biotechnol Adv , 2011, 29 :667–674. DOI:10.1016/j.biotechadv.2011.05.003 |
| [11] | HATAKKA A. Lignin-modifying enzymes fungi: production and role[J]. FEMS Microbiol Rev , 1994, 13 :125–135. DOI:10.1111/fmr.1994.13.issue-2-3 |
| [12] | WARIISHI H, AKILESWRAN L, GOLD M H. Manganese peroxidase from the basidiomycete Phanerochaete chrysosporium: spectral characterization of the oxidized states and the catalytic cycle[J]. Biochemistry , 1988, 27 :5365–5370. DOI:10.1021/bi00414a061 |
| [13] | ZHANG Y, XIE J, LIU M, TIAN Z, HE Z, VAN NOSTRAND J D, et al. Microbial community functional structure in response to antibiotics in pharmaceutical wastewater treatment systems[J]. Water Res , 2013, 47 :6298–6308. DOI:10.1016/j.watres.2013.08.003 |
| [14] | HUSAIN Q, QAYYUM S. Biological and enzymatic treatment of bisphenol A and other endocrine disrupting compounds: a review[J]. Crit Rev Biotechnol , 2013, 33 :260–292. DOI:10.3109/07388551.2012.694409 |
| [15] | CREGG J M, BARRINGER K J, HESSLER A Y, MADDEN K R. Pichia pastoris as a host system for transformations[J]. Mol Cell Biol , 1985, 5 :3376–3385. DOI:10.1128/MCB.5.12.3376 |
| [16] | NETT J H, COOK W J, CHEN M T, DAVIDSON R C, BOBROWICZ P, KETT W, et al. Characterization of the Pichia pastoris protein-O-mannosyltransferase gene family[J]. PLoS One , 2013, 8 :e68325. DOI:10.1371/journal.pone.0068325 |
| [17] | AHMAD M, HIRZ M, PICHLER H, SCHWAB H. Protein expression in Pichia pastoris: recent achievements and perspectives for heterologous protein production[J]. Appl Microbiol Biotechnol , 2014, 98 :5301–5317. DOI:10.1007/s00253-014-5732-5 |
| [18] | DE POURCQ K, DE SCHUTTER K, CALLEWAERT N. Engineering of glycosylation in yeast and other fungi: current state and perspectives[J]. Appl Microbiol Biotechnol , 2010, 87 :1617–1631. DOI:10.1007/s00253-010-2721-1 |
| [19] | GERNGROSS T U. Advances in the production of human therapeutic proteins in yeasts and filamentous fungi[J]. Nat Biotechnol , 2004, 22 :1409–1414. DOI:10.1038/nbt1028 |
| [20] | BOLLOK M, RESINA D, VALERO F, FERRER P. Recent patents on the Pichia pastoris expression system: expanding the toolbox for recombinant protein production[J]. Recent Pat Biotechnol , 2009, 3 :192–201. |
| [21] | GOH K M, GANESON M, SUPRAMANIAM C V. Infection potential of vegetative incompatible Ganoderma boninense isolates with known ligninolytic enzyme production[J]. Afr J Biotechnol , 2015, 13 :1056–1066. |
| [22] | PADMA N, SUDHA H. Optimization of lignin peroxidase, manganese peroxidase, and lac production from Ganoderma lucidum under solid state fermentation of pineapple leaf[J]. Bioresources , 2013, 8 :250–271. |
| [23] | KHURI A I, MUKHOPADHYAY S. Response surface methodology[J]. Wiley Interdiscip Rev Comput Stat , 2010, 2 :128–149. DOI:10.1002/wics.v2:2 |
| [24] | MACAULEY-PATRICK S, FAZENDA M L, MCNEIL B, HARVEY L M. Heterologous protein production using the Pichia pastoris expression system[J]. Yeast , 2005, 22 :249–270. DOI:10.1002/(ISSN)1097-0061 |
| [25] | JIANG F, KONGSAEREE P, SCHILKE K, LAJOIE C, KELLY C. Effects of pH and temperature on recombinant manganese peroxidase production and stability[J]. Appl Biochem Biotechnol , 2008, 146 (1-3) :15–27. DOI:10.1007/s12010-007-8039-5 |
| [26] | JIANG F, KONGSAEREE P, CHARRON R, LAJOIE C, XU H, SCOTT G, et al. Production and separation of manganese peroxidase from heme amended yeast cultures[J]. Biotechnol Bioeng , 2008, 99 :540–549. DOI:10.1002/(ISSN)1097-0290 |
 2016, Vol. 37
2016, Vol. 37


