静电纺丝(电纺)技术是目前支架结构的新兴技术,应用该技术制造的纳米纤维支架具有较大的比表面积和较高的孔隙率,不但有利于生长因子、酶等生物大分子的吸附,还有利于细胞的附着和铺展,以及细胞和微环境之间的物质交换[1-2]。聚乳酸-乙醇酸聚合物[poly(D, L-lactide-co-glycolide),PLGA]具有良好的生物相容性和可降解性[3],是制造细胞支架的理想材料。嗅鞘细胞(olfactory ensheathing cells,OECs)是来源于嗅上皮基底膜的神经胶质细胞,其分布区域位于嗅神经和嗅球,可分泌多种神经营养因子和神经细胞黏附因子,具有帮助损伤神经元存活、促进轴突再生和髓鞘化的作用,在神经再生中扮演着重要角色[4-5]。将OECs种植于应用电纺技术制作的PLGA材料中可能会加强其体内移植对神经损伤的修复能力。但目前电纺PLGA膜与OECs的生物相容性仍然未知,本研究拟将OECs接种于电纺PLGA膜上,观察两者的生物相容性。
1 材料和方法 1.1 实验动物与试剂雄性成年SD大鼠,体质量120 g的2只和200 g的10只,由长海医院实验中心动物房提供[许可证号:SYXK(沪)2015-0017];3D打印复合静电纺丝PLGA膜由上海大学快速制造工程中心提供;DMEM/F12培养基、胎牛血清(FBS)和双抗购自美国HyClone公司;p75NGFR抗体购自美国Millipore公司;4, 6-联脒-2-苯基吲哚(DAPI)染料、多聚赖氨酸(PLL)购自谷歌生物科技有限公司;CFDA SE细胞增殖与示踪检测试剂盒购自上海碧云天生物技术有限公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、腺苷酸环化酶激活剂(forskolin)与戊巴比妥钠购自美国Sigma公司。
1.2 原代OECs的培养及纯化取120 g雄性SD大鼠,5%CO2窒息,75%乙醇消毒,断头后置于100 mm培养皿中,无菌条件下分离双侧嗅球,置于D-Hank’s解剖液中。镜下剥去嗅球表面血管膜,钳取嗅球表面呈束状排列的薄层透明组织,放入另一盛有少量解剖液的培养皿中。用眼科弯剪将嗅球碎成1 mm3的组织块,加入等量0.125%胰酶,于5% CO2、37℃培养箱中消化30 min。于超净台中加入含15% FBS的培养液中止消化。200×g离心5 min,弃上清后加入培养液,吹打混匀成单细胞悬液后静置5 min。吸取上清至不涂胶的T25培养瓶中,加双抗50 μL,置于37℃、5%CO2培养箱中培养36 h后将细胞悬液转移至另一培养瓶中,再培养36 h后将细胞接种于PLL涂板的6孔板中。加入bFGF至终浓度为10 ng/mL,加入forskolin至终浓度为2 μmol/L。24 h后更换含15%FBS的培养液,之后每2 d换液一次。培养至第10天时取部分OECs,用p75NGFR特异性抗体作免疫荧光染色鉴定纯度。
1.3 电纺PLGA膜上OECs的细胞形态与分布使用前将电纺PLGA膜紫外消毒1 h,之后加入含15%FBS的培养液2 mL与双抗50 μL,置于37℃、5%CO2培养箱中培养24 h后吸去培养液,以1.5×105 /mL的细胞密度将纯化OECs悬液接种于电纺PLGA膜上,加入1.5 mL 15%FBS培养液,24 h后补满培养液至2 mL。之后每2 d换液一次。共培养至5 d后使用p75NGFR特异性抗体作免疫荧光染色,观察电纺PLGA膜上OECs的细胞形态与分布。
1.4 CFDA SE荧光染色检测电纺PLGA膜上OECs的增殖情况用1 mL CFDA SE细胞标记液悬浮1×106个细胞,置于15 mL离心管内,再加入1 mL CFDA SE存储液(2X),轻轻混匀。37℃孵育10 min后立即在15 mL离心管内加入10 mL含15% FBS的培养液,室温颠倒数下混匀。200×g离心5 min,弃上清液,再加入5 mL含15% FBS的细胞培养液,37℃孵育5 min,200×g离心5 min后弃上清。加入含15%FBS的培养液吹打混匀,接种于电纺PLGA膜(PLGA组)与PLL包被(对照组)的6孔板中,并于培养1、2、3、4、5 d时分别行荧光下细胞计数,每次取10个10×20视野计数。
1.5 电纺PLGA膜与大鼠的生物相容性检测将200 g大鼠分为2组,假手术组与膜植入组,每组5只。膜植入组大鼠以3%戊巴比妥钠0.3 mL/100 g(体质量)腹腔注射麻醉,手术显露前列腺部位,将电纺PLGA膜裁剪为合适大小,3-0线缝合于前列腺上,逐层缝合。假手术组大鼠显露前列腺部位后直接关腹。术后每周观察大鼠的生存状态,1个月后解剖大鼠查看电纺PLGA膜在大鼠体内的局部情况。
1.6 统计学处理使用SPSS 20.0统计软件进行分析,计量数据以x±s表示。两组每日OECs增殖差异比较采用t检验,总体比较采用重复测量单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 OECs的纯度鉴定大鼠OECs体外培养10 d后呈现双极和多突起形态。取OECs用p75NGFR特异性抗体作免疫荧光染色(红)和DAPI复染(蓝),结果发现90%以上细胞免疫反应呈阳性(图 1)。结合形态分析可推断OECs的细胞纯度大于90%。
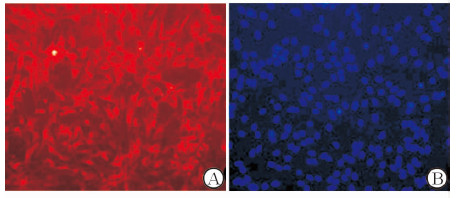
|
图 1 体外培养OECs的纯度鉴定 Fig 1 Purity identification of OECs in vitro |
2.2 电纺PLGA膜上OECs的细胞形态学观察
相差显微镜(DMIL,Leica)下观察消化完毕后接种于电纺PLGA膜上的OECs,可见OECs散落在纳米纤维包绕的孔隙中,分布均匀,细胞状态良好(图 2A)。接种24 h后,细胞黏附于电纺PLGA膜孔隙中的纳米纤维上,沿纤维排列,立体排布,细胞伸出短小突起沿纳米纤维分布,并向外围生长;且细胞形态清楚,立体感强,透亮度好(图 2B)。接种后第5天行p75NGFR染色和DAPI复染可见大量细胞附着于电纺PLGA膜的细胞生长支架上,且电纺PLGA膜支撑支架上的单层结构中可见少量OECs状态良好,呈线状排列,并依附于纳米纤维分布(图 2C、2D)。
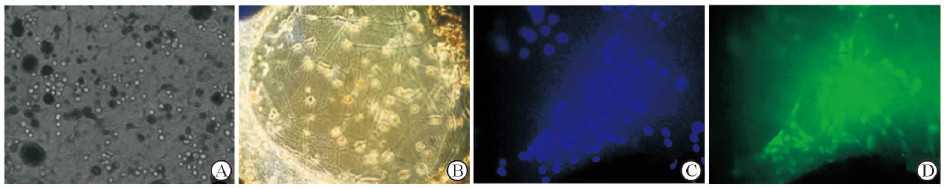
|
图 2 电纺PLGA膜上OECs的细胞形态学观察 Fig 2 Morphological observation of OECs on the PLGA membrane |
2.3 电纺PLGA膜上OECs的增殖情况
将CFDA SE染色的OECs种植于电纺PLGA膜上并动态观察OECs的生长情况,结果发现,接种后1~5 d内PLGA组电纺PLGA膜上OECs的细胞数目与对照组相比差异均无统计学意义(P>0.05,表 1)。单因素方差分析结果显示5 d内两组总体比较差异仍无统计学意义(P=0.791)。
|
|
表 1 电纺PLGA膜上OECs的细胞数目与对照组贴壁细胞数目比较 Tab 1 Cell counts of OECs on the membrane of PLGA and control groups |
2.4 电纺PLGA膜与大鼠的生物相容性
未植入体内的电纺PLGA膜如图 3A所示。在整个观察期间假手术组与膜植入组均无手术鼠死亡;同时大鼠腹腔切口无红肿溃烂,所有大鼠无明显不适。术后4周时解剖可见电纺PLGA膜覆盖于前列腺上,表层被透明筋膜覆盖,膜结构部分降解(图 3B)。
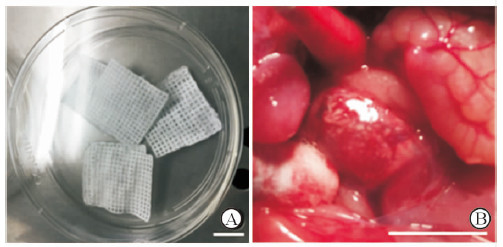
|
图 3 电纺PLGA膜在大鼠体内的降解情况 Fig 3 The degradation of PLGA membrane in vivo |
3 讨论
神经损伤修复是困扰临床医务工作者的一大难题,而组织工程学的发展为这一难题的解决提供了良好的应用前景。理想的组织工程化神经移植物有两个关键因素,即拥有活力的种子细胞和可与组织良好相容的支架材料。本实验选取的种子细胞OECs是嗅神经系统特有的神经胶质细胞,能帮助损伤神经元存活、促进轴突再生和髓鞘化,在神经损伤修复中具有重要作用。此外,OECs的来源并不仅限于嗅球,还可以从自体嗅黏膜中取材,具有取材方便、损伤轻微的优点,因此OECs在神经损伤修复领域被广泛应用并取得了良好效果[6]。马玉海等[7]应用硅胶管负载OECs成功修复鼠坐骨神经切断损伤,但其载体材料的不可吸收性及长期存留可能导致的异物反应和神经挤压限制了其实际应用。本实验选用电纺PLGA膜作为支架材料,组织相容性较好,局部移植后大鼠无死亡,伤口也均未发生炎症反应;开腹后可见PLGA膜与周围组织融合,对局部组织起到保护与防止粘连的作用,并发生了一定的降解,体现了电纺PLGA膜良好的神经损伤修复潜力。
目前研究大多采用导管作为细胞支架来进行周围神经缺损修复[8]。而在因牵拉、挤压而造成的神经损伤方面,膜结构的细胞支架可覆盖在受损神经段上,相比导管结构更加符合神经损伤修复要求。崔颖等[9]和矫树生等[10]的研究验证了冻融工艺制作的PLGA膜与OECs的相容性,Piao等[3]成功应用脂肪干细胞与脑源性神经因子复合PLGA膜治疗海绵体钳夹损伤。但传统冻融工艺制造的PLGA膜支架孔径较大,细胞容易出现孔内团聚现象,不利于细胞的生长。此外,冻融制造的支架附着力较差,且细胞在冻融膜上仍为二维生长,而体内的组织为三维生长,无法达到立体化的修复要求。相较于传统的冻融工艺,电纺技术制作的纳米纤维支架直径较小,故而具有较大的比表面积;同时其孔径由纳米纤维包绕而形成,大小可调,能根据细胞尺寸进行针对性的匹配,最终形成类似于天然细胞外基质构成的立体网状结构;这样的结构可以为细胞黏附提供大量附着点,并且可设定纳米纤维贯穿其中,诱导神经细胞沿纳米纤维方向定向生长[1, 11]。本实验通过镜下观察电纺PLGA膜上的细胞形态,直观了解细胞的黏附、增殖、分布和定向生长情况,进而分析OECs与电纺PLGA膜的生物相容性。p75NGFR可特异性的标识神经细胞,通过免疫荧光染色鉴定后观察发现OECs在电纺PLGA膜上的黏附良好,细胞状态佳;且OECs可特异性的沿纳米纤维方向生长,为神经修复建立了良好的导向性。此外,因为良好的神经修复移植物需要一定力学强度来保证膜结构的完整,所以该电纺PLGA膜设计成了四角支撑结构,支撑结构通光性较差,故本实验通过CFDA SE荧光染色光镜计数来分析电纺PLGA膜上细胞的增殖情况。电纺PLGA膜具有良好的立体孔隙结构,其细胞黏附与增殖能力和对照组相比差异无统计学意义,说明电纺PLGA膜能为OECs提供良好的生长环境。
综上所述,采用电纺技术制作的纳米纤维结构PLGA膜具有高孔隙率及孔径可调的三维网状结构,能为OECs的黏附提供优异的附着点,并可诱导OECs定向生长;且该电纺PLGA膜具有良好的生物相容性、可控的降解性和可吸收性,OECs在其膜上的黏附和增殖状况良好。此外,该电纺PLGA膜参入了碳纳米管材料作为支撑结构,可达到接近软骨的力学强度,在移植过程中不易损坏,能为损伤神经提供良好的保护作用。OECs-电纺PLGA膜复合物有望成为神经损伤修复的理想神经移植物。
| [1] | 何凤利, 何进, 尹大川. 静电纺丝制备组织工程支架的研究进展[J]. 材料导报 , 2014, 28 :1–7. |
| [2] | XIN X, HUSSAIN M, MAO J J. Continuing differentiation of human mesenchymal stem cells and induced chondrogenic and osteogenic lineages in electrospun PLGA nanofiber scaffold[J]. Biomaterials , 2007, 28 :316–325. DOI:10.1016/j.biomaterials.2006.08.042 |
| [3] | PIAO S, KIM I G, LEE J Y, HONG S H, KIM S W, HWANG T K, et al. Therapeutic effect of adipose-derived stem cells and BDNF-immobilized PLGA membrane in a rat model of cavernous nerve injury[J]. J Sex Med , 2012, 9 :1968–1979. DOI:10.1111/j.1743-6109.2012.02760.x |
| [4] | CAO L, LIU L, CHEN Z Y, WANG L M, YE J L, QIU H Y, et al. Olfactory ensheathing cells genetically modified to secrete GDNF to promote spinal cord repair[J]. Brain , 2004, 127 (Pt 3) :535–549. |
| [5] | PELLITTERI R, RUSSO A, STANZANI S, ZACCHEO D. Olfactory ensheathing cells protect cortical neuron cultures exposed to hypoxia[J]. CNS Neurol Disord Drug Targets , 2015, 14 :68–76. DOI:10.2174/1871527314666150116121105 |
| [6] | ZHU Y, CAO L, SU Z, MU L, YUAN Y, GAO L, et al. Olfactory ensheathing cells: attractant of neural progenitor migration to olfactory bulb[J]. Glia , 2010, 5 :716–729. |
| [7] | 马玉海, 张勇, 曹莉, 张少成, 侯铁胜, 何成. 嗅鞘细胞-胶质细胞源性神经营养因子基因工程细胞移植对坐骨神经再生的作用[J]. 中华实验外科杂志 , 2004, 21 :17–19. |
| [8] | 矫树生, 陈建梅, 游华, 李兵仓. 嗅鞘细胞复合PLGA导管修复周围神经缺损的研究[J]. 现代生物医学进展 , 2007, 7 :494–498. |
| [9] | 崔颖, 崔志明, 徐冠华, 王玲玲, 孙郁雨, 储惊蛰. PLGA与大鼠嗅鞘细胞的生物相容性研究[J]. 组织工程与重建外科杂志 , 2011, 7 :80–84. |
| [10] | 矫树生, 李兵仓, 陈建梅, 游华. 嗅鞘细胞与聚乳酸-聚羟基乙酸共聚物材料的细胞相容性研究[J]. 第三军医大学学报 , 2008, 30 :370–373. |
| [11] | JOSE M V, THOMAS V, JOHNSON K T, DEAN D R, NYAIRO E. Aligned PLGA/HA nanofibrous nanocomposite scaffolds for bone tissue engineering[J]. Acta Biomater , 2009, 5 :305–315. DOI:10.1016/j.actbio.2008.07.019 |
 2016, Vol. 37
2016, Vol. 37


