喉癌是常见的头颈部恶性肿瘤,其发病率逐年攀升。尽管近年来喉癌手术技术已有明显提高,放疗以及化疗新药物的不良反应也更小,但是术后复发喉癌的死亡率并未见明显降低[1]。因此,在现有治疗方式的基础上寻找新的治疗方法及药物尤为重要。
叉头框蛋白M1(forkhead box protein M1,FoxM1)是Fox转录因子家族的一员,其在肝癌[2]、乳腺癌[3]、肺癌[4-6]、胃癌[7]、宫颈癌[8]和卵巢癌[9]等多种肿瘤中呈现高表达,参与肿瘤的发生和发展。盐屋霉素A是一种噻唑类抗生素,可抑制FoxM1的转录活性和下调其表达,从而抑制如肝癌细胞、白血病细胞等肿瘤细胞的增殖,促进如骨肉瘤细胞等肿瘤细胞的凋亡[10]。本课题组前期研究发现FoxM1在喉癌组织中高表达,而在正常喉鳞状上皮组织中低表达,表明FoxM1在喉癌的发生、发展中可能具有重要作用[11]。目前对于盐屋霉素A下调FoxM1对喉癌细胞增殖、凋亡、侵袭的影响尚未见研究报道,本研究将探讨盐屋霉素A下调FoxM1表达对喉癌细胞恶性生物学行为的影响。
1 材料和方法 1.1 主要材料与试剂人喉癌细胞株Hep-2购于中国典型培养物保藏中心。盐屋霉素A、Matrigel基质胶购于美国Sigma公司。Transwell小室购于美国BD公司。CFSE试剂盒购于东仁化学科技(上海)有限公司。FoxM1兔抗人多克隆抗体购于美国Abgent公司。Ki-67、cleaved caspase-3兔抗人多克隆抗体购于美国Immunoway公司。GAPDH兔抗人多克隆抗体购于杭州华安生物技术有限公司。基质金属蛋白酶(MMP)-2、MMP-9 ELISA试剂盒购于武汉基因美生物科技有限公司。
1.2 CCK-8法检测盐屋霉素A对Hep-2细胞活力的影响Hep-2细胞置于含10%胎牛血清的RPMI 1640培养液中,37℃、5% CO2孵箱内培养至对数生长期,用0.25%胰蛋白酶消化细胞,以5×104/mL的密度将细胞接种于96孔板中,每孔100 μL。然后每孔分别加入含不同浓度盐屋霉素A的RPMI 1640培养液10 μL,使盐屋霉素A的终浓度分别为0.25、0.5、1、1.3、1.5、2 μmol/L,每组设3个复孔。同时设阴性对照组和空白对照组,阴性对照组只加培养液和细胞,空白对照组只加培养液。将培养板置入37℃、5% CO2培养箱中继续培养。在培养24、48、72 h时分别取出培养板,每孔加入10 μL CCK-8试剂,37℃继续培养2 h后终止反应。酶标仪(型号680,美国Bio-Rad公司)测定450 nm波长下各孔的光密度(D)值。实验重复3次。按公式计算细胞活力:细胞活力(%)=(D实验组-D空白组)/ (D对照组-D空白组)×100%
1.3 CFSE法检测盐屋霉素A对Hep-2细胞增殖的影响当Hep-2细胞呈对数生长时,用0.25%胰蛋白酶消化细胞,以3×105/孔的密度将细胞接种于6孔板中。待细胞生长过夜后弃培养液,每孔分别加入含盐屋霉素A的RPMI 1640培养液,使盐屋霉素A的终浓度分别为1.3、1.5 μmol/L,对照组不加盐屋霉素A。继续培养细胞,在24、48 h时分别取出培养板,收集细胞制备成细胞悬液,PBS调整细胞密度至约106/mL。 取1 mL细胞悬液于试管中,加入适量CFSE工作液(CFSE终浓度为 5 μmol/L),轻轻搅拌混匀。37℃培养箱中培养 15~30 min。 离心后去上清,加入 2 mL PBS,再离心后去上清,重复操作一次。沉淀加入1 mL的PBS制成细胞悬液,用流式细胞仪(美国BD公司)检测各孔荧光强度。
1.4 Annexin Ⅴ-FITC/PI双染法检测盐屋霉素A对Hep-2细胞凋亡的影响当Hep-2细胞呈对数生长时,用0.25%胰蛋白酶消化细胞,以3×105/孔的密度将细胞接种于6孔板中。待细胞生长过夜后弃培养液,每孔分别加入含盐屋霉素A的RPMI 1640培养液,使盐屋霉素A的终浓度分别为1.3、1.5 μmol/L,对照组不加盐屋霉素A。继续培养细胞,在48 h时取出培养板收集细胞,制备成细胞悬液;离心后去上清,加入2 mL PBS,再离心后去上清。用预冷1×PBS(4℃)重悬细胞一次,2 000×g离心5~10 min,洗涤细胞。加入300 μL的1×结合缓冲液悬浮细胞。加入5 μL的Annexin Ⅴ-FITC混匀后,避光,室温孵育15 min。上机前5 min 再加入5 μL的PI染色。上机前补加200 μL的1×结合缓冲液,最后用流式细胞仪检测。
1.5 Transwell小室法检测盐屋霉素A对Hep-2细胞侵袭能力的影响在24孔板中放入Transwell小室,小室滤膜上平铺一层RPMI 1640基底膜基质胶(1∶5稀释)40 μL,经紫外线消毒过夜后以无血清RPMI 1640培养液湿润上室。上室种入400 μL细胞密度为2×104单细胞悬液,实验组细胞分别为1.3、1.5 μmol/L盐屋霉素A作用48 h后,对照组不含盐屋霉素A;下室加入600 μL含20%胎牛血清的RPMI 1640培养液。每组设3个复孔,培养24 h后取出所有小室。用棉签小心擦除上室未穿膜的细胞与基质胶,多聚甲醛固定15 min,苏木精染色10 min。 自来水洗10 min,蒸馏水洗10 s,剥离滤膜后正面朝下固定于载玻片上,显微镜下观察并计数穿过室膜的细胞。
1.6 蛋白质印迹法检测FoxM1、Ki-67、cleaved caspase-3蛋白的表达Hep-2细胞经0、1.3、1.5 μmol/L盐屋霉素A作用48 h后提取总蛋白,BCA法测定蛋白浓度后按每孔40 μg上样,行SDS-PAGE 。湿法转膜将蛋白转印至PVDF膜上。5%脱脂奶粉(溶于1×TBST) 室温封闭1 h,分别加入FoxM1(1∶2 000)、Ki-67(1∶2 000)、cleaved caspase-3 (1∶2 000)、GAPDH ( 1∶4 000) 一抗孵育。4℃过夜,TBST洗3次,每次5 min。分别加入相应二抗室温孵育1 h,TBST洗3次,每次5 min。最后加入ECL 发光液孵育,暗室发光,用凝胶成像分析系统(美国Bio-Rad 公司)检测各条带灰度值并定量。
1.7 ELISA法检测MMP-2、MMP-9蛋白的表达取Hep-2细胞随机分为实验组与对照组,待细胞融合度为50%时实验组加入1.5 μmol/L盐屋霉素A,对照组不加盐屋霉素A,孵育48 h后收集细胞上清,按照MMP-2、MMP-9 ELISA试剂盒操作说明检测细胞上清中MMP-2、MMP-9蛋白的表达。
1.8 统计学处理采用SPSS 13.0软件包对数据进行统计分析,计量资料以x±s表示,组间比较采用t检验。检验水准(α)为0.05。
2 结 果 2.1 盐屋霉素A对Hep-2细胞FoxM1表达水平的影响采用蛋白质印迹法检测不同浓度盐屋霉素A作用Hep-2细胞48 h后对细胞FoxM1蛋白表达的影响。结果(图 1)显示,1.3、1.5 μmol/L盐屋霉素A作用后FoxM1蛋白的表达量(0.04±0.01、0.04±0.02)低于0 μmol/L盐屋霉素A作用后FoxM1的表达量(0.46±0.07),差异具有统计学意义(P<0.05)。

|
图 1 不同浓度盐屋霉素A作用后Hep-2细胞FoxM1蛋白的表达水平 Fig 1 Protein expression of FoxM1 in Hep-2 cells after treatment with different doses of siomycin A |
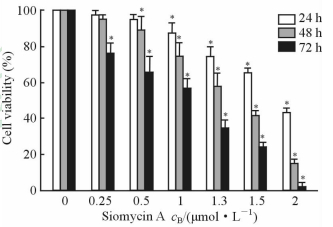
2.2 盐屋霉素A对Hep-2细胞活力的影响
采用CCK-8法检测盐屋霉素A对Hep-2细胞活力的影响,结果(图 2)发现,浓度为0.25~2 μmol/L的盐屋霉素A作用72 h后,均能抑制Hep-2细胞的活力(P<0.05),而浓度为0.5~2 μmol/L的盐屋霉素A作用48 h后即可抑制Hep-2细胞的活力(P<0.05)。此外,随着作用时间的延长,同一浓度盐屋霉素A对Hep-2 细胞活力的抑制作用更强;而当作用时间相同时,随着盐屋霉素A浓度的增加其对细胞活力的抑制作用也更强,表明盐屋霉素A对Hep-2细胞活力的影响呈现浓度和时间依赖性。
|
图 2 不同浓度盐屋霉素A作用后Hep-2细胞的活力 Fig 2 Viability of Hep-2 cells after treatment with different doses of siomycin A |
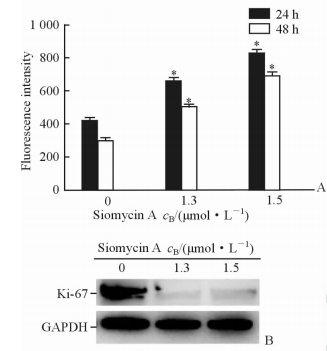
2.3 盐屋霉素A对Hep-2细胞增殖的影响
采用CFSE染色检测盐屋霉素A对Hep-2细胞增殖的影响,结果(图 3A)显示,与对照组相比,1.3、1.5 μmol/L盐屋霉素A处理组Hep-2细胞荧光强度的衰减程度均降低(P<0.05),并呈现浓度依赖性。表明盐屋霉素A可以抑制Hep-2细胞的增殖分裂。进一步检测盐屋霉素A作用Hep-2细胞后增殖标志性蛋白Ki-67的表达变化。结果(图 3B)发现,1.3、1.5 μmol/L盐屋霉素A作用后Ki-67蛋白的表达量(0.06±0.02、0.05±0.04)显著低于0 μmol/L盐屋霉素A作用后的表达量(1.08±0.21),差异具有统计学意义(P<0.05)。提示盐屋霉素A可能通过下调Ki-67抑制Hep-2细胞增殖。
|
图 3 盐屋霉素A作用后Hep-2细胞的增殖能力和Ki-67蛋白的表达变化 Fig 3 Proliferation ability of Hep-2 cells and protein expression of Ki-67 after treatment with siomycin A |
2.4 盐屋霉素A对Hep-2细胞凋亡的影响
采用Annexin Ⅴ-FITC/PI双染法检测盐屋霉素A对Hep-2细胞凋亡的影响。结果(图 4A)显示(为更直接体现药物对凋亡的影响,在此仅列出其中一次的凋亡结果),经1.3、1.5 μmol/L盐屋霉素A作用48 h 后,Hep-2细胞的凋亡率分别为10.60%和27.90 %,均高于对照组(4.91%);且盐屋霉素A作用呈现药物浓度依赖性。进一步检测凋亡相关蛋白cleaved caspase-3的表达变化,结果(图 4B)发现,1.3、1.5 μmol/L盐屋霉素A作用后cleaved caspase-3蛋白的表达量(0.44±0.12、0.48±0.18)显著高于对照组(0.12±0.05),差异具有统计学意义(P<0.05)。

|
图 4 盐屋霉素A作用后Hep-2细胞的凋亡情况和cleaved caspase-3蛋白的表达变化 Fig 4 Apoptosis of Hep-2 cells and the protein expression of cleaved caspase-3 after treatment with siomycin A |
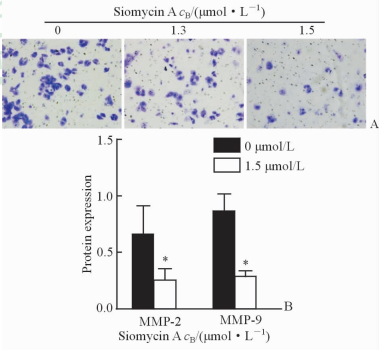
2.5 盐屋霉素A对Hep-2细胞侵袭能力的影响
采用Transwell小室法检测盐屋霉素A对Hep-2细胞侵袭能力的影响,显微镜下观察发现,1.3、1.5 μmol/L盐屋霉素A处理组Hep-2细胞的侵袭能力较对照组均下降(P<0.05);且随着盐屋霉素A浓度的增加,穿膜细胞数逐渐下降(图 5A)。实验结果提示盐屋霉素A可能通过下调FoxM1表达抑制喉癌Hep-2细胞侵袭能力。进一步检测侵袭相关蛋白MMP-2、MMP-9的表达变化,结果(图 5B)显示,1.5 μmol/L盐屋霉素A处理后MMP-2和MMP-9蛋白的表达水平均低于对照组(P<0.05)。
|
图 5 盐屋霉素A作用后Hep-2细胞的侵袭能力和MMP-2、MMP-9蛋白的表达变化 Fig 5 Invasion ability of Hep-2 cells and protein expression of MMP-2 and MMP-9 after treatment with siomycin A |
3 讨 论
FoxM1在细胞周期进程中起着重要调控作用,在增殖和凋亡受抑制的细胞中表达增加,FoxM1功能的缺失可使细胞分化受到抑制,最终导致分化不良细胞的恶性转变[12]。FoxM1在多种肿瘤中高表达,近年来越来越多研究发现FoxM1基因是治疗肿瘤的极具潜力的重要靶点,其抑制剂盐屋霉素A有望成为新型肿瘤治疗药物[13]。本课题组前期研究发现FoxM1在人喉癌组织中高表达,而在正常喉鳞状上皮组织中低表达,对喉癌的发生和发展中起着重要作用[11]。本研究进一步探讨了盐屋霉素A下调FoxM1后对喉癌细胞生物学行为的影响。
Bhat等[10]研究发现盐屋霉素A可显著抑制白血病细胞和肝癌细胞增殖。本研究通过CFSE法检测盐屋霉素A对Hep-2细胞增殖的影响,结果同样发现盐屋霉素A可抑制喉癌Hep-2细胞增殖,作用呈浓度依赖性。且增殖标志性蛋白Ki-67在经盐屋霉素A作用后表达量也下调,表明盐屋霉素A下调FoxM1表达可抑制喉癌Hep-2细胞增殖。
有研究发现,盐屋霉素A可促进白血病细胞和肝癌细胞凋亡[10]。而本研究同样发现盐屋霉素A促进了Hep-2细胞的凋亡,作用呈现浓度依赖性。此外,经盐屋霉素A作用后,凋亡标志蛋白caspase-3激活,表明盐屋霉素A下调FoxM1后可促进喉癌细胞凋亡,其机制可能是通过激活caspase-3发挥作用。
Jiang等[14]研究显示,下调FoxM1表达能抑制鼻咽癌细胞侵袭转移,其机制可能是通过下调MMP-2、MMP-9表达。也有研究发现FoxM1可上调骨肉瘤细胞中MMP-2、MMP-9表达,FoxM1可直接激活MMP-2启动子,通过小干扰RNA下调FoxM1可抑制MMP-2启动子的激活[15-16]。本研究发现盐屋霉素A作用Hep-2细胞后穿膜细胞数明显减少,作用并呈现浓度依赖性,提示盐屋霉素A可能抑制喉癌Hep-2细胞的侵袭能力。本实验也检测了Hep-2细胞MMP-2、MMP-9蛋白的表达变化,发现经盐屋霉素A作用后MMP-2、MMP-9蛋白的表达水平均下降。表明FoxM1可直接或间接作用于MMP-2和MMP-9,推测盐屋霉素A下调FoxM1可能也直接下调了MMP-2和间接下调了MMP-9,从而抑制了Hep-2的侵袭转移能力。
综上所述,本研究发现盐屋霉素A下调FoxM1可抑制喉癌Hep-2细胞增殖,促进其凋亡,抑制其侵袭能力。但值得一提的是,目前国外有文献报道,盐屋霉素A不仅通过下调FoxM1,也部分通过下调母系胚胎亮氨酸拉链蛋白激酶(MELK)蛋白的表达来抑制脑肿瘤干细胞的增殖[17]。因此,盐屋霉素A除主要通过下调FoxM1表达,可能也部分通过调控其他蛋白来达到抑制喉癌恶性生物学行为的目的,有待进一步深入探讨。
| [1] | 崔朝阳.喉癌及复发癌微卫星杂合性丢失的研究[D].济南: 山东大学,2011. |
| [2] | XIA L, HUANG W, TIAN D, ZHU H, ZHANG Y, HU H, et al. Upregulated FoxM1 expression induced by hepatitis B virus X protein promotes tumor metastasis and indicates poor prognosis in hepatitis B virus-related hepatocellular carcinoma[J]. J Hepatol , 2012, 57 :600–612. DOI:10.1016/j.jhep.2012.04.020 |
| [3] | PARK Y Y, JUNG S Y, JENNINGS N B, RODRIGUEZ-AGUAYO C, PENG G, LEE S R, et al. FOXM1 mediates Dox resistance in breast cancer by enhancing DNA repair[J]. Carcinogenesis , 2012, 33 :1843–1853. DOI:10.1093/carcin/bgs167 |
| [4] | GUO X, LIU A, HUA H, LU H, ZHANG D, LIN Y, et al. Siomycin A induces apoptosis in human lung adenocarcinoma A549 cells by suppressing the expression of FoxM1[J]. Nat Prod Commun , 2015, 10 :1603–1606. |
| [5] | KONG F F, QU Z Q, YUAN H H, WANG J Y, ZHAO M, GUO Y H, et al. Overexpression of FOXM1 is associated with EMT and is a predictor of poor prognosis in non-small cell lung cancer[J]. Oncol Rep , 2014, 31 :2660–2668. |
| [6] | LIU Y, CHEN X, GU Y, ZHU L, QIAN Y, PEI D, et al. FOXM1 overexpression is associated with cisplatin resistance in non-small cell lung cancer and mediates sensitivity to cisplatin in A549 cells via the JNK/mitochondrial pathway[J]. Neoplasma , 2015, 62 :61–71. DOI:10.4149/neo_2015_008 |
| [7] | DIBB M, HAN N, CHOUDHURY J, HAYES S, VALENTINE H, WEST C, et al. FOXM1 and polo-like kinase 1 are co-ordinately overexpressed in patients with gastric adenocarcinomas[J]. BMC Res Notes , 2015, 8 :676. DOI:10.1186/s13104-015-1658-y |
| [8] | CHEN H, ZOU Y, YANG H, WANG J, PAN H. Downregulation of FoxM1 inhibits proliferation, invasion and angiogenesis of HeLa cells in vitro and in vivo[J]. Int J Oncol , 2014, 45 :2355–2364. |
| [9] | ZHAO F, SIU M K, JIANG L, TAM K F, NGAN H Y, LE X F, et al. Overexpression of forkhead box protein M1(FOXM1) in ovarian cancer correlates with poor patient survival and contributes to paclitaxel resistance[J]. PLoS One , 2014, 9 :e113478. DOI:10.1371/journal.pone.0113478 |
| [10] | BHAT U G, HALASI M, GARTEL A L. Thiazole antibiotics target FoxM1 and induce apoptosis in human cancer cells[J]. PLoS One , 2009, 4 :e5592. DOI:10.1371/journal.pone.0005592 |
| [11] | JIANG L Z, WANG P, DENG B, HUANG C, TANG W X, LU H Y, et al. Overexpression of forkhead box M1 transcription factor and nuclear factor-κB in laryngeal squamous cell carcinoma: a potential indicator for poor prognosis[J]. Hum Pathol , 2011, 42 :1185–1193. DOI:10.1016/j.humpath.2010.06.017 |
| [12] | GARTEL A L. Suppression of the oncogenic transcription factor FOXM1 by proteasome inhibitors[J]. Scientifica (Cairo) , 2014, 2014 :596528. |
| [13] | ADAMI G R, YE H. Future roles for Foxm1 inhibitors in cancer treatments[J]. Future Oncol , 2007, 3 :1–3. DOI:10.2217/14796694.3.1.1 |
| [14] | JIANG L, WANG P, CHEN H. Overexpression of FOXM1 is associated with metastases of nasopharyngeal carcinoma[J]. Ups J Med Sci , 2014, 119 :324–332. DOI:10.3109/03009734.2014.960053 |
| [15] | DAI B, KANG S H, GONG W, LIU M, ALDAPE K D, SAWAYA R, et al. Aberrant FoxM1B expression increases matrix metalloproteinase-2 transcription and enhances the invasion of glioma cells[J]. Oncogene , 2007, 26 :6212–6219. DOI:10.1038/sj.onc.1210443 |
| [16] | WANG I C, CHEN Y J, HUGHES D E, ACKERSON T, MAJOR M L, KALINICHENKO V V, et al. FoxM1 regulates transcription of JNK1 to promote the G1/S transition and tumor cell invasiveness[J]. J Biol Chem , 2008, 283 :20770–20778. DOI:10.1074/jbc.M709892200 |
| [17] | NAKANO I, JOSHI K, VISNYEI K, HU B, WATANABE M, LAM D, et al. Siomycin A targets brain tumor stem cells partially through a MELK-mediated pathway[J]. Neuro Oncol , 2011, 13 :622–534. DOI:10.1093/neuonc/nor023 |
 2016, Vol. 37
2016, Vol. 37


