2. 重庆医科大学基础医学院, 重庆 400016
2. School of Basic Medical Sciences, Chongqing Medical University, Chongqing 400016, China
男性不育是一个世界性医学难题,其发病率逐年上升,弱精子症和少弱精子症是导致男性不育的两个常见原因,但其病因复杂,发病机制不清,严重制约了男性不育症的临床诊疗,阻碍了生殖医学的发展。
精子发生是一个极为复杂的特殊细胞分裂和分化过程,许多研究表明在此过程中,泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)发挥了重要调控作用,大量蛋白被泛素化,并最终在精子形成期被降解[1-4],但具体机制尚未阐明。泛素特异性蛋白酶7(ubiquitin specific peptidase 7, USP7) /疱疹病毒相关性泛素特异性蛋白酶(herpes virus-associated ubiquitin-specific protease, HAUSP)是UPS的重要组成成分[5]。USP7属于半胱氨酸蛋白酶,是去泛素化酶家族(deubiquitinases, DUBs)中泛素特异性修饰酶家族(ubiquitin specific processing enzymes, USPs)的重要成员之一,它能调控细胞内多种底物蛋白的定位、活性和功能,在人类许多疾病的发病过程中发挥重要作用[6-7]。目前,研究较多的是USP7表达异常引起肿瘤和病毒性疾病的发生[8-9],USP7与男性不育的相关研究极少。近期Amaral等[10]用高通量检测方法识别USP7是与人精子活力相关的蛋白,但未深入研究。本课题采用间接免疫荧光染色和蛋白质印迹法在蛋白水平研究USP7在弱精子症(asthenozoospermia)和少弱精子症(oligoasthenozoospermia)患者精子中的定位情况与表达变化,并对USP7表达与精液参数进行了相关性分析,旨在探讨USP7在男性不育症发病过程中的功能。
1 材料和方法 1.1 研究对象与分组标本来源于2013年11月至2015年3月重庆医科大学附属第二医院妇产科生殖医学中心就诊的男性精液,排除性功能障碍,精索静脉曲张、隐睾、前列腺炎、附睾炎、睾丸炎或尿道炎等疾病,随机抽取120例。所有供精者禁欲3~7 d,手淫法采集精液于取精杯内,然后置于37℃水浴箱内,待精液完全液化后,采用计算机辅助精子分析(computer-aided sperm analysis, CASA),按照世界卫生组织(World Health Organization, WHO)于2010年出版的第五版《世界卫生组织人类精液检查与处理实验室手册》推荐标准进行精液常规参数检测,将这120例男性精液分为3组:弱精子症组(A组)37例(30.8%),少弱精子症组(OA组)26例(21.7%),正常精子(normozoospermia)组(N组)57例(47.5%)。本研究获得医院医学伦理委员会批准,所有标本均取得志愿者知情同意。
1.2 免疫荧光细胞化学染色确定USP7在精子中的定位分布参照前期免疫细胞化学技术[11]处理精液,去除精浆、杂质,得到精子,涂片后用丙酮固定,自然风干,破膜30 min,洗涤缓冲液洗涤。室温封闭1 h后加一抗USP7兔多克隆抗体(1∶100;货号ab4080,美国Abcam公司),4℃避光过夜。洗涤缓冲液洗涤后,滴加二抗(Alexa Fluor 488标记IgG,1∶2 000),室温下孵育2 h,洗涤缓冲液洗涤,抗荧光衰减封片剂(含DAPI)封片后在激光共聚焦显微镜下观察结果。
1.3 蛋白质印迹法检测USP7在精子中的表达为了检测USP7蛋白分别在N、A、OA组精子中的表达,分别提取这3组样本的总蛋白,测定蛋白浓度后各取50 μg样品,上样用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜,用含5%脱脂奶粉TBST缓冲液在室温封闭2 h后加一抗USP7兔多克隆抗体(1∶1 000)、微管蛋白α(α-tubulin)抗体(1∶5 000;货号ab52866,美国Abcam公司),4℃孵育过夜后用TBST洗膜,然后加二抗(辣根过氧化物酶标记的羊抗兔IgG, 1∶2 000)常温孵育45 min,洗膜,最后发光显影。
1.4 统计学处理应用GraphPad Prism 6.0统计软件进行统计分析。实验数据均以x±s表示,3组变量的比较采用单因素方差分析,组间两两比较采用Bonferroni法;相关性分析采用Spearman法。检验水准(α)为0. 05。
2 结果 2.1 精液常规分析经精液常规参数检测得出,与N组相比,A组和OA组的精子总数、浓度、总活动率、前向运动百分率和正常形态百分率均降低(P < 0.01),但3组对象年龄差异无统计学意义(P>0.05)。与A组相比,OA组的精子总数、浓度和总活动率均下降(P < 0.01),前向运动百分率、正常形态百分率和年龄差异无统计学意义(P>0.05)。见表 1。
|
|
表 1 研究对象的精液参数分析 Tab 1 Analysis of semen parameters of the subjects included in this study |
2.2 USP7蛋白在人精子中的定位分布
间接免疫荧光染色分析结果(图 1)显示,USP7(绿色荧光)定位在人精子尾部中段(包括线粒体鞘)和主段。与N组相比,USP7蛋白在A组或OA组精子变形或缺失的尾部中段和主段的荧光强度明显减弱或缺失。
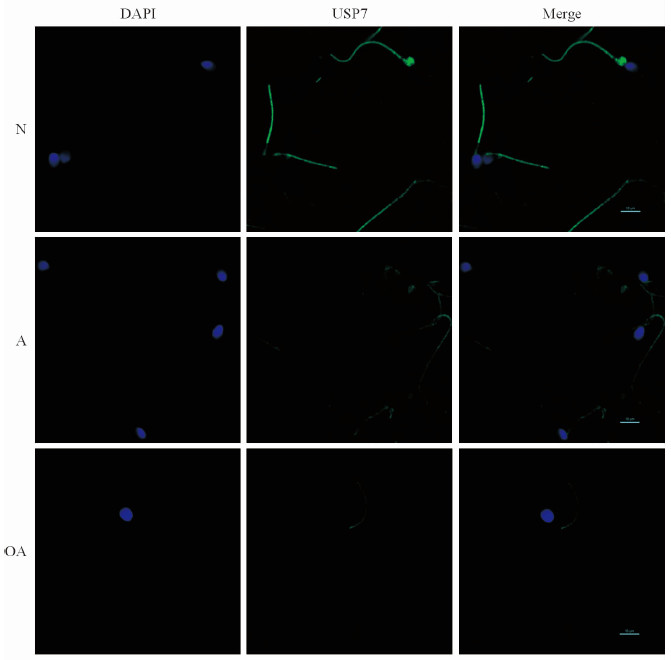
|
图 1 间接免疫荧光染色检测USP7蛋白的定位 Fig 1 Localization of USP7 protein as assayed by indirect immunofluorescence |
2.3 USP7蛋白在人精子中的表达水平
蛋白质印迹法检测结果(图 2)显示,与N组(1.63±0.76)比较,A组(0.86±0.53)或OA组(0.62±0.43)中精子USP7的表达水平降低,差异有统计学意义(P < 0.01)。而与A组相比,OA组中精子USP7的表达水平下降,但差异无统计学意义(P>0.05)。
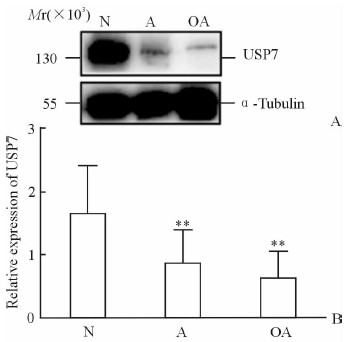
|
图 2 蛋白质印迹分析检测USP7蛋白的表达 Fig 2 Expression of USP7 protein detected using Western blotting |
2.4 USP7蛋白水平与精液常规参数的相关性分析
USP7蛋白表达水平与精液常规参数的相关性分析结果(图 3)显示,USP7蛋白表达水平与精子浓度(r=0.455 0, P=0.005 3)、前向运动百分率(r=0.431 2, P=0.008 7)和总活动率(r=0.443 8, P=0.006 7)呈正相关。
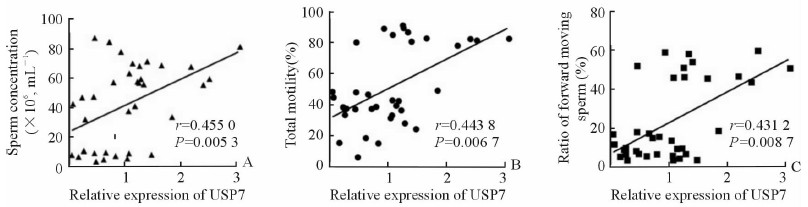
|
图 3 USP7蛋白表达和精液参数的相关性分析 Fig 3 Correlation of USP7 expression with sperm parameters |
3 讨论
USP7是DUBs中的USPs的重要成员之一,广泛分布于各种细胞和组织中,有多种底物蛋白,是UPS的重要调节器[12-14]。异常的去泛素化存在于许多疾病中,尤以肿瘤最为明显[15]。许多研究表明USP7参与了复杂的蛋白水平调控,它在肿瘤的发生发展过程中起致癌或抑癌的作用,可因细胞或组织类型的不同而呈现不同的生物学特性[6, 16]。
精子活力和浓度是评估精液质量和男性生育力的重要指标,如不正常即表现为弱精子症和少弱精子症。Kon等[17]报道,usp7基因敲除小鼠表现出早期胚胎致死性,说明其在早期胚胎发育中起关键作用。Luo等[18]研究发现,SCML2(sex comb on midleg-like 2)是生殖细胞特定染色质相关蛋白,能与USP7相互作用,并招募USP7到精母细胞XY体中。SCML2/USP7复合体构成了一种新的分子通路以在男性减数分裂时调控性染色体表观遗传状态。目前尚未见关于USP7与弱精子症和少弱精子症的相关报道。本研究采用间接免疫荧光技术和蛋白质印迹技术在蛋白水平研究了USP7在正常精子、弱精子症和少弱精子症者精子中的定位情况和表达变化,并分析了USP7与精子活力和浓度的相关性。本研究发现,与N组相比,A组和OA组患者精子总数、浓度、总活动率和前向运动百分率均下降(P < 0.01)。间接免疫荧光结果显示,USP7定位在人精子尾部中段和主段,包括线粒体鞘,推测其可能与精子活力相关。本研究还发现USP7在精子尾部形态和结构异常,尤其是在线粒体形态和结构异常的精子中表达减少,在A组或OA组患者精子的绿色荧光强度明显降低。精子尾部的形态和结构异常可导致精子运动障碍,这就进一步说明了USP7蛋白是精子运动所必需的,其与精子活力密切相关。另外,本研究并未发现USP7在精子核中有表达,这与之前报道的USP7主要定位在细胞核[19]不一致,可能是由于其他相互作用的蛋白存在,在精子中出现了细胞核的USP7转位到了细胞质中,也可能是由于细胞或组织间的差异[20]。
同时,蛋白质印迹法检测结果也证实了精子中USP7的表达,与N组相比,在A组和OA组中明显降低(P < 0.01)。有研究表明,精子活力低下可能与精子线粒体能量产生或利用障碍相关,也可能是由于精子线粒体鞘畸形所造成[21]。USP7蛋白在A组和OA组患者精子的表达水平降低,可能会影响线粒体鞘结构的形成、能量的产生和利用,最终影响男性的生育能力。此外,相关性分析结果表明,USP7蛋白水平与精子浓度、精子总活动率和前向运动百分率呈正相关(P < 0.01)。这些结果与Amaral等[10]报道的关于高通量识别发现与人精子活力相关的蛋白USP7,在弱精子症中的表达低于正常精子的表达的结论具有一致性。因此,我们推测与精子活力、浓度异常相关的男性不育症的发病过程可能与USP7表达异常有关。
虽然USP7在精子形成期的功能尚不清楚,但作为去泛素化酶的一种,它就会发挥其功能而影响精子形成期各蛋白的变化。USP7发挥去泛素化酶的作用,调控底物蛋白的命运,如是否被降解、重新定位或活化等。不同表达量的USP7发挥作用,可导致靶蛋白过少或过度降解,从而调控细胞内蛋白质的水平并影响其功能。因此,我们推测,与N组相比,在A组、OA组精子中USP7表达显著下降,过少的USP7发挥去泛素化酶作用,有可能使过多的靶蛋白被降解,从而导致精子发生过程中各级精子细胞内蛋白质水平失去平衡,进而影响其定位,甚至影响其功能,这可能是引起弱精子症(和)或少弱精子症精子活力低下和(或)浓度稀少的原因之一。
研究发现,USP7能调控p53-MDM2(murine double minute 2)通路,USP7敲除的H460细胞能促进凋亡,表明USP7可参与凋亡途径[22]。本研究中A组和OA组中USP7减少可能也会导致精子线粒体受损,致使精子运动活力下降;在精子发生期,凋亡可以调控精子数量,而OA组中USP7的抗凋亡调节作用减低,可能会导致过度的精子细胞凋亡,从而导致精子浓度减低。我们推测,在精子形成期,USP7可能影响精子细胞内蛋白质水平和功能,也可能参与精子细胞的凋亡。因此,进一步研究其表达降低的机制有利于揭示弱精子症和少弱精子症发生的分子机制,对弱精子症和少弱精子症诊疗具有重要意义。
总之,本研究证实,与正常精子相比,USP7在弱精子症和少弱精子症患者精子中的表达明显降低;USP7蛋白水平与精子总活动率、前向运动百分率以及精子浓度呈正相关。我们推测USP7表达降低会改变精子线粒体结构和精子细胞凋亡机制,最终导致线粒体功能、精子活力下降和精子浓度减少。本研究结果提示精子USP7可作为筛选精液质量和男性生育力的一种筛查指标。
| [1] | BOSE R, MANKU G, CULTY M, WING S S. Ubiquitin-proteasome system in spermatogenesis[J]. Adv Exp Med Biol , 2014, 759 :181–213. DOI:10.1007/978-1-4939-0817-2 |
| [2] | BAARENDS W M, VAN DER LAAN R AND GROOTEGOED J A. Specific aspects of the ubiquitin system in spermatogenesis[J]. J Endocrinol Invest , 2000, 23 :597–604. DOI:10.1007/BF03343782 |
| [3] | BEBINGTON C, DOHERTY F J, FLEMING S D. The possible biological and reproductive functions of ubiquitin[J]. Hum Reprod Update , 2001, 7 :102–111. DOI:10.1093/humupd/7.1.102 |
| [4] | SUTOVSKY P. Ubiquitin-dependent proteolysis in mammalian spermatogenesis, fertilization, and sperm quality control: killing three birds with one stone[J]. Microsc Res Tech , 2003, 61 :88–102. DOI:10.1002/jemt.10319 |
| [5] | GIOVINAZZI S, SIRLETO P, AKSENOVA V, MOROZOV V M, ZORI R, REINHOLD W C, et al. USP7 protects genomic stability by regulating Bub3[J]. Oncotarget , 2014, 5 :3728–3742. DOI:10.18632/oncotarget |
| [6] | NICHOLSON B, SURESH KUMAR K G. The multifaceted roles of USP7: new therapeutic opportunities[J]. Cell Biochem Biophys , 2011, 60 (1/2) :61–68. |
| [7] | ZLATANOU A, SABBIONEDA S, MILLER E S, GREENWALT A, AGGATHANGGELOU A, MAURICE M M, et al. USP7 is essential for maintaining Rad18 stability and DNA damage tolerance[J]. Oncogene , 2016, 35 :965–976. DOI:10.1038/onc.2015.149 |
| [8] | ZAMAN MM, NOMURA T, TAKAGI T, OKAMURA T, JIN W, SHINAGAWA T, et al. Ubiquitination-deubiquitination by the TRIM27-USP7 complex regulates tumor necrosis factor alpha-induced apoptosis[J]. Mol Cell Biol , 2013, 33 :4971–4984. DOI:10.1128/MCB.00465-13 |
| [9] | FAN Y H, CHENG J, VASUDEVAN S A, DOU J, ZHANG H, PATEL R H, et al. USP7 inhibitor P22077 inhibits neuroblastoma growth via inducing p53-mediated apoptosis[J]. Cell Death Dis , 2013, 4 . |
| [10] | AMARAL A, PAIVA C, ATTARDO PARRINELLO C, ESTANYOL J M, BALLESCÀ J L, RAMALHO-SANTOS J, et al. Identification of proteins involved in human sperm motility using high-throughput differential proteomics[J]. J Proteome Res , 2014, 13 :5670–5684. DOI:10.1021/pr500652y |
| [11] | WANG M J, OU J X, CHEN G W, WU J P, SHI H J, O W S, et al. Does prohibitin expression regulate sperm mitochondrial membrane potential, sperm motility and male fertility?[J]. Antioxid Redox Signal , 2012, 17 :513–519. DOI:10.1089/ars.2012.4514 |
| [12] | AMERIK A Y, HOCHSTRASSER M. Mechanism and function of deubiquitinating enzymes[J]. Biochim Biophys Acta , 2004, 1695 (1/2/3) :189–207. |
| [13] | VENTII K H, WILKINSON K D. Protein partners of deubiquitinating enzymes[J]. Biochem J , 2008, 414 :161–175. DOI:10.1042/BJ20080798 |
| [14] | KOMANDER D. Mechanism, specificity and structure of the deubiquitinases[J]. Subcell Biochem , 2010, 54 :69–87. DOI:10.1007/978-1-4419-6676-6 |
| [15] | REYES-TURCU F E, VENTII K H, WILKINSON K D. Regulation and cellular roles of ubiquitin-specific deubiquitinating enzymes[J]. Annu Rev Biochem , 2009, 78 :363–397. DOI:10.1146/annurev.biochem.78.082307.091526 |
| [16] | REVERDY C, CONRATH S, LOPEZ R, PLANQUETTE C, ATMANENE C, COLLURA V, et al. Discovery of specific inhibitors of human USP7/HAUSP deubiquitinating enzyme[J]. Chem Biol , 2012, 19 :467–477. DOI:10.1016/j.chembiol.2012.02.007 |
| [17] | KON N, KOBAYASHI Y, LI M, BROOKS C L, LUDWIG T, GU W. Inactivation of HAUSP in vivo modulates p53 function[J]. Oncogene , 2010, 29 :1270–1279. DOI:10.1038/onc.2009.427 |
| [18] | LUO M, ZHOU J, LEU N A, ABREU C M, WANG J, ANGUERA M C, et al. Polycomb protein SCML2 associates with USP7 and counteracts histone H2A ubiquitination in the XY chromatin during male meiosis[J]. PLoS Genet , 2015, 11 . |
| [19] | NATHAN J A, SENGUPTA S, WOOD S A, ADMON A, MARKSON G, SANDERSON C, et al. The ubiquitin E3 ligase MARCH7 is differentially regulated by the deubiquitylating enzymes USP7 and USP9X[J]. Traffic , 2008, 9 :1130–1145. DOI:10.1111/j.1600-0854.2008.00747.x |
| [20] | MURATANI M, GERLICH D, JANICKI S M, GEBHARD M, EILS R, SPECTOR D L. Metabolic-energy-dependent movement of PML bodies within the mammalian cell nucleus[J]. Nat Cell Biol , 2002, 4 :106–110. DOI:10.1038/ncb740 |
| [21] | PIASECKA M, KAWIAK J. Sperm mitochondria of patients with normal sperm motility and with asthenozoospermia: morphological and functional study[J]. Folia Histochem Cytobiol , 2003, 41 :125–139. |
| [22] | ZHAO G Y, LIN Z W, LU C L, GU J, YUAN Y F, XU F K, et al. USP7 overexpression predicts a poor prognosis in lung squamous cell carcinoma and large cell carcinoma[J]. Tumour Biol , 2015, 36 :1721–1729. DOI:10.1007/s13277-014-2773-4 |
 2016, Vol. 37
2016, Vol. 37


