2. 河北省人民医院医务处, 石家庄 050051
2. Divison of Medical Affairs, Hebei General Hospital, Shijiazhuang 050051, Hebei, China
胃癌是我国发病率、死亡率最高的消化道恶性肿瘤,严重危害人民健康。胃癌患者的肿瘤生长迅速,患者就诊时肿瘤多已处于进展期,综合治疗效果不佳、预后差,5年生存率不足40%[1-2]。胃癌发展迅速的重要原因之一在于细胞具有较强的增殖能力[3]。若能有效抑制胃癌细胞的增殖,将对阐明胃癌发生、发展机制,探索新的胃癌治疗方案有重要意义,但相关研究目前尚未取得突破性进展。亲环素A(cyclophilin A, CypA)是亲环蛋白家族成员之一,具有原癌基因特性,在乳腺癌、食管癌、胆管癌、非小细胞肺癌等多种恶性肿瘤中高表达[4-7]。目前关于CypA与胃癌细胞增殖的报道不多,具体机制也不清楚。因此,本研究检测了CypA在胃癌组织和细胞株中的表达情况,并采用基因干扰技术抑制胃癌细胞中CypA的表达,观察抑制前后胃癌细胞增殖能力的改变,进一步检测抑制CypA后增殖基因的变化,为探讨胃癌细胞的增殖机制提供一定依据。
1 材料和方法 1.1 主要试剂及仪器RPMI 1640培养基、胰蛋白酶购自美国Gibco公司;RNA提取试剂TRIzol、核酸转染细胞的转染试剂LipofectamineTM 2000购自美国Invitrogen公司;荧光定量PCR所用反转录试剂盒及相关试剂购自美国Promega公司;所有目的基因PCR引物和小干扰RNA(siRNA)由生工生物工程(上海)有限公司合成;蛋白提取试剂盒购自碧云天生物技术有限公司;CypA、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、Cyclin D1、P21及β-actin抗体购自美国Santa Cruz公司;MTT购自美国Sigma公司。GeneAmp 9600型PCR仪购自美国PE公司;2010型酶标仪购自奥地利Thermo公司;Epics-XLⅡ型流式细胞仪购自美国Beckman Coulter公司。
1.2 胃癌组织来源选择2013年1月至2013年12月在河北医科大学第四医院普外三科住院行手术切除并经病理确诊的胃癌患者20例,其中男性12例,女性8例;年龄41~71岁,平均年龄(56.8±6.2)岁,患者术前均未接受过针对肿瘤的治疗。每例均取癌组织及癌旁组织(距癌组织边缘 > 2cm)各1份(约1.0 cm×0.5 cm×0.5 cm),标本投入液氮速冻后转入-80℃冰箱保存。该研究取得河北医科大学第四医院医学伦理委员会批准并获得患者同意。
1.3 细胞株及细胞培养高分化胃癌细胞株MKN28、低分化胃癌细胞株MKN45及正常胃上皮细胞株GSE-1购自中国科学院上海生命科学院细胞资源中心,细胞在河北医科大学第四医院中心实验室进行培养、传代及保存。各细胞株均于RPMI 1640培养基中常规培养(培养时加入10%胎牛血清及双抗),在5% CO2、37℃的细胞培养箱恒温孵育。用含0.02% EDTA的0.25%胰蛋白酶溶液消化传代。
1.4 荧光定量PCR技术检测CypA、PCNA、Cyclin D1、P21 mRNA的表达采用TRIzol一步法提取胃癌组织、癌旁组织及各细胞株的总RNA,分别取2 μg RNA反转录成为cDNA。反转录产物取2 μL行荧光定量PCR,按反转录试剂盒操作说明建立反应体系:2 μL反转录产物,10 μL SYBR Green Mix (Applied Biosystems, 美国),上、下游引物(10 μmol/L)各0.5 μL,去离子水7 μL。PCR热循环参数设定为95℃,持续5 min;然后依次行下列步骤:94℃变性30 s,60℃退火30 s,进行45个循环。CypA引物: (F)5′-CAT ACG GGT CCT GGC ATC T-3′,(R)5′-TGC TGG TCT TGC CAT TCC-3′;PCNA引物:(F)5′-TAA GGG CTG AAG ATA ATG CTG AT-3′,(R)5′-CCT GTT CTG GGA TTC CAA GTT-3′;Cyclin D1引物:(F)5′-CCG TCC ATG CGG AAG ATC-3′,(R)5′-GTC ACA CTT GAT CAC TCT GG-3′;P21引物:(F)5′-CGC TCT ACA TCT TCT GCC TTA G-3′,(R)5′-CAG CAC TCT TAG GAA CCT CTC AT-3′; P16引物:(F)5′-CAA CGC ACC GAA TAG TTA CG-3′,(R)5′-ACC ACC AGC GTG TCC AGG AA-3′;β-actin引物:(F)5′-ACC ACA GTC CAT GCC ATC AC-3′,(R)5′-TCC ACC ACC CTG TTG CTG TA-3′。本研究以β-actin作内参基因。荧光定量PCR检测结果经1.5%琼脂糖凝胶电泳鉴定,并以2-ΔΔCt法计算各基因mRNA的相对表达量。
1.5 蛋白质印迹法检测CypA、PCNA、Cyclin D1、P21蛋白的表达应用Bradford法对胃癌组织、癌旁组织及各细胞株的样本蛋白进行定量,各样本分别取60 μg进行实验。使用12%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分离蛋白样品并电转移至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜,用TBST洗涤缓冲液配制的脱脂奶粉在室温下封闭1 h。加入相应一抗4℃孵育过夜,TBST漂洗3次后加入辣根过氧化酶(horseradish peroxidase,HRP)标记的二抗室温孵育1 h。显色,检测各蛋白条带灰度值并定量,结果以目的蛋白条带灰度值与内参β-actin条带灰度值的比值来表示。
1.6 CypA特异性siRNA(CypA-siRNA)转染MKN45细胞CypA-siRNA序列为5′-CTG ACT GTG GAC AAC TCG AAT-3′,非特异性siRNA序列为5′-CCC TTC TCT GTT TGT AAA GAG ACA T-3′。取MKN45细胞以4×105/mL的密度接种于6孔板中,培养24 h。转染前用RPMI 1640清洗MKN45细胞,将合成的siRNA溶解成浓度为40 nmol/L的溶液,按转染试剂操作说明稀释各溶液并分组:CypA-siRNA(CypA-siRNA组)、非特异性siRNA(Non组)及相应比例的转染试剂LipofectamineTM 2000(Con组),其中CypA-siRNA组根据CypA-siRNA浓度不同分为10、20、40 nmol/L CypA-siRNA组3个亚组,混合静置后分别转染MKN45细胞。转染48 h后观察转染效率。
1.7 MTT法检测转染后细胞的生长情况0.02%EDTA-0.25%胰蛋白酶消化MKN45细胞,将细胞密度调整为5×104/mL,接种于96孔板中。待细胞生长至60%~70%融合时各组分别转染CypA-siRNA、非特异性siRNA和转染试剂LipofectamineTM 2000。继续培养各组细胞,分别在转染后24、48、72 h时取出培养板,各组均加入20 μL的MTT(5 mg/mL),培养4 h后去除培养液。各孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),室温下振荡15 min,检测波长为490 nm时各孔的光密度(D)值。实验重复3次。
1.8 流式细胞术检测转染后细胞周期情况转染结束后,MKN45细胞无血清培养16 h进行同步化处理;收集各组细胞,清洗并用70%冷乙醇快速冲散,制备1×107/mL的单细胞悬液0.1 mL。4℃固定12 h后碘化丙啶(PI)染色30 min,取密度为1×106/mL的细胞样品100 μL,应用Epics-XLⅡ型流式细胞仪(美国Beckman Coulter公司)上机检测各组细胞周期分布。
1.9 统计学处理采用SPSS 16.0软件进行统计学分析,实验数据均以x±s表示,组间比较采用单因素方差分析或t检验。检验水准(α)为0.05。
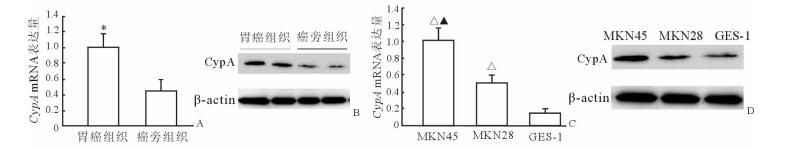
2 结果 2.1 胃癌组织、癌旁组织和细胞株中CypA的表达情况采用荧光定量PCR和蛋白质印迹法检测胃癌组织、癌旁组织及各细胞株中CypA的mRNA和蛋白表达情况,结果发现,胃癌组织中CypA的mRNA和蛋白表达水平高于癌旁组织(P < 0.05,图 1A、1B);而胃癌MKN28、MKN45细胞株CypA的mRNA和蛋白的表达水平也均高于正常胃上皮GES-1细胞株,低分化MKN45细胞株中CypA的mRNA和蛋白的表达高于高分化MKN28细胞株(P < 0.05,图 1C、1D)。
|
图 1 胃癌组织、癌旁组织及胃癌细胞株、胃上皮细胞株中CypA的mRNA和蛋白表达 A, C:实时荧光定量PCR检测CypAmRNA的表达量. *P < 0.05与癌旁组织比较;△P < 0.05与GES-1比较;▲P < 0.05与MKN28比较. n=6, x±s;B, D:蛋白质印迹法检测CypA蛋白表达. CypA:亲环素A |
2.2 CypA-siRNA对MKN45细胞CypA蛋白表达的影响
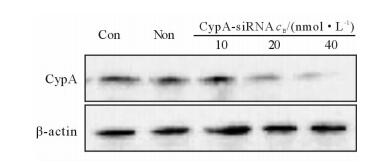
蛋白质印迹法检测转染48 h后各组细胞CypA蛋白的表达水平,结果显示较Con组和Non组,10、20、40 nmol/L CypA-siRNA 3组MKN45细胞CypA蛋白的表达均明显下降,且呈现出一定的剂量依赖性(图 2)。本研究选取40 nmol/L的CypA-siRNA转染MKN45细胞进行后续实验。
|
图 2 转染后各组MKN45细胞CypA蛋白的表达 CypA:亲环素A;Con:转染试剂LipofectamineTM 2000; Non:非特异性siRNA |
2.3 CypA-siRNA对MKN45细胞增殖能力的影响
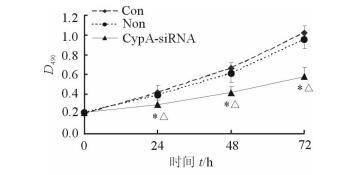
采用MTT法检测各组细胞的增殖情况,结果发现转染后不同时间点CypA-siRNA组MKN45细胞的增殖活力较Non组及Con组均明显下降(P < 0.05)。Non组与Con组比较差异无统计学意义(P > 0.05)。见图 3。
|
图 3 转染后各组MKN45细胞的增殖活性 CypA:亲环素A; Con:转染试剂LipofectamineTM 2000; Non:非特异性siRNA. *P < 0.05与同一时间点Con组比较;△P < 0.05与同一时间点Non组比较. n=6, x±s |
2.4 CypA-siRNA转染后MKN45细胞周期的变化
转染MKN45细胞后,CypA-siRNA组细胞G0/G1期的细胞比例高于Con组和Non组,而G2/M期的细胞比例低于Con组和Non组(P < 0.05)。Non组与Con组各周期的细胞比例差异均无统计学意义(P > 0.05,表 1)。
|
|
表 1 各组胃癌细胞的周期分布情况 |
2.5 CypA-siRNA转染对MKN45细胞PCNA、P21、P16、Cyclin D1表达的影响
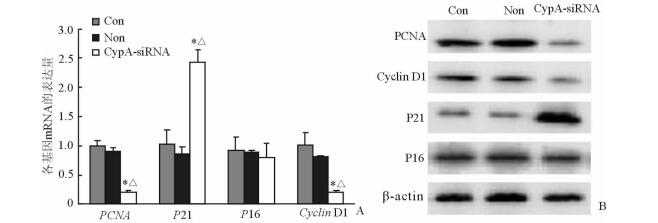
实时定量PCR和蛋白质印迹法检测结果显示,与Non组及Con组比较,CypA-siRNA组PCNA、Cyclin D1的mRNA和蛋白表达均下降,P21的mRNA和蛋白表达均上调(图 4)。
|
图 4 各组细胞增殖相关基因的表达情况 A:实时定量PCR检测mRNA的表达;* P < 0.05与Con组比较;△P < 0.05与Non组比较. n=6, x±s. B:蛋白质印迹法检测蛋白表达. CypA:亲环素A; Con:转染试剂LipofectamineTM 2000; Non:非特异性siRNA |
3 讨论
胃癌的发生和进展是多因素共同作用的结果[8],其中基因异常表达在胃癌发生中发挥了重要作用。胃癌细胞增殖迅速,可促使肿瘤快速生长并发生转移,因此通过抑制胃癌细胞的增殖而控制肿瘤进展是胃癌治疗的方向之一,发现胃癌细胞增殖的中心调节基因并对其功能进行分析具有重要意义。本研究分析了CypA与胃癌细胞增殖之间的关系,结果显示胃癌组织中CypA的表达高于癌旁组织,胃癌细胞株中CypA的表达也高于胃上皮细胞,且低分化的胃癌细胞株MKN45中CypA的表达高于高分化胃癌细胞株MKN28。这些结果提示CypA与胃癌有关,可能在胃癌发生和进展中发挥了作用。
CypA是亲环素家族的成员之一,具有参与蛋白质组装、介导细胞间信号转导及调节细胞凋亡等生物学功能[9-10]。近年来研究发现,CypA在多种恶性肿瘤中表达异常,并与肿瘤的迁移、耐药、增殖等生物学活性有关[4-7]。本研究通过siRNA技术抑制内源性CypA在胃癌MKN45细胞株中的表达后,细胞的增殖能力明显下降,进一步证实了CypA对细胞增殖具有促进作用,为深入了解胃癌发生机制及靶向性基因治疗提供了实验依据。
siRNA技术是近年来研究基因功能常用的反向遗传学方法,该技术可有效抑制内源性目的基因的表达,通过对抑制后的效应进行分析,从而了解目的基因的功能。本研究通过siRNA抑制胃癌MKN45细胞株CypA的高表达,反向证明了CypA对细胞增殖具有促进作用。本研究发现该技术同时抑制了MKN45细胞增殖标志基因PCNA和增殖促进基因Cyclin D1的表达,促进了增殖抑制基因P21的表达。PCNA是标志细胞增殖状态的重要基因[11];Cyclin D1则是通过促进细胞周期G1/S期进程从而促进细胞增殖[12];而P21是公认的细胞增殖负性调节基因[13-14]。这些基因表达的变化提示CypA可能通过调节这些基因而干预胃癌细胞的增殖进程。此外,本研究中细胞增殖负性调节基因P16[15]的表达变化并不明显,提示P16可能不受CypA调节,其对肿瘤细胞的增殖调节可能是通过其他途径实现的。
综上所述,在胃癌组织及胃癌细胞株中CypA的表达上调,应用siRNA技术抑制的CypA表达可有效抑制胃癌细胞的增殖能力。尽管确切的机制仍需要进一步研究,但上述结果可表明CypA可能作为致癌基因在胃癌增殖中发挥重要作用。
| [1] | LI Y, ZHAO Q, FAN L Q, TAN B B, ZHANG Z D, LIU Y. Analysis of lymph node dissection range-related factors for early gastric cancer operation[J]. Hepatogastroenterology , 2013, 60 :971–974. |
| [2] | 檀碧波, 李勇, 赵群, 范立侨, 刘小慧, 焦志凯, 等. 胃癌区域转移淋巴结中锌指蛋白139与基质金属蛋白酶-2、基质金属蛋白酶-7、基质金属蛋白酶组织抑制剂-1表达的关系及意义[J]. 中华实验外科杂志 , 2013, 30 :951–953. |
| [3] | ZHU Z L, YAN B Y, ZHANG Y, YANG Y H, WANG Z M, ZHANG H Z, et al. PINCH expression and its clinicopathological significance in gastric adenocarcinoma[J]. Dis Markers , 2012, 33 :171–178. DOI:10.1155/2012/895713 |
| [4] | CHEVALIER F, DEPAGNE J, HEM S, CHEVILLARD S, BENSIMON J, BERTRAND P, et al. Accumulation of cyclophilin A isoforms in conditioned medium of irradiated breast cancer cells[J]. Proteomics , 2012, 12 :1756–1766. DOI:10.1002/pmic.201100319 |
| [5] | FENG M X, LI J P, WANG H, SHEN Y X, TAN L J, WANG Q, et al. Clinical significance of cyclophilin a expression in esophageal squamous cell carcinoma[J]. Genet Test Mol Biomarkers , 2015, 19 :182–186. DOI:10.1089/gtmb.2014.0067 |
| [6] | OBCHOEI S, SAWANYAWISUTH K, WONGKHAM C, KASINRERK W, YAO Q, CHEN C, et al. Secreted cyclophilin A mediates G1/S phase transition of cholangiocarcinoma cells via CD147/ERK1/2 pathway[J]. Tumour Biol , 2015, 36 :849–859. DOI:10.1007/s13277-014-2691-5 |
| [7] | QIAN Z, ZHAO X, JIANG M, JIA W, ZHANG C, WANG Y, et al. Downregulation of cyclophilin A by siRNA diminishes non-small cell lung cancer cell growth and metastasis via the regulation of matrix metallopeptidase 9[J]. BMC Cancer , 2012, 12 :442. DOI:10.1186/1471-2407-12-442 |
| [8] | TAN B, LI Y, ZHAO Q, FAN L, WANG D, LIU Y. Inhibition of gastric cancer cell growth and invasion through siRNA-mediated knockdown of guanine nucleotide exchange factor Vav3[J]. Tumor Biol , 2014, 35 :1481–1488. DOI:10.1007/s13277-013-1204-2 |
| [9] | KOVALEV N, NAGY P D. Cyclophilin A binds to the viral RNA and replication proteins, resulting in inhibition of tombusviral replicase assembly[J]. J Virol , 2013, 87 :13330–13342. DOI:10.1128/JVI.02101-13 |
| [10] | MCGOWAN L C, HAMELBERG D. Conformational plasticity of an enzyme during catalysis: intricate coupling between cyclophilin A dynamics and substrate turnover[J]. Biophys J , 2013, 104 :216–226. DOI:10.1016/j.bpj.2012.11.3815 |
| [11] | MADHUMATI G, KAVITA S, ANJU M, UMA S, RAJ M. Immunohistochemical expression of cell proliferating nuclear antigen (PCNA) and p53 protein in cervical cancer[J]. J Obstet Gynaecol India , 2012, 62 :557–561. DOI:10.1007/s13224-012-0180-6 |
| [12] | RAVIKUMAR G, ANANTHAMURTHY A. Cyclin D1 expression in ductal carcinoma of the breast and its correlation with other prognostic parameters[J]. J Cancer Res Ther , 2014, 10 :671–675. |
| [13] | OHKOSHI S, YANO M, MATSUDA Y. Oncogenic role of p21 in hepatocarcinogenesis suggests a new treatment strategy[J]. World J Gastroenterol , 2015, 21 :12150–12156. DOI:10.3748/wjg.v21.i42.12150 |
| [14] | LI N, ZHONG X, LIN X, GUO J, ZOU L, TANYI J L, et al. Lin-28 homologue A (LIN28A) promotes cell cycle progression via regulation of cyclin-dependent kinase 2(CDK2), cyclin D1(CCND1), and cell division cycle 25 homolog A (CDC25A) expression in cancer[J]. J Biol Chem , 2012, 287 :17386–17397. DOI:10.1074/jbc.M111.321158 |
| [15] | RAMSHANKAR V, SOUNDARA V T, SHYAMSUNDAR V, RAMANI P, KRISHNAMURTHY A. Risk stratification of early stage oral tongue cancers based on HPV status and p16 immunoexpression[J]. Asian Pac J Cancer Prev , 2014, 15 :8351–8359. DOI:10.7314/APJCP.2014.15.19.8351 |
 2016, Vol. 37
2016, Vol. 37


