2. 第二军医大学长海医院预防保健科, 上海 200433
2. Department of Prevention and Health Care, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
维生素D的主要功能是维持钙磷的平衡,调节骨代谢和促进多种组织细胞的生长、分化。但近期研究发现维生素D除了参与骨钙的代谢之外,还参与骨骼肌代谢,与骨骼肌衰减症(骨骼肌萎缩)有关[1-2],如González-Reimers等[2]研究发现,维生素D水平与肌肉萎缩具有一定的相关性,血浆维生素D越低,肌肉萎缩的程度越明显。维生素D水平在衰老过程中趋于下降[3],近年来Gilsanz等[4]运用计算机断层扫描技术发现,维生素D严重缺乏的女性萎缩的肌纤维之间产生的空隙会由脂肪、糖原颗粒渗透进去,并发生肌纤维变性;而Moreira-Pfrimer等[5]研究发现,补充维生素D有助于提高肌肉力量和平衡性,并有助于降低老年人跌倒的风险,提示维生素D有助于改善肌肉功能。在骨骼肌中有维生素D受体(vitamin D receptor, VDR)表达[6-7],而维生素D以其活化形式1, 25-(OH)2-D3结合VDR发挥作用,经由基因机制和非基因机制调节维生素D靶基因转录水平和蛋白质合成[8],调节肌细胞的增殖与分化[9]。上述研究结果表明高维生素D水平对骨骼肌质量有着利好的调节作用,但在老年个体水平上关于维生素D对骨骼肌组织作用机制的研究还很少。
Bischoff-Ferrari等[10]研究表明在衰老的骨骼肌细胞内VDR表达较低,即肌肉萎缩与VDR的低表达有关。抗阻运动可以改善骨骼肌质量,但在老年个体身上这种抗阻运动改善骨骼肌质量的机制是否也受维生素D水平的调节尚不清楚。Blouqh等[11]研究表明超负荷手术可以引起骨骼肌肥大,这与抗阻运动引起骨骼肌肥大的原理与效果相同。鉴于采用抗阻力量方案难以控制,故本研究采用手术代偿性肥大模型代替抗阻力量肥大方案,探讨抗阻训练结合维生素D补充对大鼠骨骼肌生长及VDR表达的影响,为改善老年骨骼肌质量提供实验依据。
1 材料和方法 1.1 动物、试剂和仪器成年雄性(2个月龄)SD大鼠20只,清洁级,购于第二军医大学实验动物中心[动物生产许可证号:SCXK(沪)2012-0003],自然饲养至24个月龄用于实验。维生素D购于索莱宝公司(货号V8070-1),血浆维生素D检测试剂盒购自Elabscience公司(货号E-EL-0015c),骨骼肌VDR ELASA试剂盒购于Uscn Life Science公司(货号L130411445)。检测仪器为美国BIOTEK酶标仪。肌蛋白提取、BCA蛋白定量及蛋白质印迹检测等试剂盒与抗体均购自美国Cell Signaling公司。
1.2 动物模型及干预方案大鼠饲养环境保持在(22±2)℃,相对湿度40%~60%,光照时间为12 h/d,自由进食饮水,标准啮齿类动物饲料喂养。大鼠适应性饲养1周后,称重并麻醉(吸入2%~3%异氟醚),手术切断大鼠单侧腓肠肌远端肌腱造成超负荷骨骼肌肥大模型(Overload, Ovld侧),另一侧行假手术(Sham侧)。手术后将20只大鼠随机均分为2组:对照组和维生素D组。维生素D补充采用灌胃方式,1 000 IU/kg,每天1次,对照组大鼠灌胃补充等量的大豆油(溶剂)。共干预1周。
1.3 取材及处理维生素D干预1周后称量,采用3.6%水合氯醛腹腔麻醉大鼠,腹主动脉取血。无菌条件下取左右侧跖肌(快肌)和比目鱼肌(慢肌),用4℃预冷的生理盐水清洗,滤纸吸干肌组织表面的水分并称量,液氮速冻后转至-80℃保存待测。
1.4 ELISA检测大鼠血清25(OH)D浓度大鼠血液样品采集后30 min内1 000×g离心15 min,取上清。在ELISA酶标板各孔中加入标准品或样品各50 μL,稍后立即在各孔中加入50 μL生物素化抗体工作液, 37℃孵育45 min; 孵育后洗涤液洗3次,加入100 μL酶结合物工作液,37℃孵育30 min; 孵育后再洗涤液洗5次,加入90 μL底物溶液,37℃孵育15 min左右; 然后加入50 μL终止液,立即在450 nm波长处测定光密度(D)值,计算25(OH)D浓度。
1.5 ELISA检测大鼠肌组织VDR含量取适量肌组织块,用预冷PBS(0.01 mol/L,pH 7.0~7.2)清洗后称量备用。先将称量后的组织剪碎置于玻璃匀浆器中,冰上匀浆,而后1 500×g离心5 min取上清。在ELISA酶标板各孔中加入标准品或样品各100 μL,酶标板加上覆膜后37℃孵育2 h,弃去液体甩干并洗涤。每孔加A工作液100 μL加覆膜37℃孵育1 h。弃去孔内液体,每孔350 μL洗涤液浸泡2 min后弃去。每孔加B工作液100 μL,加覆膜37℃孵育30 min。弃液350 μL洗板液浸泡2 min,重复洗板5次。每孔加底物溶液90 μL,加覆膜37℃避光显色20 min。每孔加终止液50 μL终止反应。用酶标仪在450 nm波长下测量各孔D值,计算VDR含量。
1.6 蛋白质印迹法检测大鼠肌组织中p-rpS6和p-mTOR表达取约100 mg肌组织,置于试管中,加入1 mL组织裂解液,每1 mL裂解液含磷酸酶抑制剂、蛋白酶抑制剂和PMSF各5 μL。剪碎肌组织,4℃静置30 min后,用玻璃研磨器将肌组织充分匀浆,然后移至1.5 mL离心管中,4℃以12 000×g离心10 min。取上清,采用BCA法测定肌组织总蛋白含量。取已定量的蛋白,按1∶4的体积比加入5×protein loading buffer,沸水煮10 min,待用。采用Bio-Rad Precast Gel进行电泳,上样量为15 μL,电压调至130 V,时间约1~2 h。以100 V电压转膜,5%脱脂奶粉封闭1 h。加入用1%BSA稀释的rpS6(1∶1 000)、p-rpS6(1∶1 000)、mTOR(1∶1 000)、p-mTOR(1∶1 000)抗体,摇床4℃孵育过夜;加入辣根过氧化物酶标记的驴抗兔IgG(1∶7 500),孵育1 h。化学发光,显影、定影,扫描图像,用Image J分析软件读取图片目的条带光密度值。
1.7 统计学处理数据采用SPSS 13.0统计软件处理。实验结果用x±s表示,组间比较采用方差分析,组内Sham侧与Ovld侧之间的比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 补充维生素D提高老龄大鼠血清维生素D含量ELISA结果显示,补充维生素D可提高大鼠血清25(OH)D水平[维生素D组(589.86±97.64) ng/L, 对照组(345.35±86.34) ng/L,P<0.05]。
2.2 补充维生素D促进大鼠超负荷诱导的骨骼肌肥大两组大鼠在实验期摄食量和体质量差异均无统计学意义。由图 1可见,两组大鼠Ovld侧跖肌质量较Sham侧跖肌均增加(P<0.05),其中对照组增加了18.4%,维生素D组增加了23.7%。与对照组比较,维生素D组Ovld侧跖肌质量增加了29.2%(P<0.05),但两组Sham侧肌肉质量差异无统计学意义。
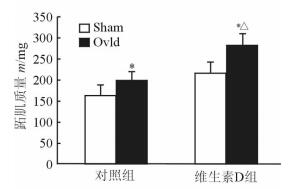
|
图 1 两组大鼠跖肌质量测定结果 Ovld:超负荷骨骼肌肥大模型;Sham:假手术. *P<0.05与同一组内Sham侧比较;△P<0.05与对照组Ovld侧比较. n=10, x±s |
2.3 补充维生素D和超负荷刺激可使骨骼肌组织VDR表达增强
由图 2可见,维生素D组Ovld侧肌组织中VDR含量高于Sham侧(P<0.05),而对照组Ovld侧和Sham侧肌组织中的VDR含量差异无统计学意义。说明补充维生素D提高了Ovld侧肌组织中VDR的表达。
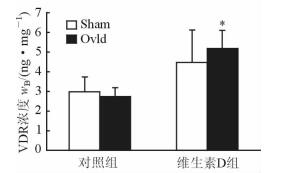
|
图 2 两组大鼠骨骼肌组织中VDR含量检测结果 VDR:维生素D受体;Ovld:超负荷骨骼肌肥大模型;Sham:假手术. *P<0.05与同一组内Sham侧比较. n=10, x±s |
2.4 补充维生素D增强rpS6和mTOR信号蛋白的表达
由图 3可见,Ovld模型促进了p-rpS6/ rpS6比值和p-mTOR/mTOR比值的增加,但仅在维生素D组与Sham侧比较差异有统计学意义(P<0.05)。
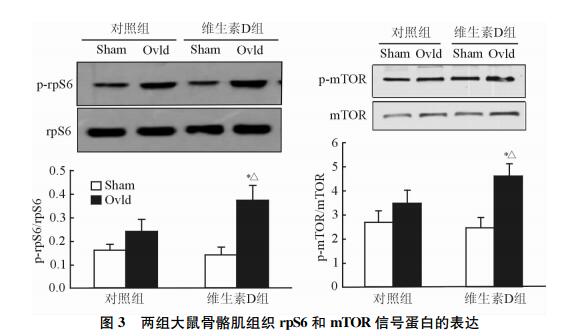
|
图 3 两组大鼠骨骼肌组织rpS6和mTOR信号蛋白的表达 Ovld:超负荷骨骼肌肥大模型;Sham:假手术. *P<0.05与同一组内Sham侧比较;△P<0.05与对照组Ovld侧比较. n=10, x±s |
3 讨论
本研究结果显示补充维生素D可提高大鼠血清维生素D水平,这与以往的研究结果[12-13]一致。超负荷诱导(Ovld)能够促使骨骼肌肥大在本实验中再次被验证,而且维生素D组与对照组Ovld侧跖肌相比肥大程度更明显,这证明维生素D具有增强骨骼肌肥大效果的作用;但两组大鼠Sham侧跖肌质量差异无统计学意义,其可能原因是老年大鼠蛋白质负平衡作用影响了维生素D的促进效果,也可能是维生素D干预时间短导致效果不明显。进一步研究发现维生素D组VDR水平高于对照组,而且Ovld侧又高于Sham侧,说明维生素D补充可提高个体肌组织中VDR水平,而且Ovld促进了VDR表达。提示维生素D和超负荷诱导在骨骼肌肥大过程中有可能相互促进。近年研究中发现,VDR可与caveolin-1关联介导维生素D激活MAPKs进而促进蛋白质合成[7],这一机制被推测与细胞膜钙离子相关受体蛋白的合成有关,因此维生素D的水平或者VDR的水平决定着相关细胞代谢通路的完整。
骨骼肌的质量受肌肉蛋白质平衡调节的控制,当蛋白质合成大于分解时骨骼肌就会肥大,反之就会发生肌肉萎缩。在本次研究中发现,各组大鼠在实验期摄食量和体质量差异均无统计学意义,但Ovld侧肢体骨骼肌肥大程度差异却有统计学意义。也许对于老年大鼠而言发生肌肉萎缩并不是蛋白质营养缺乏,而是某些受体数量减少或敏感性降低,抑制了蛋白质合成的相关信号通路。本研究结果显示,手术肥大模型可促进p-mTOR/mTOR、p-rpS6/ rpS6比值的增加,但仅在维生素D补充组差异有统计学意义。这说明手术模拟的超负荷模型激活了细胞mTOR通路,使蛋白质合成增加,而且维生素D能进一步激活相关信号蛋白,其可能机制是维生素D在VDR激活的情况下与之结合形成复合物,启动了蛋白质合成相关的mTOR通路,进一步促进了蛋白质的表达。但是还有一点我们应当看到,在Sham侧虽然维生素D补充同样提高了VDR水平,但蛋白质合成相关信号蛋白活化并不明显,而且骨骼肌肥大程度也不显著。这提示我们维生素D对骨骼肌肥大是有积极效应的,但却不能直接单独促进骨骼肌肥大,或者效果不显著。
本研究探索性地揭示了维生素D在骨骼肌肥大过程中所起到的作用,但实验设计还存在一定的不完善之处,如在大鼠干预前后可对生长因子进行检测,这样更能说明蛋白质平衡的状态;还可对基因转录水平进行检测,进一步确定维生素D在蛋白质合成中的作用。此外,我们没有做更详细的维生素D浓度梯度的探究,我们的预实验只分了补充800 IU和1 000 IU两个梯度,而且在800 IU剂量下各组间差异无统计学意义,因此后续研究中只采用了1 000 IU的剂量;虽然日本有研究表明,老年女性每天补充1 000 IU维生素D可显著提高女性的Ⅱ型肌纤维(快肌纤维)的质量[14],但仍应继续探究更有效的维生素D干预范围。尽管本次研究尚有如此多需要改进的方面,但实验研究所取得的结果在一定程度上证明维生素D在骨骼肌肥大过程中具有促进作用,其机制可能与维生素D激活VDR和mTOR信号蛋白、促进骨骼肌肥大有关。这提示高维生素D水平有利于老年个体骨骼肌健康,同时适当的抗阻运动对保持骨骼肌质量是有益的。
| [1] | BUITRAGO C G, ARANGO N S, BOLAND R L. 1α, 25(OH)2D3-dependent modulation of Akt in proliferating and differentiating C2C12 skeletal muscle cells[J]. J Cell Biochem , 2012, 113 :1170–1181. DOI:10.1002/jcb.23444 |
| [2] | GONZÁLEZ-REIMERS E, DURÁN-CASTELLÓN M C, LÓPEZ-LIROLA A, SANTOLARIA-FERNÁNDEZ F, ABREU-GONZÁLEZ P, ALVISA-NEGRÍN J, et al. Alcoholic myopathy: vitamin D deficiency is related to muscle fibre atrophy in a murine model[J]. Alcohol Alcohol , 2010, 45 :223–230. DOI:10.1093/alcalc/agq010 |
| [3] | TUOHIMAA P. Vitamin D and aging[J]. J Steroid Biochem Mol Biol , 2009, 114 (1/2) :78–84. |
| [4] | GILSANZ V, KREMER A, MO A O, WREN T A, KREMER R. Vitamin D status and its relation to muscle mass and muscle fat in young women[J]. J Clin Endocrinol Metab , 2010, 95 :1595–1601. DOI:10.1210/jc.2009-2309 |
| [5] | MOREIRA-PFRIMER L D, PEDROSA M A, TEIXEIRA L, LAZARETTI-CASTRO M. Treatment of vitamin D deficiency increases lower limb muscle strength in institutionalized older people independently of regular physical activity: a randomized double-blind controlled trial[J]. Ann Nutr Metab , 2009, 54 :291–300. DOI:10.1159/000235874 |
| [6] | SRIKUEA R, ZHANG X, PARK-SARGE O K, ESSER K A. VDR and CYP27B1 are expressed in C2C12 cells and regenerating skeletal muscle: potential role in suppression of myoblast proliferation[J]. Am J Physiol Cell Physiol , 2012, 303 :C396–C405. DOI:10.1152/ajpcell.00014.2012 |
| [7] | BUITRAGO C, BOLAND R. Caveolae and caveolin-1 are implicated in 1alpha, 25(OH)2-vitamin D3-dependent modulation of Src, MAPK cascades and VDR localization in skeletal muscle cells[J]. J Steroid Biochem Mol Biol , 2010, 121 (1/2) :169–175. |
| [8] | HAUSSLER M R, JURUTKA P W, MIZWICKI M, NORMAN A W. Vitamin D receptor (VDR)-mediated actions of 1α, 25(OH)2vitamin D3: genomic and non-genomic mechanisms[J]. Best Pract Res Clin Endocrinol Metab , 2011, 25 :543–559. DOI:10.1016/j.beem.2011.05.010 |
| [9] | GARCIA L A, KING K K, FERRINI M G, NORRIS K C, ARTAZA J N. 1, 25(OH)2 vitamin D3 stimulates myogenic differentiation by inhibiting cell proliferation and modulating the expression of promyogenic growth factors and myostatin in C2C12 skeletal muscle cells[J]. Endocrinology , 2011, 152 :2976–2986. DOI:10.1210/en.2011-0159 |
| [10] | BISCHOFF-FERRARI H A, BORCHERS M, GUDAT F, DÜRMÜLLER U, STÄHELIN H B, DICK W. Vitamin D receptor expression in human muscle tissue decreases with age[J]. J Bone Miner Res , 2004, 19 :265–269. DOI:10.1359/jbmr.2004.19.2.265 |
| [11] | BLOUGH E R, LINDERMAN J K. Lack of skeletal muscle hypertrophy in very aged male Fischer 344×Brown Norway rats[J]. J Appl Physiol (1985) , 2000, 88 :1265–1270. |
| [12] | MUIR S W, MONTERO-ODASSO M. Effect of vitamin D supplementation on muscle strength, gait and balance in older adults: a systematic review and meta-analysis[J]. J Am Geriatr Soc , 2011, 59 :2291–2300. DOI:10.1111/j.1532-5415.2011.03733.x |
| [13] | KHAN Q J, REDDY P S, KIMLER B F, SHARMA P, BAXA S E, O'DEA A P, et al. Effect of vitamin D supplementation on serum 25-hydroxy vitamin D levels, joint pain, and fatigue in women starting adjuvant letrozole treatment for breast cancer[J]. Breast Cancer Res Treat , 2010, 119 :111–118. DOI:10.1007/s10549-009-0495-x |
| [14] | SATO Y, IWAMOTO J, KANOKO T, SATOH K. Low-dose vitamin D prevents muscular atrophy and reduces falls and hip fractures in women after stroke: a randomized controlled trial[J]. Cerebrovasc Dis , 2005, 20 :187–192. DOI:10.1159/000087203 |
 2016, Vol. 37
2016, Vol. 37


