2. 第二军医大学长海医院口腔科, 上海 200433
2. Department of Stomatology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)是创伤愈合过程中重要的一类细胞因子,其可通过刺激造血干细胞分化、中性粒细胞与巨噬细胞形成、诱导单核巨噬细胞、炎性细胞和角化细胞的增殖与迁移、促进炎症反应、介导再上皮化等途径参与创伤愈合[1-3]。全身电离辐射损伤(ionizing radiation,IR)作为一种特殊的创伤,常见于核武器爆炸、核事故时以及放疗后进行手术时,该类损伤会引起造血细胞和修复细胞数量降低、功能减退,影响愈合过程中的诸多环节,最终延缓创面愈合;当IR 损伤合并烧伤、切割伤等其他创伤时最终会形成放射性复合伤[4]。近来研究发现,与单纯创伤相比,放射性复合伤愈合过程中诸多细胞因子表达水平存在异常,如血小板源性生长因子(platelet derived growth factor,PDGF)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等,但对于GM-CSF在放射性复合伤中的表达水平以及其与伤口愈合间的关系还不十分清楚。因此,本研究拟通过观察GM-CSF在放射性复合切割伤愈合过程中动态表达水平以及外源GM-CSF凝胶对该类伤口的干预治疗效果进一步探究GM-CSF对放射性复合伤愈合的影响。
1 材料和方法 1.1 分组及放射性复合切割伤模型构建雌性昆明种小鼠56只(SPF级),体质量20~22 g,健康状况好,由第二军医大学实验动物中心提供,使用许可证号为SYXK(沪)2012-0003。将实验动物随机分为对照组(28只)和实验组(28只);采用课题组前期方法[5]构建动物模型,即实验组小鼠用6 Gy 60Coγ射线(第二军医大学辐射中心提供)全身均匀辐射,对照组小鼠不做全身辐射。所有实验小鼠经2%戊巴比妥钠腹腔注射麻醉,8%硫化钠脱毛剂背部脱毛,生理盐水清洗,干燥后于无菌条件下在小鼠背部作一1.5 cm×1.5 cm正方形全层皮肤缺损伤口,优拓敷以创面,无菌纱布包扎,正常喂养,隔日更换敷料。
1.2 标本采集与处理两组动物均按致伤后1、3、5、7 d 4个时间点随机分为4个观察组,每个观察组7只小鼠。每个时间点将小鼠2%戊巴比妥钠腹腔麻醉后,无菌条件下于致伤时伤口同一部位进行活体取材,所有取材标本均为皮肤损伤区域(1.5 cm×1.5 cm)内全层皮肤及深面肌肉组织,取材后将标本分为两组,一组即刻置入于液氮内,抽提组织RNA备用;另一组10%中性甲醛固定,免疫组化分析备用。
1.3 RNA提取与反转录反应按照TRIzol法提取小鼠组织标本中的总RNA,方法步骤严格按照TRIzol(Invitrogen公司)说明书进行,提取总RNA后用NanoDrop紫外分光光度计检测其含量与纯度(D260/D280应大于1.8),随后进行凝胶电泳成像鉴定RNA完整性;RNA反转录反应采用TaKaRa反转录试剂盒(TaKaRa公司),在反转录酶作用下进行反转录反应得到cDNA;合成的cDNA直接用于Real-time PCR。
1.4 Real-time PCR检测组织中GM-CSF mRNA水平GM-CSF Real-time PCR反应采用SYBR Green Ⅰ法,试剂盒购于美国ABI公司; Real-time PCR反应体系为20 μL,其中:SYBR Green Mix 10 μL,cDNA 2 μL,GM-CSF的上下游引物各0.8 μL,最后由dH2O配至20 μL。反应条件为:95℃预变性 10 min;95℃变性 30 s,60℃退火 10 min,72℃延伸 20 s,40 个循环。PCR引物由生工生物工程(上海)有限公司合成,GAPDH:5′-GAA GGG TGG AGC CAA AAG-3′,5′-ACC AGT GGA TGC AGG GAT-3′;GM-CSF:5′-CCT GCT CTT CTC CAC GCT A-3′,5′-CGT GCC ATT GAC ATC CAG-3′。通过2-ΔΔCt法计算实验组与对照组之间GM-CSF mRNA表达水平的差异。
1.5 免疫组化检测GM-CSF蛋白水平石蜡切成4 μm厚连续切片,常规脱蜡,组织切片于二甲苯中浸泡约10 min,更换二甲苯后浸泡约10 min;无水乙醇浸泡约5 min;95% 乙醇中浸泡约5 min;70% 乙醇中浸泡约5 min,封片,镜检。
1.6 rhGM-CSF凝胶治疗实验雌性昆明种小鼠共40只(SPF级),体质量(20±2) g,健康状况好,由第二军医大学实验动物中心提供[许可证号SYXK(沪)2012-0003号]。背部放射性复合切割伤模型构建后随机分为2组,每组20只,一组在致伤后于伤口处涂抹浓度为6 000 ng/mL的rhGM-CSF凝胶,另一组涂抹空白凝胶,于小鼠致伤后0、1、3、4、5、7、9、11、14 d在消毒透明膜上进行面积描绘分析残余面积比;并于第14天取材,10%中性甲醛固定液中固定24 h后,石蜡进行包埋,胶原纤维Masson染色。
1.7 伤口胶原纤维测定切片常规脱蜡至水,苏木精染液5 min,清水冲洗,盐酸酒精分化数秒,流水蓝化,蒸馏水洗(可不染苏木精),丽春红酸性品红液中染5~8 min,蒸馏水洗,1%磷钼酸中染1~3 min,不用水洗直接入苯胺蓝液或亮绿液5 min (如染色效果不佳,可在冰醋酸内脱色后重染),水速洗,置60℃温箱中烘干,二甲苯透明,封固。胶原纤维呈蓝色(苯胺蓝复染)或绿色(亮绿复染),细胞核呈现灰黑或灰蓝色,肌纤维、纤维素呈红色。
1.8 统计学处理使用Image pro-plus 6.0软件分析免疫组化结果,每组切片挑选4个200倍视野进行拍照,应用Image-pro plus6.0软件对每张照片进行分析得出每张照片阳性的累积光密度值(IOD值),IOD值越大,阳性表达越强,每组所有照片的平均IOD值代表该组的IOD值。采用SPSS 17.0统计软件进行结果分析。实验结果中连续性变量以x±s形式表示,组间比较采用 t检验。检验水准(α)为0.05。
2 结 果 2.1 RT-PCR检测GM-CSF mRNA水平如图 1所示,在两组致伤后1~5 d内,对照组小鼠的GM-CSF mRNA表达水平高于实验组(P<0.05或P<0.01)。对照组伤后3 d GM-CSF mRNA的表达水平达到峰值,随后开始下降,并于第7天时达到最低水平;而实验组致伤后1~7 d内GM-CSF mRNA的表达水平变化较平缓,其相对表达水平也低于对照组,在第3天时表达量最低,随后表达缓慢上调,至第7天时达到最高并略高于对照组,但差异无统计学意义。RT-PCR结果显示在放射性复合切割伤愈合早期阶段(1~5 d),伤口组织中GM-CSF mRNA的表达水平低于单纯切割伤。
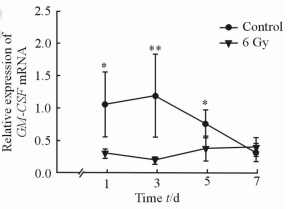
|
图 1 实验组与对照组伤口组织GM-CSF mRNA表达变化 Fig 1 Changes of GM-CSF mRNA levels between experimental group and control group |
2.2 免疫组化检测GM-CSF蛋白水平的变化
伤后3 d可见在对照组创口中存在大量巨噬细胞,胞质呈GM-CSF阳性表达(++),创缘表皮基底细胞、真皮深层少量成纤维细胞以及血管内皮细胞胞质呈弱阳性(+)表达(图 2A);而实验组中GM-CSF阳性表达的细胞较少(图 2B)。在伤后5 d,实验组与对照组的伤口组织中均可见少量巨噬细胞、创缘表皮基底细胞、血管内皮细胞GM-CSF呈阳性表达(图 2C、2D)。IOD定量统计结果(表 1)显示,对照组在致伤后1~7 d GM-CSF表达水平均高于实验组,其中在1 d与3 d时差异具有统计学意义(P<0.01);对照组大鼠组织中的GM-CSF表达水平在3 d时达到高峰,随后迅速下降,5 d、7 d时两组GM-CSF表达差异无统计学意义;IOD统计结果显示:与mRNA表达水平类似,放射性复合切割伤愈合早期阶段(1~3 d),伤口组织中GM-CSF的蛋白表达水平低于单纯切割伤。
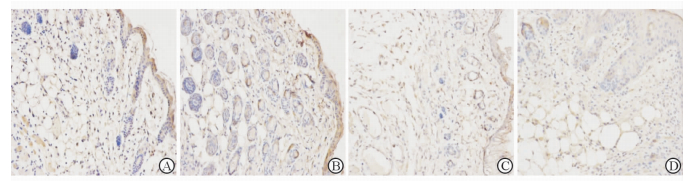
|
图 2 伤口组织中不同时间点的GM-CSF免疫组化结果 Fig 2 Immunohistochemical staining results of GM-CSF in the injury sites at different time points after injury |
|
|
表 1 7 d内小鼠背部皮肤缺损伤伤口处GM-CSF表达的变化 Tab 1 Comparison of GM-CSF expression levels at injury sites between experimental group and control group during 7 days after injury |
2.3 rhGM-CSF凝胶对放射性复合切割伤残余面积的影响
如图 3所示,rhGM-CSF 6 000 ng/mL凝胶组与空白凝胶组在致伤后1~14 d伤口残余面积比均呈下降趋势,但rhGM-CSF凝胶组在伤后1~14 d内伤口残余面积比均小于空白凝胶组,其中第4~11天,凝胶组伤口残余面积优于对照组(P<0.05或P<0.01)。
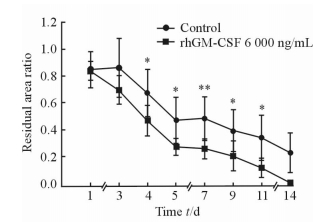
|
图 3 rhGM-CSF 6 000 ng/mL凝胶组和空白凝胶组在创伤14 d内小鼠背部皮肤缺损伤创面残余面积 Fig 3 Comparison of wound areas on mouse back between rhGM-CSF 6 000 ng/mL group and control group within 14 days after injury |
2.4 rhGM-CSF凝胶治疗后放射性复合切割伤中胶原纤维测定
Masson染色结果(图 4)显示:在创伤愈合14 d时,rhGM-CSF 6 000 ng/mL凝胶组伤口中,上皮增厚明显,创面胶原纤维着色深,分布广泛,排列紧密;而相较于rhGM-CSF 6 000 ng/mL凝胶组,空白凝胶组胶原纤维分布疏散,着色较浅,排列不紧密。
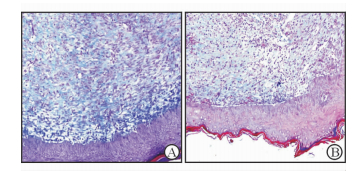
|
图 4 rhGM-CSF 6 000 ng/mL凝胶组(A)与空白凝胶组(B) 14 d时创面胶原纤维的测定 Fig 4 Masson staining of wound tissues at 14 d of injury between rhGM-CSF 6 000 ng/mL group (A)and control group (B) |
3 讨 论
创伤愈合是一个复杂的生物学过程,包括凝血、炎症、组织增生、改建与重塑等多个阶段[6],在此过程中多种细胞与细胞因子的相互作用共同促进了伤口的愈合,如中性粒细胞、单核巨噬细胞、血管内皮细胞以及TNF-α、GM-CSF、VEGF、PDGF等;当任何因素导致这些细胞分布异常或细胞因子表达异常时均会影响正常的伤口愈合过程。放射性复合伤是核能出现以来的一种新型的损伤,因暴露的皮肤组织或整个个体受到了核能射线的辐照损伤,导致放射性复合伤口的愈合过程与正常伤口存在明显的区别。在放射性复合伤口中,皮肤缺损伤口局部会发生细胞因子表达紊乱、角朊细胞增殖分化变缓、炎症细胞浸润减少、肉芽组织增生及血管生成异常等[4];对该类伤口中细胞因子表达的研究将有助于我们进一步认识放射性复合伤与普通单纯性损伤愈合过程的不同,为将来临床治疗放射性复合伤提供相应的理论基础。
研究发现,与单纯伤口相比,受到60Co γ射线一次性均匀照射的小鼠的伤口愈合撕裂强度明显降低,且随着照射剂量的增加,撕裂强度逐渐降低;照射后的小鼠伤口愈合明显延迟,伤口胶原纤维排列无序,组织疏松,成纤维细胞数量明显减少,愈合过程明显减缓[6]。而对于其中的机制,我们前期的研究结果显示,异常表达的PDGF-BB与TNF-α是导致伤口愈合缓慢的一个重要原因[7]。GM-CSF作为伤口愈合过程中一类重要的细胞因子,其在放射性复合伤中的表达情况以及对伤口愈合的影响当前还不是十分清楚,因此本研究着重探讨了GM-CSF与在放射性复合切割伤愈合过程的关系。
GM-CSF作为一种多功能的细胞因子,是创伤愈合过程的启动因子,在创伤愈合过程的各个阶段均发挥着重要的作用[8]。在伤口愈合止血期,GM-CSF可以促进嗜酸性粒细胞相关因子、组织因子等表达进而参与止血[9];在炎症期,GM-CSF可以通过加强趋化多种细胞,如单核/巨噬细胞、中性粒细胞、树突状细胞至创面,参与伤口炎症反应。此外,在增加创面炎症细胞浸润数量的同时,GM-CSF还可以活化中性粒细胞、巨噬细胞,提高其吞噬活性和杀菌能力[10];而在愈合过程的增生期,GM-CSF可以促进成纤维细胞、内皮细胞迁移与增殖,刺激角质细胞生长,诱导胶原蛋白分泌、沉积及促进新生血管形成等,最终将有助于创面肉芽组织形成,加速再上皮化过程,促进创面愈合。近来有研究发现,GM-CSF可以修复创伤愈合过程中某些免疫缺陷(IL-2合成下降、T细胞与粒细胞增殖与功能障碍等),从而证实GM-CSF除促进创伤愈合外还可以降低创伤导致的感染并发症;GM-CSF在创伤愈合过程中具有潜在的应用价值[11]。
在本研究中,我们从组织伤口中的基因及蛋白水平分析了放射性复合切割伤中GM-CSF表达水平。RT-PCR的结果显示,伤口愈合的1、3、5 d,放射性复合切割伤中GM-CSF mRNA的表达水平均低于对照组(P<0.05或P<0.01),在第7天随着对照组GM-CSF表达水平的下调二者之间差异无统计学意义。而免疫组化结果显示,GM-CSF蛋白水平的表达与分子水平的表达变化有着相似的趋势,即在放射性复合切割伤中GM-CSF表达相对较低,在第1、3天时二组差异有统计学意义(P<0.01),对照组中GM-CSF的表达在第1~3天呈现上升,于第3天达到最高峰,3~7 d呈下降趋势;而放射性复合切割伤中GM-CSF的表达水平的动态变化并不明显。进一步的rhGM-CSF凝胶治疗实验结果证实,rhGM-CSF凝胶可以明显改善放射性复合切割伤的愈合过程,提高伤口愈合质量。本研究结果表明,GM-CSF早期表达的下降可能是导致放射性复合伤愈合延迟的一个重要因素。其可能的机制是早期缺乏GM-CSF,导致放射性复合伤创面炎症反应减弱,影响中性粒细胞及巨噬细胞对创面坏死组织、失活细胞碎片、病菌、异物等吞噬,影响了伤口愈合的炎症阶段;此外,下调的GM-CSF可能也会导致成纤维细胞、内皮细胞等增殖减弱,抑制新生血管、胶原蛋白的形成,影响伤口愈合的增生重建阶段。
总之,本研究发现,在放射性复合切割伤愈合早期,GM-CSF表达水平低于单纯切割伤口,给予rhGM-CSF凝胶可以有效地促进放射性复合切割伤口的愈合。本文对GM-CSF在放射性复合切割伤愈合过程中作用的研究,将有助于进一步探讨电离辐射损伤对伤口愈合的影响机制,为临床治疗该类伤口提供新的思路。
| [1] | RUBBIA-BRANDT L, SAPPINO A P, GABBIANI G. Locally applied GM-CSF induces the accumulation of alpha-smooth muscle actin containing myofibroblasts[J]. Virchows Arch B Cell Pathol , 1991, 60 :73–82. DOI:10.1007/BF02899530 |
| [2] | UTENA H, EZOE T, KATO N, HADA H. Effects of chronic administration of methamphetamine in enzymic patterns in brain tissue[J]. J Neurochem , 1959, 4 :161–169. DOI:10.1111/jnc.1959.4.issue-2 |
| [3] | SMITH CH, ALLEN MH, GROVES RW, BARKER JN. Effect of granulocyte macrophage-colony stimulating factor on Langerhans cells in normal and healthy atopic subjects[J]. Br J Dermatol , 1998, 139 :239–246. DOI:10.1046/j.1365-2133.1998.02360.x |
| [4] | KIANG J G, GARRISON B R, BURNS T M, ZHAI M, DEWS I C, NEY P H, et al. Wound trauma alters ionizing radiation dose assessment[J]. Cell Biosci , 2012, 2 :20. DOI:10.1186/2045-3701-2-20 |
| [5] |
王国栋, 王良, 柏书博, 刘新元, 吴洋. γ射线全身照射降低小鼠切割伤愈合伤口撕裂强度[J]. 第二军医大学学报 , 2011, 32 :9–11.
WANG G D, WANG L, BAI S B, LIU X Y, WU Y. Total body γ-irradiation decreases wound breaking strength during wound healing in rats[J]. Acad J Sec Mil Med Univ , 2011, 32 :9–11. |
| [6] | GETHIN G. Understanding the inflammatory process in wound healing[J]. Br J Community Nurs , 2012 (Suppl) :S17–S18. |
| [7] |
王国栋, 王佳琪, 赵云富, 柏书博, 陈潇卿, 吴洋, 等. PDGF-BB、TNF-α参与电离辐射致小鼠皮肤创面愈合延迟[J]. 第二军医大学学报 , 2013, 34 :954–959.
WANG G D, WANG J Q, ZHAO Y F, BAI S B, CHEN X Q, WU Y, et al. PDGF-BB and TNF-α are involved in delayed skin wound healing in mice exposed to ionizing radiation[J]. Acad J Sec Mil Med Univ , 2013, 34 :954–959. |
| [8] | MALIK IA, ZAHID M, HAQ S, SYED S, MOID I, WAHEED I. Effect of subcutaneous injection of granulocyte-macrophage colony stimulating factor (GM-CSF) on healing of chronic refractory wounds[J]. Acta chirurgica , 1998, 164 :737–744. |
| [9] | KAPLAN G. Novel responses of human skin to intradermal recombinant granulocyte/macrophage-colony-stimulating factor: Langerhans cell recruitment, keratinocyte growth, and enhanced wound healing[J]. J Exp Med , 1992, 175 :1717–1728. DOI:10.1084/jem.175.6.1717 |
| [10] | MANN A, NIEKISCH K, SCHIRMACHER P, BLESSING M. Granulocyte-macrophage colony-stimulating factor is essential for normal wound healing[J]. J Investig Dermatol Symp Proc , 2006, 11 :87–92. DOI:10.1038/sj.jidsymp.5650013 |
| [11] | ZHANG L, CHEN J, HAN C. A multicenter clinical trial of recombinant human GM-CSF hydrogel for the treatment of deep second-degree burns[J]. Wound Repair Regen , 2009, 17 :685–689. DOI:10.1111/wrr.2009.17.issue-5 |
 2016, Vol. 37
2016, Vol. 37


