随着糖尿病病程的进展,糖尿病并发症的发生严重影响人类的生活质量,其中糖尿病肾病作为糖尿病微血管并发症之一,是导致终末期肾功能衰竭的最常见原因[1]。研究发现,虽然糖尿病患者循环内生长激素(growth hormone,GH)水平升高、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)水平降低,但其肾脏组织中GH、IGF-1水平均升高[2],两者具有促细胞增殖、分化等作用;同时高血糖刺激、GH等均可激活丝裂原活化蛋白激酶(mitogen-actived protein kinase, MAPK)家族信号通路,如胞外信号调节激酶(extracellular signal-regulated kianse, ERK)/ c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)/p38[3-4],提示其与肾脏肥大、细胞外基质(ECM)增多有关。本研究旨在观察津力达颗粒对1型糖尿病大鼠肾脏组织GH、IGF-1水平的影响及对肾脏的保护作用。
1 材料和方法 1.1 主要药品与试剂津力达颗粒和通心络超微粉由石家庄以岭药业有限公司提供;二甲双胍(0.85 g/片)购自中美上海施贵宝有限公司;沙格列汀(5 mg/片)购自阿斯利康制药有限公司;链脲佐菌素(streptozocin, STZ)、羟甲基纤维素钠、柠檬酸及柠檬酸钠均购自美国Sigma公司;反转录试剂盒、SYBR Green PCR试剂盒、BCA蛋白定量试剂盒购自Thermo公司;RNaseⅠ购自Fermentas公司;PCR引物购自上海捷瑞生物工程有限公司;ERK/p-ERK抗体、JNK/p-JNK抗体、p38/p-p38抗体、GAPDH抗体购自美国CST公司;羊抗兔HRP标记二抗、羊抗鼠HRP标记二抗购自碧云天生物科技公司;石蜡购自中国石油化工有限公司;氯仿、异丙醇、甲醛、二甲苯、无水乙醇、氨水、冰醋酸、甘油、10%水合氯醛等购自上海国药集团;中性树脂、苏木精、伊红购自上海长岛生物技术有限公司;RIPA组织细胞快速裂解液、DEPC处理水、PBS、中性树脂购自上海基尔顿生物科技有限公司;Masson染色试剂盒购自南京凯基生物科技发展有限公司;AB-PAS染色试剂盒购自北京雷根生物技术有限公司;普通饲料由第二军医大学实验动物中心提供。
1.2 动物模型制备与分组按照STZ诱导实验性糖尿病动物模型的方法制备1型糖尿病大鼠模型。60只成年雄性SD大鼠,体质量180~220 g,购自第二军医大学实验动物中心[许可证号:SCXK(沪)2012-0003],适应性饲养3 d后,禁食不禁水12 h,随机抽取5只作为正常对照组(NC组),其余大鼠则以60 mg/kg的STZ溶液腹腔注射(STZ溶于0.1 mmol/L柠檬酸钠缓冲液,pH 4.2~4.5,新鲜配制)。72 h后鼠尾静脉采血测血糖值,根据血糖≥16.7 mmol/L确定是否造模成功。将成模大鼠进行随机分组,分别为糖尿病模型组(DM组)、低剂量津力达组(JL组)、中剂量津力达组(JM组)、高剂量津力达组(JH组)、中剂量津力达+通心络组(JM+TXL组)、二甲双胍组(Met组)、沙格列汀组(Sax组),每组5只(去除造模失败、死亡鼠)。
1.3 药物干预与组织留取JL、JM和JH组分别给予0.75、1.5、3.0 g/kg的津力达颗粒,JM+TXL组给予1.5 g/kg津力达颗粒+0.4 g/kg通心络超微粉,Met组给予50 mg/kg二甲双胍,Sax组给予1 mg/kg沙格列汀。各组药物均溶于0.5%羟甲基纤维素钠后灌胃,DM组和NC组仅给予0.5%羟甲基纤维素钠(1 mL/100 g)灌胃。8周后全部大鼠(每组5只)禁食过夜后称量并记录。按0.4 mL/100 g的剂量腹腔注射10%水合氯醛麻醉大鼠,打开腹腔,迅速留取肾脏组织,部分放入10%甲醛液中固定,另一部分液氮速冻,-80℃保存。
1.4 实时定量PCR检测肾脏GH、IGF-1及相关因子mRNA的表达取大鼠肾脏皮质组织,用标准TRIzol法提取总RNA,将RNA用反转录酶反转录为cDNA,SYBR Green法实时定量PCR检测肾脏GH及其受体(GHR)、IGF-1及其受体(IGF-1R)、胰岛素样生长因子结合蛋白1(IGFBP-1)的表达,管家基因GAPDH作为内参。引物序列见表 1。
|
|
表 1 实时定量PCR所用引物序列 |
1.5 蛋白质印迹法检测肾脏MAPK系统通路相关蛋白、纤维连接蛋白(FN)的表达
分离肾脏皮质组织,剪碎、匀浆,提取组织样品并进行蛋白定量(562 nm)。PAGE分离蛋白样品,转膜,5%脱脂奶粉封闭,加入相应ERK、p-ERK、JNK、p-JNK、p38、p-p38、FN抗体孵育,显色。使用蛋白灰度分析软件检测目的蛋白条带灰度值并定量,结果以目的条带灰度值与内参GAPDH条带灰度值的比值来表示。
1.6 肾脏组织形态学改变用10%甲醛固定部分肾脏组织,常规洗涤、脱水、透明、浸蜡、包埋、切片后,分别行H-E染色、Masson染色和PSA染色,显微镜下观察组织并拍照。
1.7 统计学处理应用SPSS 19.0软件进行数据分析,数据用x±s表示,多组间比较采用单因素方差分析;两组间比较采用Dunnett-t检验,方差不齐时为Dunnett’s T3检验,检验水准(α)为0.05。
2 结果 2.1 糖尿病模型评估大鼠腹腔注射STZ 3 d后,鼠尾静脉血糖值高于16.7 mmol/L者可确定成模,本实验成模率100%。成模大鼠摄食量、饮水量增加,二便排泄增多,精神差,反应迟钝,毛发黯淡杂乱。随后每周监测大鼠血糖及体质量,血糖值均≥16.7 mmol/L,且体质量减轻。
2.2 各组大鼠肾脏GH、GHR、IGF-1、IGF-1R、IGFBP-1 mRNA的表达变化与NC组相比,DM组大鼠肾脏GH、GHR、IGF-1、IGF-1R、IGFBP-1 mRNA的表达升高(P < 0.01)。与DM组相比,JM组、JH组、JM+TXL组、Met组肾脏GH和IGF-1 mRNA的表达降低(P < 0.01),所有治疗组肾脏GHR mRNA的表达均降低(P < 0.01),JL组、JM组、JH组、JM+TXL组、Met组肾脏IGF-1R mRNA的表达均降低(P < 0.05,P < 0.01),JM+TXL组IGFBP-1 mRNA的表达降低(P < 0.05)。见图 1。

|
图 1 各组大鼠肾脏GH、GHR、IGF-1、IGF-1R、IGFBP-1 mRNA的表达水平 NC:正常对照组; DM:糖尿病组; JL: 0.75 g/kg津力达组; JM: 1.5 g/kg津力达组; JH: 3.0 g/kg津力达组; JM+T: 1.5 g/kg津力达颗粒+0.4 g/kg通心络超微粉组; Met: 50 mg/kg二甲双胍组; Sax: 1 mg/kg沙格列汀组. GH:生长激素; GHR:生长激素受体; IGF-1:胰岛素样生长因子1; IGF-1R:胰岛素样生长因子1受体; IGFBP-1:胰岛素样生长因子结合蛋白1. *P < 0.05, **P < 0.01与DM组比较; △△P < 0.01与NC组比较. n=5, x±s |
2.3 各组大鼠肾脏MAPK系统通路相关蛋白、FN的表达变化
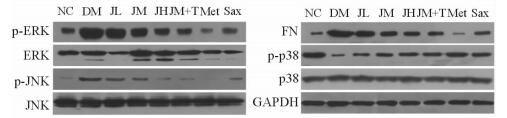
与NC组相比,DM组肾脏p-ERK/ERK、p-JNK/JNK比值和FN表达均升高,p-p38/p38比值降低。与DM组相比,JM、JH、JM+TXL、Met和Sax组p-ERK/ERK、p-JNK/JNK的比值均降低;所有治疗组p-p38/p38的比值均升高,而FN的表达均降低。见图 2。
|
图 2 各组大鼠肾脏MAPK系统通路相关蛋白、FN的表达 NC:正常对照组; DM:糖尿病组; JL: 0.75 g/kg津力达组; JM: 1.5 g/kg津力达组; JH: 3.0 g/kg津力达组; JM+TXL: 1.5 g/kg津力达颗粒+0.4 g/kg通心络超微粉组; Met: 50 mg/kg二甲双胍组; Sax: 1 mg/kg沙格列汀组. ERK:胞外信号调节激酶; JNK: c-Jun氨基末端激酶; FN:纤维连接蛋白 |
2.4 各组大鼠肾脏组织形态学改变
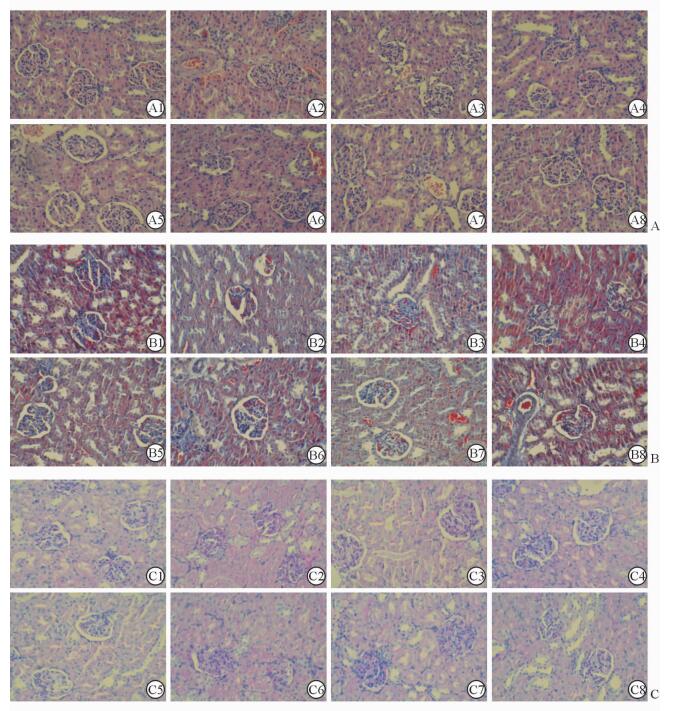
H-E染色(图 3A)镜下示NC组大鼠肾小球轮廓及周围肾小管结构清晰,细胞间界限清晰;DM组皮质变薄,肾小球轮廓不清、数量减少,肾小管结构模糊、细胞界限不清。Masson染色(图 3B)镜下示DM组相对于NC组肾小管-间质中蓝染部分增加,即发生胶质沉积和间质纤维化。PAS染色(图 3C)镜下示DM组肾小球内紫红色面积增加,肾小球系膜区增生,基底膜增厚。由各染色结果可见,JM、JL、JM+TXL组大鼠肾脏组织形态相较于DM组均有不同程度的改善。
|
图 3 各组大鼠肾脏组织H-E染色(A)、Masson染色(B)及PAS染色(C)结果 A1,B1,C1:正常对照组; A2, B2, C2:糖尿病组; A3, B3, C3: 0.75 g/kg津力达组; A4, B4, C4: 1.5 g/kg津力达组; A5, B5, C5: 3.0 g/kg津力达组; A6, B6, C6: 1.5 g/kg津力达颗粒+0.4 g/kg通心络超微粉组; A7, B7, C7: 50 mg/kg二甲双胍组; A8, B8, C8: 1 mg/kg沙格列汀组. Original magnification: ×200 |
3 讨论
糖尿病肾病作为糖尿病微血管并发症之一,其肾脏病理损伤包括早期肾小球高滤过、肾小球肥大、细胞外基质增厚、晚期肾小球纤维化等[5]。糖尿病肾病的发生和发展涉及多种机制,已有证据表明,GH和IGF在糖尿病肾病的发展中有重要作用[6]。GH/IGF-1系统各组成部分在肾脏中均有表达,通过多种途径参与糖尿病肾病的发生,如IGF-1可抑制NO合酶,降低肾小动脉阻力,增加肾小球滤过率[7];还可刺激肾小球系膜细胞有丝分裂,诱导细胞迁移及蛋白多糖、FN、Ⅳ型胶原纤维的合成[8-9]。虽然GH不直接影响肾脏血流动力学、细胞增殖及细胞外基质的产生,但其可通过IGF-1发挥作用[10]。此外,GH还存在一些IGF-1非依赖性作用,可能与肾小球硬化相关[11]。GH/IGF-1可激活Akt、MAPK、PI3K等多条信号通路,其中MAPK家族系统是促进细胞增殖和传导应激信号的主要通路,与糖尿病肾病的发生机制相关[12]。MAPK家族系统包括ERK、JNK、p38等蛋白,高血糖、生长因子、氧化应激、牵张刺激等均可激活MAPK通路,通过磷酸化作用激活下游转录因子(如STAT,c-jun,AP-1等),进而调节转化生长因子-β1(TGF-β1)等表达,影响细胞增殖、FN及Ⅳ型胶原的合成,从而促进糖尿病肾病的发生和发展[13-14]。
中医认为“消渴病”(糖尿病)起于“中焦”(脾,包含胰腺概念),脉络学认为“孙络-微血管”损伤时易壅滞、积瘀,从而导致孙络所处脏器组织发生病变[15]。津力达颗粒重在改善“脾”运化功能失调,继而使水津沿“孙络-微血管”输布至脏器,治疗微血管病变[16]。
本研究通过检测大鼠肾脏组织中GH、GHR、IGF-1、IGF-1R、IGFBP-1 mRNA的水平来反映GH/IGF-1系统在肾脏中的表达情况,发现DM组肾脏组织内GH、GHR、IGF-1、IGF-1R、IGFBP-1 mRNA的表达与NC组比较均升高,中或高剂量津力达颗粒治疗后,GH、GHR、IGF-1、IGF-1R mRNA的表达水平降低,表明GH、IGF-1及相关受体的高表达可能与糖尿病肾脏改变相关。此外,本研究通过检测大鼠肾脏组织MAPK通路相关蛋白及FN蛋白的表达来反映肾脏组织MAPK家族的激活状态及纤维化程度,发现DM组pERK/ERK、pJNK/JNK比值及FN蛋白的表达与NC组比较均升高,而加入中、高剂量津力达颗粒治疗后,ERK、JNK的磷酸化水平及FN蛋白的表达均降低,表明津力达颗粒可能通过抑制ERK、JNK通路的激活来减少细胞外基质(包括FN)的生成。本研究3种肾脏病理染色结果均表明津力达颗粒可抑制肾小球细胞增殖、基底膜增厚及肾小球纤维化。另JM+TXL组对肾脏GH、GHR、IGF-1、IGF-1R、IGFBP-1 mRNA表达的抑制作用大于JM组,提示通心络可能也具有与津力达颗粒相似的作用,两药合用具有协同作用。
综上所述,津力达颗粒可降低糖尿病大鼠肾脏GH、IGF-1表达,抑制ERK、JNK通路的激活从而减少细胞外基质的生成,具有肾脏保护作用。
| [1] | SHAW J E, SICREE R A, ZIMMET P Z. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract , 2010, 87 :4–14. DOI:10.1016/j.diabres.2009.10.007 |
| [2] | BACH L A, HALE L J. Insulin-like factors and kidney disease[J]. Am J Kidney Dis , 2014, 65 :327–336. |
| [3] | LANDAU D, ESHET R, TROIB A, GURMAN Y, CHEN Y, RABKIN R, et al. Increased renal Akt/mTOR and MAPK signaling in typeⅠ diabetes in the absence of IGF type 1 receptor activation[J]. Endocrine , 2009, 36 :126–134. DOI:10.1007/s12020-009-9190-2 |
| [4] | 宋志霞, 张晓良. 生长激素-胰岛素样生长因子-1轴在糖尿病肾病发生发展中的作用[J]. 中华临床医师杂志:电子版 , 2013, 7 :231–234. |
| [5] | BRODIUS F C 3rd. Trophic factors and cytokines in early diabetic glomerulopathy[J]. Exp Diabesity Res , 2003, 4 :225–233. DOI:10.1155/EDR.2003.225 |
| [6] | RABIN R, SCHAEFER F. New concepts: growth hormone, insulin-like growth factor-Ⅰand the kidney[J]. Growth Horm IGF Res , 2004, 14 :270–276. DOI:10.1016/j.ghir.2004.02.001 |
| [7] | LEVIN-IAINA N, IAINA A, RAZ I. The emerging role of NO and IGF-1 in early renal hypertrophy in STZ-induced diabetic rats[J]. Diabetes Metab Res Rev , 2011, 27 :235–243. DOI:10.1002/dmrr.v27.3 |
| [8] | GOOCH J L, TANG Y, RICONO J M, ABBOUD H E. Insulin-like growth factor-Ⅰ induces renal cell hypertrophy via a calcineurin-dependent mechanism[J]. J Biol Chem , 2001, 276 :42492–42500. DOI:10.1074/jbc.M102994200 |
| [9] | HAYLOR J, HICKLING H, EL ETERE, MOIR A, OLDROYD S, HARDISTY C, et al. JB3, an IGF-1 receptor antagonist, inhibits early renal growth in diabetic and uninephrectomized rats[J]. J Am Soc Nephrol , 2000, 11 :2027–2035. |
| [10] | FELD S, HIRSCHBERG R. Growth hormone, the insulin-like growth factor system, and the kidney[J]. Endocr Rev , 1996, 17 :423–480. |
| [11] | BAUD L, FOUQUERAY B, BELLOCQ A, DOUBLIER S, DUMOULIN A. Growth hormone and somatostatin in glomerular injury[J]. J Nephrol , 1999, 12 :18–23. |
| [12] | KANG S W, ADLER S G, LAPAGE J, NATARAJAN R. p38 MAPK and MAPK kinase 3/6 mRNA and activities are increased in early diabetic glomeruli[J]. Kidney Int , 2001, 60 :543–552. DOI:10.1046/j.1523-1755.2001.060002543.x |
| [13] | RANE M J, SONG Y, JIN S, BARATI M T, WU R, KAUSAR H, et al. Interplay between Akt and p38 MAPK pathways in the regulation of renal tubular cell apoptosis associated with diabetic nephropathy[J]. Am J Physiol Renal Physiol , 2010, 298 :49–61. DOI:10.1152/ajprenal.00032.2009 |
| [14] | 王丽晖, 段惠军. MAPK信号转导途径与糖尿病肾病[J]. 国外医学(内科学分册) , 2005, 32 :234–237. |
| [15] | 吴以岭. 消渴病从脾论治探讨[J]. 中医杂志 , 2002, 43 :410–411. |
| [16] | 庞洁, 魏聪, 高怀林, 吴以岭. 脉络学说指导2型糖尿病胰岛微血管病变防治[J]. 中医杂志 , 2014, 55 :1011–1014. |
 2016, Vol. 37
2016, Vol. 37


