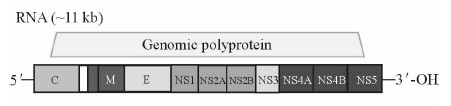
寨卡病毒(Zika virus,ZIKV)是一种有包膜的单正链RNA病毒,黄病毒科黄病毒属,主要通过埃及伊蚊传播。病毒基因组全长10 794 bp,含位于序列两端的2个非编码区和1个开放阅读框(open reading frame,ORF)[1],编码3 419个氨基酸,生成3个结构蛋白和7个非结构蛋白。如图 1所示,结构蛋白分别是衣壳蛋白(105 aa)、膜蛋白/膜蛋白前体(187 aa)和包膜蛋白(505 aa),非结构蛋白分别是NS1(352 aa)、NS2A(217 aa)、NS2B(139 aa)、NS3(619 aa)、NS4A(127 aa)、NS4B(255 aa)和NS5(904 aa)[2]。包膜蛋白E是病毒表面的主要蛋白,介导锚定和膜融合,参与病毒的生命周期。NS5是寨卡病毒相对分子质量最大的蛋白(103 000),其C末端含有RdRp(RNA-dependent RNA polymerase)活性位点,N末端具有甲基化酶活性,帮助病毒RNA加帽。寨卡病毒基因3′非编码区共有428个核苷酸,包含27个可折叠部分,其功能涉及细胞膜表面识别、RNA稳定、翻译、修饰以及环化等[1]。
|
图 1 寨卡病毒基因组组成 Fig 1 Genomic structure of Zika virus |
寨卡病毒于1947年在乌干达寨卡森林(Zika forest)的一只恒河猴身上分离出来[1],随后在同一片森林的埃及伊蚊中也分离到该病毒[3]。1954年首次报道了人类寨卡病毒感染病例[4]。寨卡病毒自20世纪中期被发现以来发生了多次适应性基因突变。最值得注意的是,与原型株(1947年分离的MR766株)相比,当前流行株包膜蛋白E的N154糖基化位点上出现了4个氨基酸(12个碱基)的插入突变,这4个氨基酸位点在许多其他虫媒病毒中均可见到,其功能可能与病毒致病力相关[1]。
1 流行趋势寨卡病毒是人类寨卡病毒病的病原体。1954年,尼日利亚首先报道了3例人感染寨卡病毒病例[4]。2007年以前,寨卡病毒感染病例主要集中于非洲的埃及、中非共和国、坦桑尼亚、乌干达、塞拉利昂以及亚洲的泰国、柬埔寨、印度尼西亚、印度、菲律宾和越南等国,被证实的人感染寨卡病毒病例仅14例[5]。2007年4—7月,位于西太平洋密克罗尼西亚的雅浦(Yap)岛上185例患者出现发热、头痛、皮疹、结膜炎和关节痛等症状,其中49例确诊为寨卡病毒感染病例,59例为寨卡病毒感染疑似病例,没有住院和死亡的严重病例[5]。2007年以后,泰国、柬埔寨、印度尼西亚、印度、菲律宾和越南等国常有散发病例出现但没有大的疫情暴发。
2013—2014年,法属波利尼西亚出现了寨卡病毒大流行,估计约11%的当地居民被感染。2014年欧洲疾病预防和控制中心确认了太平洋复活节岛1例确诊病例和40例疑似病例[6]。2015年寨卡病毒开始在美洲、西太平洋、非洲及亚洲暴发流行,至2016年3月底,已累计有超过55个国家和地区报告发生寨卡病毒本地传播。我国已将寨卡病毒病列为第二类法定传染病,截止到2016年6月7日一共报告了18例输入性寨卡病毒感染病例。
2014年,寨卡病毒的传播路径为:向东穿越太平洋的法属波利尼西亚,然后到复活节岛,并在2015年到达南美洲、中美洲和加勒比海地区,现在认为中南美洲处在大流行阶段。2015年,已经有9个国家出现了原发性寨卡病毒感染病例,分别是巴西、智利、哥伦比亚、萨尔多瓦、危地马拉、墨西哥、巴拉圭、苏里南和委内瑞拉。截止到2016年1月已经在美洲的23个国家发现了寨卡病毒感染病例[7]。2014—2015年,巴西寨卡病毒感染呈现大流行趋势,确诊病例呈指数式增长。世界卫生组织预计,美洲可能出现多达400万例感染者,其中巴西的感染人数可能会上升到50万~150万[8]。同期巴西出现多例新生儿小头畸形病例。2014年11月,科学家从巴西东北部的1例先天性小头症的新生儿脑内分离出寨卡病毒[9]。2015年10月—2016年1月,巴西共报告约4 000例新生儿小头症病例,比2013年的147例及2014年的167例增加了约25倍[9]。2016年1月,美国本土出现首例与寨卡病毒相关的新生儿小头症病例。目前已有研究证实新生儿小头症与寨卡病毒感染相关[8, 10-12]。
2 临床表现和致病机制寨卡病毒病是自限性疾病,潜伏期为3~12d[13]。患者、隐性感染者和感染寨卡病毒的灵长类动物是该病的传染源[14]。人感染寨卡病毒后,仅约20%会出现症状,且症状较轻,临床表现与其他已知虫媒病毒如登革病毒、西尼罗病毒及基孔肯亚病毒等感染相似。
世界上第1例有完整医学报道的寨卡病毒病患者是乌干达东非病毒研究中心(East African Virus Research Institute)的研究人员Simpson,其临床症状起初为轻微头痛,随后面部、颈部、躯干及上身出现丘疹,并发展至手掌和脚掌,同时伴有发热及背痛;次日症状减轻,丘疹开始消退,3 d后基本恢复正常。随后从其发热期间血清样本中分离到寨卡病毒[15]。1973年,Filipe等[16]报道了第1个实验室寨卡病毒感染病例,患者伴有短时高热、头痛及关节痛,但没出现丘疹。Olson等[17]报道印度尼西亚寨卡病毒感染病例不仅有发热,而且伴有厌食、腹泻、便秘、腹痛及头晕等症状。2007年太平洋西部雅浦岛(Yap)暴发的寨卡病毒病临床症状主要表现为皮疹、结膜炎和关节痛;其他非典型症状包括肌痛、头痛、水肿及呕吐等[5],重症患者可出现格林-巴利综合征(Guillain-Barrésyndrome,GBS)。2015年在中南美洲肆虐的寨卡病毒主要临床症状为皮疹、关节痛、结膜炎等,同时还集中暴发了新生儿小头畸形病例,患儿往往伴有大脑发育不全[18]。一般来说,寨卡病毒感染者病程会持续2~7 d。
寨卡病毒致病机制尚不明确,一般认为蚊媒传播的黄病毒科病毒都是在最初感染部位的树突状细胞内复制,随后扩散到淋巴结和血液中。但与黄病毒科病毒通常在细胞质中复制不同,寨卡病毒感染的细胞核内也存在寨卡病毒抗原,说明寨卡病毒可能进入细胞核内复制[19]。
3 诊断和治疗我国于2016年3月颁布了“寨卡病毒病诊疗方案”(2016年第2版)。寨卡病毒诊断主要依赖PCR法检测病毒RNA和免疫组化法检测病毒抗原,通常认为病毒血症持续时间为感染后3~5 d;也有报道在感染后10 d仍然检测到病毒核酸[20]。目前,我国已研制出荧光定量PCR和恒温扩增微流控芯片核酸检测试剂。病毒分离培养可用蚊源细胞(C6/36)或Vero细胞等,也可使用乳鼠脑内接种进行病毒分离。
寨卡病毒也可用ELISA和免疫荧光血清学的方法进行鉴定,美国疾病控制与预防中心等少数几个实验室已开展血清免疫学检测[21]。患者通常在感染3~8 d后检测到IgM型抗体,由于寨卡病毒抗体与登革病毒、黄热病毒和西尼罗病毒抗体等有交叉反应活性,容易产生假阳性。所以ELISA检测的特异性和敏感性仍存在一定的问题,ELISA阳性样本通常需要用空斑减少中和试验(plaque reduction neutralization test,PRNT)进行确认。对于IgG型抗体检测,需要同时做登革病毒抗体的对照,只有寨卡病毒抗体阳性并且其抗体滴度比登革抗体滴度上升4倍以上时才认为有意义。寨卡病毒不耐酸、不耐热,60℃30 min即可灭活,70%乙醇、1%次氯酸钠、脂溶剂、过氧乙酸等消毒剂及紫外线照射均可灭活[22]。目前尚没有寨卡病毒疫苗,也没有特异抗病毒药物。
4 传播途径已确定寨卡病毒主要通过埃及伊蚊传播,白纹伊蚊、非洲伊蚊和黄头伊蚊也可能传播该病毒。亦可通过母婴传播,包括宫内感染和分娩时感染,乳汁中可检测到寨卡病毒核酸,但尚无通过哺乳感染新生儿的报道。Boorman等[20]证实,在实验条件下寨卡病毒可通过埃及伊蚊感染小鼠和猴,野生寨卡病毒在蚊体的保存时间约为10 d。携带寨卡病毒的蚊经过10 d左右人工饲养后,病毒载量会下降到检测阈值以下,然而在15 d以后病毒载量又开始上升,在第20~60天期间一直保持较高水平。目前尚不清楚埃及伊蚊是否能在病毒检测阈值以下时传播寨卡病毒。有研究显示在啮齿动物中检测到寨卡病毒抗体[23],因此需要进一步确定寨卡病毒是否有节肢动物宿主或中间媒介。另有研究显示性传播也是寨卡病毒传播方式之一[24]。而且Musso等[25]证实寨卡病毒感染者的精液中含有很高的寨卡病毒RNA,同时也在其精液中分离出了寨卡病毒,而同期的血液中却没有检测到寨卡病毒的RNA,更加说明寨卡病毒可通过性接触传播。人群对寨卡病毒普遍易感,感染后可获得持久的终生免疫,目前没有感染后再次感染的报道。大多数虫媒病毒的流行发生在嗜血的节肢动物宿主或者易感的脊椎动物之间。人类通常是这些病毒的最终宿主,同西尼罗病毒、基孔肯亚病毒、登革病毒等一样,寨卡病毒能够在被感染者的血液中持续产生足够高滴度的病毒感染传播宿主[26]。Besnard等[27]报道了2013年10月和2014年2月法属玻利尼西亚发生的2例寨卡病毒母婴传播的病例,证明寨卡病毒可以透过胎盘屏障感染胎儿。最新研究显示,尿液中寨卡病毒滴度和持续时间都高于血液,因此可用尿液样本对寨卡病毒病患者进行诊断[28]。也有文献报道部分寨卡病毒感染者的血液样本寨卡病毒RNA阴性的同期唾液样本中检测到寨卡病毒的RNA[29],因此唾液检测也可作为寨卡病毒检测的辅助手段之一。
5 预防措施蚊虫是寨卡病毒主要传播媒介,控制蚊虫滋生是寨卡病毒病的防控重点。控制蚊虫滋生有物理、化学和生物的方法[30]。物理方法主要是清除不必要的暴露水源,保持环境卫生,以减少蚊虫的滋生地。化学方法主要是使用化学药物如菊酯类、有机氯化物、有机磷化物等,作用于蚊虫神经系统而起杀灭效果。该类方法最大缺点是可能会导致蚊虫耐药性发生以及对高等哺乳动物产生毒性[13]。避蚊胺(N, N-diethyl-meta-toluamide,DEET)以及羟乙基哌啶羧酸异丁酯(picaridin)可作为孕妇的安全驱蚊药物[31]。生物方法主要是抑制蚊受精卵的形成,这也是目前的研究热点。有研究证实Asaia细菌可以感染蚊的肠道,并在蚊间垂直传播,从而抑制蚊的繁殖[32];而沃尔巴克体则通过雌性化雄蚊,使雌蚊不能受精而减少其繁殖[33]。其他的方法包括在环境中释放基因工程改造的雄性不育的蚊从而达到抑制蚊繁殖的目的[34]等。在大开曼岛(Grand Cayman)的研究显示,通过释放雄性不育的埃及伊蚊使当地埃及伊蚊的种群密度下降了80%[35]。
孕妇应避免前往寨卡病毒流行的国家和地区旅行,防止寨卡病毒感染。性传播也是寨卡病毒的传播方式之一,从疫区归来的人应禁欲4周以上,避免将病毒传染给伴侣[36]。目前我国报道的病例均为输入性病例,但由于埃及伊蚊和白纹伊蚊在我国南方地区有较高分布密度,随着气温升高,蚊虫类活动加剧,我国爆发寨卡病毒感染的风险不容忽视[37]。2016年夏季奥林匹克运动会即将在巴西举行,疫区人员流动将加剧,应当紧密监测巴西及南美归国人员健康情况,及早做出诊断[38],以防寨卡病毒在我国流行。
6 最新研究进展2016年2月,我国军事医学科学院完成了世界上首例患者尿液样本中寨卡病毒的全基因测序,为病毒溯源研究提供了重要证据[39]。Delvecchio等[40]体外实验证实治疗疟疾的氯喹(chloroquine)具有抗寨卡病毒作用。Miner等[41]构建了一种宫内传播寨卡病毒的小鼠模型,实验中寨卡病毒可通过血液迁移到孕鼠胎盘,并在胎盘中复制,最终扩散到胎鼠体循环并感染胎鼠大脑,为研发寨卡病毒疫苗和治疗方法提供了新思路。Qian等[42]通过3D打印技术培育出了一种由人体多能干细胞制成只有绿豆大小的“迷你大脑”模型,这种模型和发育中的胎儿大脑很相似并且可在体外培养长达20周。通过此模型研究人员准确“看见”怀孕不同阶段寨卡病毒感染的情况并证实寨卡病毒会感染胎儿大脑皮质的特殊的干细胞。Cugola等[43]首次给出直接实验证据证明寨卡病毒可以引发严重的婴儿出生缺陷。研究人员通过小鼠模型、人干细胞和体外培养的“微型脑结构”3个层面证实了该结论。Pardee等[44]开发出了基于CRISPR/Cas9系统的低成本快速诊断试纸,可以特异性筛查血液、尿液和唾液样本中的寨卡病毒。Dutra等[45]证实携带沃尔巴克体的蚊再感染寨卡病毒时,其唾液和机体中病毒颗粒数目明显降低,并且感染人的能力也明显下降,提示沃尔巴克体或许可以帮助抵御蚊虫传播寨卡病毒,为寨卡病毒防控提供了新思路。
7 展望2007年以前仅有零星的寨卡病毒感染的散发病例报道,2007年4月雅浦岛暴发流行后,人们才开始认识到寨卡病毒的危害。与大多数黄病毒一样,寨卡病毒感染症状通常轻微。由于寨卡病毒的流行病特征与登革病毒高度类似,诊断上很容易与登革病毒等其他黄病毒感染混淆,临床上应仔细鉴别。最新研究显示,寨卡病毒可在孕妇妊娠期间透过胎盘感染胎儿[41-42],这被认为可能是巴西新生儿小头症激增的原因。根据包膜蛋白或非结构蛋白NS5序列差异,可将寨卡病毒分为亚洲型和非洲型[1],本次美洲流行的毒株为亚洲型。研究寨卡病毒传播途径及对人类健康的影响需要临床、公共卫生中心及实验室的通力合作。伊蚊在我国也有分布,其中埃及伊蚊主要分布于海南省、广东省雷州半岛以及云南省的西双版纳州、德宏州、临沧市等地区;白纹伊蚊则广泛分布于我国河北、山西、陕西以南广大区域[37]。虽然迄今寨卡病毒主要在赤道附近流行,我国还未报告本地感染病例,但暴发风险不可忽视,应有详细应急预案,并做好相关基础研究和技术、资源储备。
| [1] | FAYE O, FREIRE C C, IAMARINO A, FAYE O, DE OLIVEIRA J V, DIALLO M, et al. Molecular evolution of Zika virus during its emergence in the 20th century[J]. PLoS Negl Trop Dis , 2014, 8 :e2636. DOI:10.1371/journal.pntd.0002636 |
| [2] | MARANO G, PUPELLA S, VAGLIO S, LIUMBRUNO G M, GRAZZINI G. Zika virus and the never-ending story of emerging pathogens and transfusion medicine[J]. Blood Transfus , 2016, 14 :95–100. |
| [3] | HADDOW A J, WILLIAMS M C, WOODALL J P, SIMPSON D I, GOMA L K. Twelve Isolations of Zika virus from Aedes (Stegomyia) Africanus (Theobald) taken in and above a Uganda forest[J]. Bull World Health Organ , 1964, 31 :57–69. |
| [4] | MACNAMARA F N. Zika virus:a report on three cases of human infection during an epidemic of jaundice in Nigeria[J]. Trans R Soc Trop Med Hyg , 1954, 48 :139–145. DOI:10.1016/0035-9203(54)90006-1 |
| [5] | DUFFY M R, CHEN T H, HANCOCK W T, POWERS A M, KOOL J L, LANCIOTTI R S, et al. Zika virus outbreak on Yap Island, Federated States of Micronesia[J]. New Engl J Med , 2009, 360 :2536–2543. DOI:10.1056/NEJMoa0805715 |
| [6] | CAO-LORMEAU V M, BLAKE A, MONS S, LASTÈRE S, ROCHE C, VANHOMWEGEN J, et al. Guillain-Barré syndrome outbreak associated with Zika virus infection in French Polynesia:a case-control study[J]. Lancet , 2016, 387 :1531–1539. DOI:10.1016/S0140-6736(16)00562-6 |
| [7] | SAMARASEKERA U, TRIUNFOL M. Concern over Zika virus grips the world[J]. Lancet , 2016, 387 :521–524. DOI:10.1016/S0140-6736(16)00257-9 |
| [8] | MLAKAR J, KORVA M, TUL N, POPOVIĆ M, POLJŠAK-PRIJATELJ M, MRAZ J, et al. Zika virus associated with microcephaly[J]. New Engl J Med , 2016, 374 :951–958. DOI:10.1056/NEJMoa1600651 |
| [9] | MARTINES R B, BHATNAGAR J, KEATING M K, SILVA-FLANNERY L, MUEHLENBACHS A, GARY J, et al. Notes from the field:evidence of Zika virus infection in brain and placental tissues from two congenitally infected newborns and two fetal losses-Brazil, 2015[J]. MMWR Morb Mortal Wkly Rep , 2016, 65 :159–160. DOI:10.15585/mmwr.mm6506e1 |
| [10] | JOHANSSON MA, MIER-Y-TERAN-ROMERO L, REEFHUIS J, GILBOA S M, HILLS S L. Zika and the risk of microcephaly[J]. New Engl J Med , 2016 . |
| [11] | BURKE R M, PANDYA P, NASTOULI E, GOTHARD P. Zika virus infection during pregnancy:what, where, and why?[J]. Br J Gen Pract , 2016, 66 :122–123. DOI:10.3399/bjgp16X683917 |
| [12] | ADIBI J J, MARQUES E T Jr, CARTUS A, BEIGI R H. Teratogenic effects of the Zika virus and the role of the placenta[J]. Lancet , 2016, 387 :1587–1590. DOI:10.1016/S0140-6736(16)00650-4 |
| [13] | KORZENIEWSKI K, JUSZCZAK D, ZWOLINŃSKA E. Zika-another threat on the epidemiological map of the world[J]. Int Marit Health , 2016, 67 :31–37. DOI:10.5603/IMH.2016.0007 |
| [14] | IOOS S, MALLET H P, LEPARC GOFFART I, GAUTHIER V, CARDOSO T, HERIDA M. Current Zika virus epidemiology and recent epidemics[J]. Med Mal Infect , 2014, 44 :302–307. DOI:10.1016/j.medmal.2014.04.008 |
| [15] | SIMPSON D I. Zika virus infection in man[J]. Trans R Soc Trop Med Hyg , 1964, 58 :335–338. DOI:10.1016/0035-9203(64)90200-7 |
| [16] | FILIPE A R, MARTINS C M, ROCHA H. Laboratory infection with Zika virus after vaccination against yellow fever[J]. Arch Gesamte Virusforsch , 1973, 43 :315–319. DOI:10.1007/BF01556147 |
| [17] | OLSON J G, KSIAZEK T G, SUHANDIMAN, TRIWIBOWO. Zika virus, a cause of fever in Central Java, Indonesia[J]. Trans R Soc Trop Med Hyg , 1981, 75 :389–393. DOI:10.1016/0035-9203(81)90100-0 |
| [18] | HEYMANN D L, HODGSON A, SALL A A, FREEDMAN D O, STAPLES J E, ALTHABE F, et al. Zika virus and microcephaly:why is this situation a PHEIC?[J]. Lancet , 2016, 387 :719–221. DOI:10.1016/S0140-6736(16)00320-2 |
| [19] | BUCKLEY A, GOULD E A. Detection of virus-specific antigen in the nuclei or nucleoli of cells infected with Zika or Langat virus[J]. J Gen Virol , 1988, 69 (Pt 8) :1913–1920. |
| [20] | BOORMAN J P, PORTERFIELD J S. A simple technique for infection of mosquitoes with viruses; transmission of Zika virus[J]. Trans R Soc Trop Med Hyg , 1956, 50 :238–242. DOI:10.1016/0035-9203(56)90029-3 |
| [21] | LANCIOTTI R S, KOSOY O L, LAVEN J J, VELEZ J O, LAMBERT A J, JOHNSON A J, et al. Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007[J]. Emerg Infect Dis , 2008, 14 :1232–1239. DOI:10.3201/eid1408.080287 |
| [22] | DICK G W. Zika virus.Ⅱ. Pathogenicity and physical properties[J]. Trans R Soc Trop Med Hyg , 1952, 46 :521–534. DOI:10.1016/0035-9203(52)90043-6 |
| [23] | KUNO G, CHANG G J. Biological transmission of arboviruses:reexamination of and new insights into components, mechanisms, and unique traits as well as their evolutionary trends[J]. Clin Microbiol Rev , 2005, 18 :608–637. DOI:10.1128/CMR.18.4.608-637.2005 |
| [24] | FOY B D, KOBYLINSKI K C, CHILSON FOY J L, BLITVICH B J, TRAVASSOS DA ROSA A, HADDOW A D, et al. Probable non-vector-borne transmission of Zika virus, Colorado, USA[J]. Emerg Infect Dis , 2011, 17 :880–882. DOI:10.3201/eid1705.101939 |
| [25] | MUSSO D, ROCHE C, ROBIN E, NHAN T, TEISSIER A, CAO-LORMEAU V M. Potential sexual transmission of Zika virus[J]. Emerg Infect Dis , 2015, 21 :359–361. DOI:10.3201/eid2102.141363 |
| [26] | FAYE O, FAYE O, DIALLO D, DIALLO M, WEIDMANN M, SALL A A. Quantitative real-time PCR detection of Zika virus and evaluation with field-caught mosquitoes[J]. Virol J , 2013, 10 :311. DOI:10.1186/1743-422X-10-311 |
| [27] | BESNARD M, LASTERE S, TEISSIER A, CAO-LORMEAU V, MUSSO D. Evidence of perinatal transmission of Zika virus, French Polynesia, December 2013 and February 2014[J]. Euro Surveill , 2014, 19 :20751. DOI:10.2807/1560-7917.ES2014.19.13.20751 |
| [28] | GOURINAT A C, O'CONNOR O, CALVEZ E, GOARANT C, DUPONT-ROUZEYROL M. Detection of Zika virus in urine[J]. Emerg Infec Dis , 2015, 21 :84–86. DOI:10.3201/eid2101.140894 |
| [29] | MUSSO D, ROCHE C, NHAN T X, ROBIN E, TEISSIER A, CAO-LORMEAU V M. Detection of Zika virus in saliva[J]. J Clin Virol , 2015, 68 :53–55. DOI:10.1016/j.jcv.2015.04.021 |
| [30] | ARAÚJO H R, CARVALHO D O, IOSHINO R S, COSTA-DA-SILVA A L, CAPURRO M L. Aedes aegypti control strategies in Brazil:incorporation of new technologies to overcome the persistence of Dengue epidemics[J]. Insects , 2015, 6 :576–594. DOI:10.3390/insects6020576 |
| [31] | KLINE M W, SCHUTZE G E. What pediatricians and other clinicians should know about Zika virus[J]. JAMA Pediatr , 2016, 170 :309–310. DOI:10.1001/jamapediatrics.2016.0429 |
| [32] | DAMIANI C, RICCI I, CROTTI E, ROSSI P, RIZZI A, SCUPPA P, et al. Paternal transmission of symbiotic bacteria in malaria vectors[J]. Curr Biol , 2008, 18 :R1087–R1088. DOI:10.1016/j.cub.2008.10.040 |
| [33] | BRELSFOARD C L, ST CLAIR W, DOBSON S L. Integration of irradiation with cytoplasmic incompatibility to facilitate a lymphatic filariasis vector elimination approach[J]. Parasit Vectors , 2009, 2 :38. DOI:10.1186/1756-3305-2-38 |
| [34] | ALPHEY L. Genetic control of mosquitoes[J]. Annu Rev Entomol , 2014, 59 :205–224. DOI:10.1146/annurev-ento-011613-162002 |
| [35] | HARRIS A F, MCKEMEY A R, NIMMO D, CURTIS Z, BLACK I, MORGAN S A, et al. Successful suppression of a field mosquito population by sustained release of engineered male mosquitoes[J]. Nat Biotechnol , 2012, 30 :828–830. DOI:10.1038/nbt.2350 |
| [36] | OSTER A M, BROOKS J T, STRYKER J E, KACHUR R E, MEAD P, PESIK N T, et al. Interim guidelines for prevention of sexual transmission of Zika virus-United States, 2016[J]. MMWR Morb Mortal Wkly Rep , 2016, 65 :120–121. DOI:10.15585/mmwr.mm6505e1 |
| [37] | LIUZZI G, NICASTRI E, PURO V, ZUMLA A, IPPOLITO G. Zika virus in saliva-new challenges for prevention of human to human transmission[J]. Eur J Intern Med , 2016 . |
| [38] | BOGOCH I I, BRADY O J, KRAEMER M U, GERMAN M, CREATORE M I, KULKARNI M A, et al. Anticipating the international spread of Zika virus from Brazil[J]. Lancet , 2016, 387 :335–336. DOI:10.1016/S0140-6736(16)00080-5 |
| [39] | ZHANG F C, LI X F, DENG Y Q, TONG Y G, QIN C F. Excretion of infectious Zika virus in urine[J]. Lancet Infect Dis , 2016, 16 :641–642. DOI:10.1016/S1473-3099(16)30070-6 |
| [40] | DELVECCHIO R, HIGA L M, PEZZUTO P, VALADAO A L, GARCEZ P P, MONTEIRO F L, et al. Chloroquine inhibits Zika virus infection in different cellular models[J/OL]. BioRxiv, 2016. doi:http://dx.doi.org/10.1101/051268 |
| [41] | MINER J J, CAO B, GOVERO J, SMITH A M, FERNANDEZ E, CABRERA O H, et al. Zika virus infection during pregnancy in mice causes placental damage and fetal demise[J]. Cell , 2016, 165 :1081–1091. DOI:10.1016/j.cell.2016.05.008 |
| [42] | QIAN X, NGUYEN H N, SONG M M, HADIONO C, OGDEN S C, HAMMACK C, et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure[J]. Cell , 2016, 165 :1238–1254. DOI:10.1016/j.cell.2016.04.032 |
| [43] | CUGOLA F R, FERNANDES I R, RUSSO F B, FREITAS B C, DIAS J L, GUIMARÃES K P, et al. The Brazilian Zika virus strain causes birth defects in experimental models[J]. Nature , 2016, 534 :267–271. |
| [44] | PARDEE K, GREEN A A, TAKAHASHI M K, BRAFF D, LAMBERT G, LEE J W, et al. Rapid, low-cost detection of Zika virus using programmable biomolecular components[J]. Cell , 2016, 165 :1255–1266. DOI:10.1016/j.cell.2016.04.059 |
| [45] | DUTRA H L, ROCHA M N, DIAS F B, MANSUR S B, CARAGATA E P, MOREIRA L A. Wolbachia blocks currently circulating Zika virus isolates in Brazilian Aedes aegypti mosquitoes[J]. Cell Host Microbe , 2016, 19 :771–774. DOI:10.1016/j.chom.2016.04.021 |
 2016, Vol. 37
2016, Vol. 37


