2. 第二军医大学基础部生物物理学教研室, 上海 200433;
3. 中国科学院上海微系统与信息技术研究所, 信息功能材料国家重点实验室, 上海 200050
2. Department of Biophysics, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China;
3. State Key Laboratory of Functional Materials for Informatics, Shanghai Institute of Microsystem and Information Technology, Chinese Academy of Sciences, Shanghai 200050, China
碳纳米管(carbon nanotubes, CNTs)是碳的一种同素异形体,呈圆筒状,直径尺寸在纳米级别,长度通常为微米级。按组成碳原子层的数目,可将CNTs分为2种:单壁碳纳米管(single-wall carbon nanotubes, SWCNTs)和多壁碳纳米管(multi-wall carbon nanotubes, MWCNTs)[1]。因为CNTs具有优良的导电、导热、机械性能和生物相容性,被广泛应用在电子、催化剂、材料和生物医药领域[2-4]。随着CNTs的生产规模和应用范围不断扩大,人类和动物与之接触的概率也不断增加,在应用CNTs材料的同时,不能忽略其毒性研究[5]。CNTs质量较轻,容易在空气中漂浮并随之扩散,有研究表明空气中的CNTs可以通过呼吸的方式进入到肺泡内[6],因此研究CNTs的肺毒性具有十分重要的意义。本研究结合体外细胞毒性检测和动物体内毒性检测2种方法,较系统地评估SWCNTs的肺毒性大小,并从氧化应激角度初步探讨SWCNTs肺毒性的机制。
1 材料和方法 1.1 材料SWCNTs来自国家纳米科学中心,直径1~2 nm,长度< 5μm,纯度90%;A549细胞购自武汉大学保藏中心;细胞高糖DMEM培养基、胎牛血清(fetal bovine serum, FBS)、胰酶、青霉素和链霉素购于Invitrogen公司;CCK-8细胞活性检测试剂盒为东仁化学公司产品;乳酸脱氢酶(lactate dehydrogenase, LDH)、活性氧(reactive oxygen species, ROS)、谷胱甘肽(glutathione, GSH)和超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒购自碧云天生物科技公司;Hoechst 33342和碘化丙啶(propidium iodide, PI)为Sigma-Aldrich公司产品;其他化学试剂均为分析纯。
1.2 SWCNTs形貌检测在毒性检测前,先利用透射电镜(transmission electron microscope, TEM)观察SWCNTs形貌。SWCNTs经超声和震荡处理后充分分散在双蒸水中,取少量分散液滴到有碳膜的铜网上,待水分蒸发完毕,利用TEM (H-7650, 日立)观察样品。
1.3 细胞毒性检测选体外培养A549细胞作为检测SWCNTs毒性的体外模型。每天更换细胞培养液1次,每2 d将细胞传代1次。细胞培养液为含10% FBS的DMEM,利用该培养液配制不同浓度的SWCNTs分散液。
1.3.1 CCK-8法检测细胞活性按每孔5 000个细胞的密度将A549细胞接种到96孔培养板中,然后利用质量浓度为0、25、50、100、150、200μg/mL的SWCNTs溶液孵育细胞24 h,最后用CCK-8试剂检测细胞活性,用酶标仪测定450 nm波长下的光密度(D)值,计算细胞活性。
1.3.2 LDH释放法检测细胞膜损伤LDH是细胞内一种稳定的酶,当细胞膜损伤或破裂时,LDH会释放到细胞外的培养液中,通过检测培养液中LDH的浓度可评估细胞膜的损伤程度。将不同浓度的SWCNTs处理的细胞孵育24 h后,利用LDH试剂盒检测培养液中LDH浓度。未处理的细胞作为阴性对照组,LDH释放液处理过的细胞作为阳性对照组,测定波长为490 nm下的D值,计算LDH释放率。
1.3.3 Hoechst 33342和PI荧光双染检测细胞死亡Hoechst 33342和PI是2种不同的核酸荧光探针,Hoechst 33342可以透过活细胞的细胞膜进入到细胞内,从而对细胞核染色;PI不能透过活细胞的细胞膜,所以只有当细胞膜损伤严重或细胞死亡时才能进入细胞,对核酸染色。将细胞接种到无菌盖玻片上,在SWCNTs溶液中孵育24 h后,利用Hoechst 33342和PI两种荧光探针对细胞染色,充分漂洗后封片,荧光显微镜下观察。
1.3.4 TEM观察细胞超微结构损伤实验细胞经胰酶消化后,4%多聚甲醛固定,梯度乙醇和丙酮脱水,812树脂包埋,切成70 nm薄片,醋酸铀和硝酸铅染色,利用TEM观察。
1.4 细胞氧化应激反应检测 1.4.1 DCFH-DA法检测细胞内ROS含量DCFH-DA是检验ROS常用的一种试剂,它可进入细胞内通过酶分解和ROS氧化生成具有荧光的DCF,检验荧光强度用来评估ROS浓度。将细胞在SWCNTs溶液中孵育4 h,经DCFH-DA荧光探针染色,充分漂洗,利用荧光酶标仪检测荧光强度(激发波长:488 nm,发射波长:525 nm)。
1.4.2 GSH和SOD试剂盒检测细胞内GSH含量和SOD活力细胞与SWCNTs溶液作用24 h后,将细胞裂解后离心取上清液,分别按照试剂盒说明书要求检测GSH浓度和SOD活力。
1.5 大鼠肺毒性检测健康雄性SD大鼠购自第二军医大学实验动物中心[许可证号:SCXK (沪) 2012-0003],标准化饲养,待体质量达220~250 g时可进行毒性检测。分别将1 mL生理盐水、0.5 mg/mL SWCNTs和1 mg/mL SWCNTs通过气管灌流的方法,使大鼠肺部染毒(若每只大鼠体质量按250 g计算,则0.5 mg/mL剂量可换算成2 mg/kg,1 mg/mL剂量为4 mg/kg)。具体实验操作如下:(1)腹腔注射麻药将大鼠麻醉,插入中空玻璃细管到大鼠气管;(2)将三叉管的一端连接到中空玻璃细管,一端连接动物呼吸机,材料分散液则通过三叉管的第三端接口注射到大鼠肺脏中;(3)SWCNTs溶液要随着大鼠的呼吸频率注射,使材料能够充分进入大鼠肺脏。染毒结束后大鼠自由进食。3 d后麻醉大鼠并取出肺脏,经4%多聚甲醛固定,按常规方法制成组织病理切片,常规H-E染色,光镜下观察。
1.6 统计学处理采用SPSS 21.0软件分析数据。所有数据均用±s表示,使用单因素方差分析(one-way ANOVA)比较组间差异,检验水准(α)为0.05。
2 结果 2.1 SWCNTs的表征SWCNTs的基本信息由生产商提供。在毒性测试前,先利用TEM观察SWCNTs的形貌和分散状态,可见镜下SWCNTs呈分散的管状(图 1)。
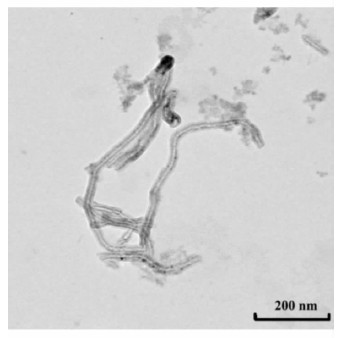
|
图 1 透射电镜观察SWCNTs形貌 Fig 1 Appearance of SWCNTs under transmission electron microscope |
2.2 SWCNTs对A549细胞的毒性
A549细胞活性检测结果(图 2A)显示,细胞在SWCNTs溶液中孵育24 h后,细胞活性随着SWCNTs浓度的增加而逐渐减小,在100μg/mL质量浓度下为69.0%,在200μg/mL质量浓度下降至42.3%。LDH释放检测结果(图 2B)显示,细胞外LDH浓度随着SWCNTs浓度增加呈上升趋势,在50μg/mL质量浓度下LDH释放率为26.8%,表明细胞膜在该浓度下明显受到损伤;在200μg/mL质量浓度下LDH释放率高达73.4%,表明此时细胞膜损伤严重。为了进一步研究SWCNTs对A549细胞的毒性,采用Hoechst 33342和PI荧光双染的方法检测细胞死亡情况,结果(图 3)显示,对照组细胞几乎无红色荧光(PI),随着SWCNTs浓度增加,被PI着色的细胞比例增加,且红色荧光强度也增强,表明随着SWCNTs浓度增加,死亡细胞越来越多。采用TEM检测细胞超微结构变化,结果(图 4)显示,A549细胞在100μg/mL的SWCNTs溶液中孵育24 h后,SWCNTs主要以团聚的形式存在于细胞质中,细胞核中没有发现CNTs的存在;细胞超微结构受到严重损伤,线粒体出现明显肿胀,线粒体嵴溶解。
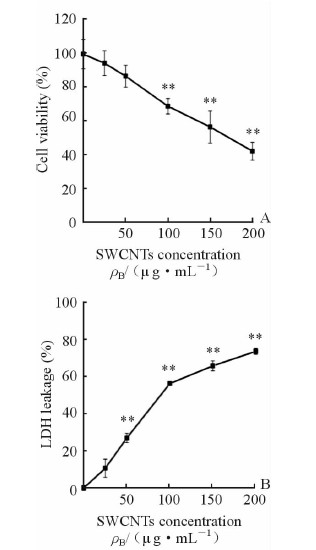
|
图 2 SWCNTs对A549细胞活性(A)和LDH释放(B)的影响 Fig 2 Effects of SWCNTs on cell viability (A) and LDH leakage (B) of A549 cells |
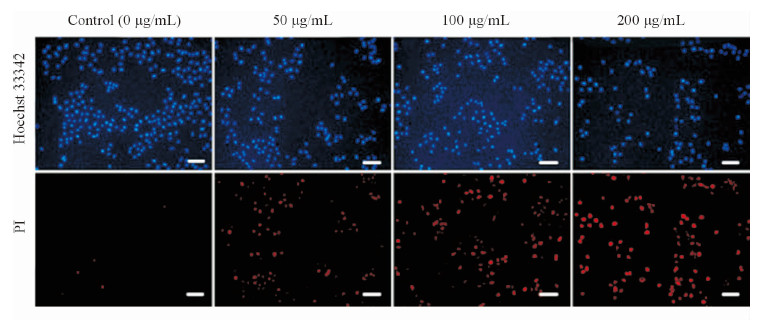
|
图 3 SWCNTs对A549细胞死亡的影响 Fig 3 Effects of SWCNTs on death of A549 cells |
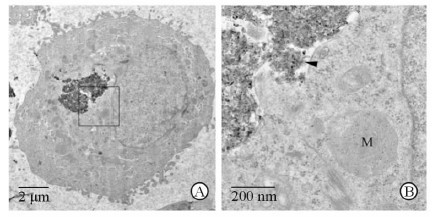
|
图 4 SWCNTs对A549细胞超微结构的影响 Fig 4 Effects of SWCNTs on ultrastructure of A549 cells |
2.3 SWCNTs对A549细胞氧化应激反应的影响
由荧光酶标仪检测结果(图 5A)可见,A549细胞在SWCNTs溶液中培养4 h后,细胞内ROS含量明显增加,SWCNTs质量浓度为50μg/mL时ROS含量为207.2%,SWCNTs质量浓度为100μg/mL时ROS含量增高至345.6%。总体上,随着SWCNTs浓度增加,ROS含量呈现先增加后保持不变的趋势。由图 5B可见,细胞与不同浓度的SWCNTs作用24 h后,细胞内GSH含量随着SWCNTs浓度增加而降低,在150μg/mL质量浓度下GSH相对含量为70.0%,在200μg/mL质量浓度下GSH相对含量降低至65.2%。由图 5C可见,SOD活力随着SWCNTs浓度增加而逐渐降低,在200μg/mL质量浓度下SOD活性降至50.6%。
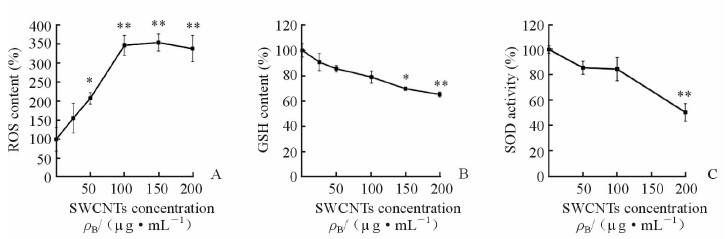
|
图 5 SWCNTs对A549细胞氧化应激反应的影响 Fig 5 Effects of SWCNTs on oxidative stress of A549 cells |
2.4 SWCNTs对大鼠肺组织病理的影响
通过气管灌流的方法使大鼠染毒不同剂量的SWCNTs,饲养3 d后,大鼠体质量和毛发未发生明显变化,且没有出现死亡和异常行为。切取大鼠肺组织进行病理学检测,结果(图 6)显示,SWCNTs能进入到肺泡内,并在肺组织中积累,使肺泡壁出现明显水肿增厚,从而使得肺泡空间减小。

|
图 6 SWCNTs对大鼠肺组织病理的影响 Fig 6 Effects of SWCNTs on pulmonary pathology of rats |
3 讨论
由于具有特殊的物理化学性能,SWCNTs被应用在多个科学领域[7],人类通过呼吸接触到SWCNTs的概率也随之增大,因此不能忽视对其肺毒性的研究[8-9]。本研究通过细胞毒性检测和动物实验,比较系统地研究了SWCNTs对肺毒性的大小,并针对SWCNTs的毒性机制进行探究。
A549作为肺上皮细胞系,被广泛应用在体外肺毒性的评估中[10-11]。本研究发现,当A549细胞暴露在不同剂量的SWCNTs溶液中24 h后,细胞活性随着SWCNTs浓度增加而降低,在高浓度(100~200μg/mL)下细胞活性显著降低。SWCNTs不仅能引起A549细胞活性降低,还能破坏细胞膜和细胞超微结构。LDH释放能反映细胞膜的损伤[12],SWCNTs在较低的剂量下能引起LDH明显释放,表明细胞膜容易被SWCNTs损伤。Hoechst 33342/PI荧光双染结果发现,随着SWCNTs剂量增加,死亡细胞也逐渐增加,表现为细胞红色荧光增强。此外,暴露在SWCNTs环境下,A549细胞结构也发生了较大变化,细胞质内有大量团聚的SWCNTs,线粒体受损严重,出现明显肿胀,线粒体内嵴基本溶解。作为细胞内重要的一种细胞器,线粒体的主要功能是为细胞提供ATP,线粒体结构损伤势必会影响到正常生理功能,进而引起细胞死亡。
研究表明CNTs通过损伤线粒体引发ROS产生[13],细胞内ROS具有较高的反应活性,可以对细胞产生多种危害,包括引发炎症反应、产生基因毒性、影响信号通路、诱发细胞凋亡等[14-16]。细胞内ROS的产生往往早于其他变化[17],本研究检测了SWCNTs暴露4 h内细胞内ROS含量变化,发现ROS浓度明显升高。GSH和SOD作为细胞内2种重要的抗氧化剂,它们的含量和活力与ROS浓度有密切关系。实验结果也显示,高浓度的SWCNTs会引起细胞内GSH含量和SOD活力显著降低。有文献报道,CNTs引发细胞内ROS产生,进而使脂质过氧化物(lipid peroxidation, LPO)浓度升高,使SOD活力和GSH浓度发生变化[18-19]。细胞内ROS含量明显增加,抗氧化剂GSH和SOD明显降低,使得细胞内氧化能力强于还原能力,细胞氧化还原平衡被打破,细胞氧化还原能力失衡后引起细胞死亡[20-21]。综合上述结果,我们认为氧化应激反应是SWCNTs引发A549细胞毒性的主要机制。
本研究通过大鼠体内毒性检测,发现SWCNTs可以在肺泡内积累,大多数CNTs被肺泡壁包裹。与正常大鼠相比,染毒SWCNTs的肺泡壁出现明显水肿增厚,肺泡体积明显减小。CNTs化学性能较稳定,很难在人体内分解,文献报道,CNTs在肺组织内长期积累,能引发肺纤维化、肉芽瘤和细胞癌变[5, 22]。长期接触CNTs可能会使CNTs在肺组织内不断积累,从而造成肺脏发病率升高,甚至引发肺癌。积累在肺组织中的SWCNTs可能会穿过毛细血管壁,进入到血液中,对血液中的蛋白质和血细胞产生不利影响,同时还能借助血液循环扩散到其他器官,比如肾脏、脾脏和肝脏等。因此,在CNTs工业生产和大量应用中,应尽量全面通风,穿戴工作服、防尘口罩和手套,避免直接接触CNTs;高浓度环境下需佩戴防护眼镜,并注意个人卫生,避免长时间接触CNTs。
本研究发现无论是体外毒性检测还是体内毒性检测,SWCNTs都表现出明显的肺毒性,其主要毒性机制是氧化应激反应。本研究内容和结果为安全生产和应用SWCNTs提供了实验依据。
| [1] | JIA G, WANG H, YAN L, WANG X, PEI R, YAN T, et al. Cytotoxicity of carbon nanomaterials:single-wall nanotube, multi-wall nanotube, and fullerene[J]. Environ Sci Technol , 2005, 39 :1378–1383. DOI:10.1021/es048729l |
| [2] | LIU Y, ZHAO Y, SUN B, CHEN C. Understanding the toxicity of carbon nanotubes[J]. Acc Chem Res , 2013, 46 :702–713. DOI:10.1021/ar300028m |
| [3] | ZHAO X, LIU R. Recent progress and perspectives on the toxicity of carbon nanotubes at organism, organ, cell, and biomacromolecule levels[J]. Environ Int , 2012, 40 :244–255. DOI:10.1016/j.envint.2011.12.003 |
| [4] | HE H, PHAM-HUY L A, DRAMOU P, XIAO D, ZUO P, PHAM-HUY C. Carbon nanotubes:applications in pharmacy and medicine[J]. Biomed Res Int , 2013, 2013 :578290. |
| [5] | LAMBERTI M, PEDATA P, SANNOLO N, PORTO S, DE ROSA A, CARAGLIA M. Carbon nanotubes:properties, biomedical applications, advantages and risks in patients and occupationally-exposed workers[J]. Int J Immunopathol Pharmacol , 2015, 28 :4–13. DOI:10.1177/0394632015572559 |
| [6] | CLIFT M J, ENDES C, VANHECKE D, WICK P, GEHR P, SCHINS R P, et al. A comparative study of different in vitro lung cell culture systems to assess the most beneficial tool for screening the potential adverse effects of carbon nanotubes[J]. Toxicol Sci , 2014, 137 :55–64. DOI:10.1093/toxsci/kft216 |
| [7] | ZHANG Q, HUANG J Q, QIAN W Z, ZHANG Y Y, WEI F. The road for nanomaterials industry:a review of carbon nanotube production, post-treatment, and bulk applications for composites and energy storage[J]. Small , 2013, 9 :1237–1265. DOI:10.1002/smll.201203252 |
| [8] | MORIMOTO Y, HORIE M, KOBAYASHI N, SHINOHARA N, SHIMADA M. Inhalation toxicity assessment of carbon-based nanoparticles[J]. Acc Chem Res , 2013, 46 :770–781. DOI:10.1021/ar200311b |
| [9] | EMA M, GAMO M, HONDA K. A review of toxicity studies of single-walled carbon nanotubes in laboratory animals[J]. Regul Toxicol Pharmacol , 2016, 74 :42–63. DOI:10.1016/j.yrtph.2015.11.015 |
| [10] | FUJITA K, FUKUDA M, ENDOH S, MARU J, KATO H, NAKAMURA A, et al. Size effects of single-walled carbon nanotubes on in vivo and in vitro pulmonary toxicity[J]. Inhal Toxicol , 2015, 27 :207–223. DOI:10.3109/08958378.2015.1026620 |
| [11] | DAVOREN M, HERZOG E, CASEY A, COTTINEAU B, CHAMBERS G, BYRNE H J, et al. In vitro toxicity evaluation of single walled carbon nanotubes on human A549 lung cells[J]. Toxicol In Vitro , 2007, 21 :438–448. DOI:10.1016/j.tiv.2006.10.007 |
| [12] | FOTAKIS G, TIMBRELL J A. In vitro cytotoxicity assays:comparison of LDH, neutral red, MTT and protein assay in hepatoma cell lines following exposure to cadmium chloride[J]. Toxicol Lett , 2006, 160 :171–177. DOI:10.1016/j.toxlet.2005.07.001 |
| [13] | HE X, YOUNG S H, SCHWEGLER-BERRY D, CHISHOLM W P, FERNBACK J E, MA Q. Multiwalled carbon nanotubes induce a fibrogenic response by stimulating reactive oxygen species production, activating NF-κB signaling, and promoting fibroblast-to-myofibroblast transformation[J]. Chem Res Toxicol , 2011, 24 :2237–2248. DOI:10.1021/tx200351d |
| [14] | MA Q. Transcriptional responses to oxidative stress:pathological and toxicological implications[J]. Pharmacol Ther , 2010, 125 :376–393. DOI:10.1016/j.pharmthera.2009.11.004 |
| [15] | ALARIFI S, ALI D, VERMA A, ALMAJHDI F N, AL-QAHTANI A A. Single-walled carbon nanotubes induce cytotoxicity and DNA damage via reactive oxygen species in human hepatocarcinoma cells[J]. In Vitro Cell Dev Biol Anim , 2014, 50 :714–722. DOI:10.1007/s11626-014-9760-3 |
| [16] | YE S, ZHANG H, WANG Y, JIAO F, LIN C, ZHANG Q. Carboxylated single-walled carbon nanotubes induce an inflammatory response in human primary monocytes through oxidative stress and NF-κB activation[J]. J Nanopart Res , 2011, 13 :4239–4252. DOI:10.1007/s11051-011-0368-1 |
| [17] | CHEN B, LIU Y, SONG W M, HAYASHI Y, DING X C, LI W H. In vitro evaluation of cytotoxicity and oxidative stress induced by multiwalled carbon nanotubes in murine RAW 264.7 macrophages and human A549 lung cells[J]. Biomed Environ Sci , 2011, 24 :593–601. |
| [18] | WANG J, SUN P, BAO Y, LIU J, AN L. Cytotoxicity of single-walled carbon nanotubes on PC12 cells[J]. Toxicol In Vitro , 2011, 25 :242–250. DOI:10.1016/j.tiv.2010.11.010 |
| [19] | GUO Y Y, ZHANG J, ZHENG Y F, YANG J, ZHU X Q. Cytotoxic and genotoxic effects of multi-wall carbon nanotubes on human umbilical vein endothelial cells in vitro[J]. Mutat Res , 2011, 721 :184–191. DOI:10.1016/j.mrgentox.2011.01.014 |
| [20] | AOYAMA K, NAKAKI T. Glutathione in cellular redox homeostasis:association with the excitatory amino acid carrier 1(EAAC1)[J]. Molecules , 2015, 20 :8742–8758. DOI:10.3390/molecules20058742 |
| [21] | YE Z W, ZHANG J, TOWNSEND D M, TEW K D. Oxidative stress, redox regulation and diseases of cellular differentiation[J]. Biochim Biophys Acta , 2015, 1850 :1607–1621. DOI:10.1016/j.bbagen.2014.11.010 |
| [22] | WANG L, STUECKLE T A, MISHRA A, DERK R, MEIGHAN T, CASTRANOVA V, et al. Neoplastic-like transformation effect of single-walled and multi-walled carbon nanotubes compared to asbestos on human lung small airway epithelial cells[J]. Nanotoxicology , 2014, 8 :485–507. DOI:10.3109/17435390.2013.801089 |
 2016, Vol. 37
2016, Vol. 37


