2. 上海中医药大学附属第七人民医院影像科, 上海 200137
2. Department of Medical Imaging, The Seventh People's Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200137, China
铁蛋白是普遍存在于动、植物和微生物体内的一种储铁蛋白,随着分子影像学的不断发展,铁蛋白基因作为一种报告基因被用于磁共振成像(MRI)[1-3],并在细胞标记成像[4]、基因治疗[5]及药物筛选[6]等方面得到广泛应用。近年来,利用干细胞治疗疾病成为研究热点,骨髓间充质干细胞(mesenchymal stem cells, MSCs)由于其自我更新、多向分化潜力,以及低免疫原性、供体来源充足的优点,成为研究干细胞治疗中的理想细胞类型。干细胞在体内的定位、迁移、存活及增殖等转归过程有赖于无创的影像学手段进行观察。关于MSCs的影像学示踪,目前研究最多的是超顺磁性氧化铁粒子[7],它能够直接标记细胞,灵敏地产生信号,但缺点是随着细胞增殖分裂及生物降解作用细胞内的铁会逐渐稀释、消失。而报告基因则能够克服这一缺点,基因会遗传到子代细胞,继续表达相同的产物,保持细胞功能的持续性。在MRI检测中,铁蛋白报告基因通过增加细胞内铁含量,引起局部磁场分布不均匀,从而缩短T2弛豫时间,产生T2负性对比效应。本研究通过将铁蛋白报告基因Fth1转染MSCs,观察其对MSCs生物学特性的影响,并探讨体外MRI成像表现,为体内移植MSCs的MRI示踪提供依据。
1 材料和方法 1.1 实验动物、主要试剂和仪器清洁级SD大鼠,4周龄,体质量60~80 g,雄性,购于第二军医大学实验动物中心[许可证号:SCXK(沪)2012-0003]。DMEM/F12培养基(吉诺生物医药公司),胎牛血清(FBS,Gibco公司),Fth1慢病毒载体上清液(课题组前期构建),普鲁士蓝染色试剂盒(上海复申生物试剂公司),锥虫蓝染色试剂(Sigma公司),CCK-8试剂盒(Dojindo公司),荧光标记抗大鼠单抗PE-CD34、PE-CD44、FITC-CD90(BD公司),柠檬酸铁(Sigma公司)。倒置相差显微镜(Nikon公司),1.5 T MR成像仪(GE公司)。
1.2 大鼠MSCs体外分离、培养与鉴定按照本课题组前期建立的方法[8], 通过全骨髓贴壁法提取原代SD大鼠MSCs,通过流式细胞仪检测表面抗原CD34、CD44及CD90,采用成骨、成脂肪诱导分化等方法对干细胞进行鉴定。取传代至第4代的MSCs进行后续实验。
1.3 Fth1报告基因转染MSCs取状态良好的第4代MSCs,将培养液更换为Fth1慢病毒载体上清液,置于细胞培养箱(37℃、5% CO2、湿度95%)孵育24 h。24 h后弃掉上清液,加入完全培养液培养,在倒置相差显微镜下观察细胞的形态及生长状况。将柠檬酸铁溶液与完全培养液混匀制成含铁培养液(柠檬酸铁浓度为1 mol/L),细胞转染2~3 d后更换为含铁培养液继续培养。更换含铁培养液3 d后,将细胞消化后铺于6孔板,待细胞贴壁后进行普鲁士蓝染色,显微镜下观察结果。细胞内有蓝色颗粒的为阳性细胞,计数各组3个低倍镜视野下的阳性细胞及细胞总数,计算阳性细胞标记率[阳性细胞标记率(%)=阳性细胞数/细胞总数×100%]。以未转染Fth1基因的MSCs作为对照。
1.4 细胞活力和增殖活性的检测将加入含铁培养液的Fth1标记MSCs、不加含铁培养液的Fth1标记MSCs和未Fth1标记的MSCs培养3 d后分别制成细胞悬液,加0.4%锥虫蓝染液混匀,光镜下观察,染成蓝色的为死细胞,活细胞呈透明不着色。计数低倍镜下3个视野内活细胞和死细胞个数,计算细胞存活率[细胞存活率(%)=活细胞数/细胞总数×100%]。实验重复3次。
将加入含铁培养液的Fth1标记MSCs、不加含铁培养液的Fth1标记MSCs和未Fth1标记的MSCs培养3 d后分别制成细胞悬液,接种于96孔板(每孔100μL,约5 000个细胞),每组设10个平行对照孔。在接种后第3天每孔加入10μL CCK-8溶液,培养箱孵育2 h后用酶联免疫检测仪测定450 nm处各孔的光密度(D)值,代表细胞增殖活性。实验重复5次。
1.5 Fth1标记的MSCs体外MRI成像将加入含铁培养液的Fth1标记MSCs、不加含铁培养液的Fth1标记MSCs和未Fth1标记的MSCs培养5 d后分别制成细胞悬液,接种于96孔板中,每孔细胞量约5×106,进行MRI扫描。采用GE 1.5 T MR成像仪,8通道头颅线圈(Sense head 8 coil)。视野(FOV) 14.0 cm,层厚1.0 mm,层间距0 mm;采用快速自旋回波序列FSE T2加权成像(TR 2 250 ms,TE 102 ms,Echo Train Length=17 ms,Bandwidth 12.50),磁共振敏感加权成像SWAN (TR 82.8 ms,TE 44.7 ms,Flip Angle 15°,Bandwidth 41.67)。测量各孔细胞悬液图像的信号强度,感兴趣区域(region of interest,ROI)为20 mm2。实验重复3次。
1.6 统计学处理采用SPSS 17.0软件进行统计学分析,所测数据以x±s表示,细胞存活率、细胞增殖活性及MRI信号强度比较采用t检验,检验水准(α)为0.05。
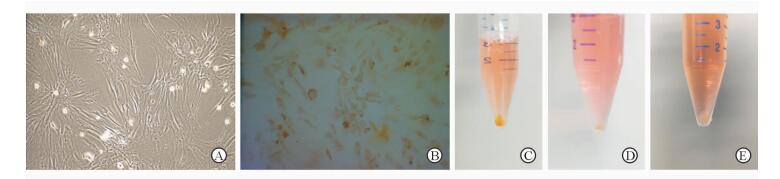
2 结果 2.1 Fth1转染MSCs形态观察在倒置相差显微镜下观察发现,经Fth1转染后的MSCs少部分死亡细胞悬浮,余下贴壁细胞能够保持完整的梭形形态,与转染前形态无明显差别(图 1A)。更换含铁培养液后,细胞逐渐摄取铁进入胞内,3 d后可以观察到部分悬浮的死细胞,贴壁细胞形态仍为梭形,光镜下可以看到细胞内棕黄色物质聚集(图 1B)。经胰酶消化离心后,可见沉积的细胞团块呈棕黄色(图 1C),而未加含铁培养液的转染MSCs及未转染MSCs离心后细胞团块呈白色(图 1D、1E)。
|
图 1 Fth1转染MSCs加入含铁培养液前后的形态变化 Fig 1 Morphologic change of MSCs transfected with Fth1 before and after adding iron A: MSCs transfected with Fth1; B: MSCs transfected with Fth1 3 days after adding iron; C: MSCs cluster transfected with Fth1 3 days after adding iron; D: MSCs cluster transfected with Fth1; E: Normal MSCs cluster. MSCs:Mesenchymal stem cells. Original magnification:×100 (A,B) |
2.2 Fth1标记MSCs的效率
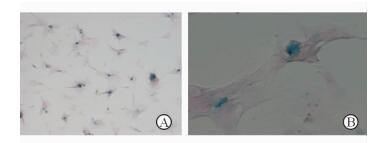
Fth1转染MSCs 3 d后经普鲁士蓝染色,显微镜下观察到胞质内均出现聚集或散在分布的蓝色铁颗粒,细胞核周围明显(图 2),对照组细胞内则没有蓝色物质。Fth1转染MSCs阳性细胞标记率为87%。
|
图 2 Fth1转染MSCs 3 d后普鲁士蓝染色 Fig 2 Prussian blue staining of MSCs 3 days after transfection with Fth1 |
2.3 细胞活力和增殖活性的变化
活细胞计数结果显示,未Fth1标记的MSCs细胞存活率为(94.23±2.42)%、细胞增殖活性D值为1.027±0.122,不加含铁培养液的Fth1标记MSCs细胞存活率为(92.17±1.91)%、细胞增殖活性D值为1.094±0.068,两组比较差异无统计学意义(P>0.05);加入含铁培养液3 d后的Fth1标记MSCs细胞存活率为(77.47±4.10)%、细胞增殖活性D值为0.493±0.024,与未Fth1标记的MSCs及不加含铁培养液的Fth1标记MSCs比较差异均有统计学意义(P < 0.05)。说明含铁培养对Fth1标记的MSCs活细胞有抑制作用。
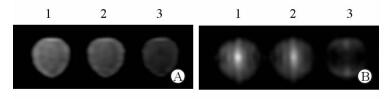
2.4 Fth1标记MSCs体外MRI成像MRI扫描结果(图 3)显示,未加含铁培养液的Fth1标记MSCs在FSE T2WI、SWAN序列信号与未Fth1标记MSCs相近,信号强度分别为807.3±17.1和847.1±10.5,差异无统计学意义(P > 0.05);加入含铁培养液培养5 d的Fth1标记MSCs呈低信号,信号强度为656.6±18.2,与未加含铁培养液的Fth1标记MSCs及未Fth1标记MSCs比较差异有统计学意义(P < 0.05)。
|
图 3 Fth1转染MSCs加入含铁培养液培养5 d后MRI扫描结果 Fig 3 MRI scan of Fth1 transfected MSCs 5 days after iron addition |
3 讨论
MRI具有良好的软组织分辨率,既能够精确显示组织解剖结构,又能进行物质代谢测定等功能成像。铁蛋白报告基因是MRI报告基因的一种,过表达的产物铁蛋白能够调节细胞内外铁浓度,使细胞摄取外环境的铁,升高细胞内铁浓度,从而缩短T2弛豫时间,产生T2负性对比效应,并且在体检测不需要引入外源性对比剂。因此,铁蛋白可作为一种较为理想的MRI内源性对比剂。铁蛋白分子由蛋白壳和中心的铁核构成,蛋白壳是由24个亚基组成的球形空腔结构,其亚基包括重链(H链)和轻链(L链)两种形式,H链具有亚铁氧化酶的活性, 可以促进铁结合,将Fe2+氧化为Fe3+[9],而L链在维持铁蛋白的稳定性上起着关键作用。
早期研究中,Cohen等[10]构建了鼠铁蛋白H链的病毒载体,并转染胶质瘤C6细胞,通过体内外MRI观察到过表达铁蛋白H链的C6细胞T2值较未转染的细胞明显降低,同时组织学方法证明了细胞内铁蛋白H链表达和铁的增加。Liu等[11]建立了携带人铁蛋白H链基因的小鼠胚胎干细胞系,MRI扫描发现与野生干细胞移植瘤相比,移植入体内的过表达铁蛋白H链的转基因胚胎干细胞移植瘤T2弛豫时间明显降低,移植后14 d横向弛豫率R2增加15%,移植后21 d R2增加28%,并通过病理证实细胞内铁的存在。本研究构建了大鼠来源铁蛋白H链基因慢病毒载体,将Fth1基因成功转染大鼠MSCs。将转染MSCs在柠檬酸铁浓度为1 mol/L的含铁培养液中培养5 d后进行MRI扫描,T2WI及SWAN序列都能产生明显的信号降低,普鲁士蓝染色也证明了细胞内铁的存在。因此,我们认为通过慢病毒载体携带Fth1基因可标记MSCs,并能够通过MRI检测到Fth1基因标记的MSCs。在预实验中我们在转染MSCs后48 h进行MRI扫描,未检测到信号的降低;而将MRI扫描时间延迟到5 d后,便能检测到明显低信号。提示随着时间延长,Fth1基因表达量也在不断增加,这与Liu等[11]研究结果符合。然而,信号强度是否会随时间持续增强,有待进一步研究。
有研究发现,细胞内的自由铁会增强过氧化物的代谢,形成过多的自由基,导致细胞膜、蛋白和DNA的损害[12]。通过转染铁蛋白基因的干细胞,由于铁蛋白的过表达会使细胞摄取过量的铁,细胞内过量的铁对细胞的生物学特性是否有影响值得探究。本研究将慢病毒转染后的MSCs与未转染MSCs进行锥虫蓝染色和CCK-8检测,结果显示转染组的细胞活力和增殖活性与未转染组比较差异没有统计学意义,说明Fth1慢病毒载体不会影响细胞的生物学特性。这与Kim等[13]的研究结果一致。本研究对Fth1转染MSCs加入含铁培养液培养3 d后再次检测细胞活力和增殖活性,结果显示其细胞活力和增殖活性均降低,表明Fth1转染MSCs在富铁环镜中培养,其活力和增殖能力受到一定影响。Naumova等[14]将转染铁蛋白基因的细胞和未转染的细胞同时加入铁培养液,结果表明在富铁环境下转染铁蛋白基因的细胞活性强于未转染细胞。原因可能在于铁蛋白基因的过表达能够将细胞内游离的Fe2+氧化成Fe3+, 使细胞更好地螯合摄入的铁,减少游离的Fe2+参与自由基的生成过程,降低对细胞的损害。本研究中含铁培养液中柠檬酸铁的浓度为1 mol/L,对细胞活力和增殖活性有一定影响,前期预实验中尝试0.1、0.5 mol/L等浓度,但经普鲁士蓝染色检测细胞摄铁量比较低。因此,培养液铁浓度、加入含铁培养液的培养时间都会影响细胞摄铁量,在既不影响细胞增殖活性,又能使细胞携带足够的铁被检测出来的前提下摸索一个合适的浓度,有待进一步探究。
本研究通过慢病毒载体成功将Fth1基因转染大鼠MSCs,并通过普鲁士蓝染色证实了细胞的摄铁能力,在普通培养液中Fth1基因不影响MSCs的生物学活性,但在含铁培养液中培养对其活性有一定影响。MRI能够对Fth1标记MSCs进行示踪。本研究不足之处在于只将Fth1转染MSCs后进行MRI扫描时间延长到5 d,随着时间推移其低信号强度是否会持续增强或保持不变,需要进一步延长检测时间进行探索。此外,本研究为体外实验,生物干扰性较少,在体研究时由于稀释作用或者体内铁环镜的浓度限制,Fth1转染干细胞的MRI信号能否被检测到,以及在体MRI示踪时间窗有多长,仍需要体内实验进一步探究。
| [1] | PEREIRA S M, MOSS D, WILLIAMS S R, MURRAY P, TAYLOR A. Overexpression of the MRI reporter genes ferritin and transferrin receptor affect iron homeostasis and produce limited contrast in mesenchymal stem cells[J]. Int J Mol Sci , 2015, 16 :15481–15496. DOI:10.3390/ijms160715481 |
| [2] | KIM H S, CHO H R, CHOI S H, WOO J S, MOON W K. In vivo imaging of tumor transduced with bimodal lentiviral vector encoding human ferritin and green fluorescent protein on a 1.5T clinical magnetic resonance scanner[J]. Cancer Res , 2010, 70 :7315–7324. DOI:10.1158/0008-5472.CAN-10-0241 |
| [3] | HE X, CAI J, LIU B, ZHONG Y, QIN Y. Cellular magnetic resonance imaging contrast generated by the ferritin heavy chain genetic reporter under the control of a Tet-On switch[J]. Stem Cell Res Ther , 2015, 6 :207. DOI:10.1186/s13287-015-0205-z |
| [4] | CAMPAN M, LIONETTI V, AQUARO G D, FORINI F, MATTEUCCI M, VANNUCCI L, et al. Ferritin as a reporter gene for in vivo tracking of stem cells by 1.5-T cardiac MRI in a rat model of myocardial infarction[J]. Am J Physiol Heart Circ Physiol , 2011, 300 :H2238–H2250. DOI:10.1152/ajpheart.00935.2010 |
| [5] | BERBERAT P O, KATORI M, KACZMAREK E, ANSELMO D, LASSMAN C, KE B, et al. Heavy chain ferritin acts as an antiapoptotic gene that protects livers from ischemia reperfusion injury[J]. FASEB J , 2003, 17 :1724–1726. |
| [6] | COHEN B, ZIV K, PLAKS V, ISRAELY T, KALCHENKO V, HARMELIN A, et al. MRI detection of transcriptional regulation of gene expression in transgenic mice[J]. Nat Med , 2007, 13 :498–503. DOI:10.1038/nm1497 |
| [7] | HUANG Z, LI C, YANG S, XU J, SHEN Y, XIE X, et al. Magnetic resonance hypointensive signal primarily originates from extracellular iron particles in the long-term tracking of mesenchymal stem cells transplanted in the infarcted myocardium[J]. Int J Nanomedicine , 2015, 10 :1679–1690. |
| [8] | 刘佳, 赵江民, 张蕾, 何瑶, 杨嘉. 超顺磁性氧化铁标记大鼠骨髓间充质干细胞的研究[J]. 同济大学学报(医学版) , 2010, 31 :30–35. |
| [9] | TREFFRY A, ZHAO Z, QUAIL M A, GUEST J R, HARRISON P M. Dinuclear center of ferritin:studies of iron binding and oxidation show differences in the two iron sites[J]. Biochemistry , 1997, 36 :432–441. DOI:10.1021/bi961830l |
| [10] | COHEN B, ZIV K, PLAKS V, ISRAELY T, KALCHENKO V, HARMELIN A, et al. MRI detection of transcriptional regulation of gene expression in transgenic mice[J]. Nat Med , 2007, 13 :498–503. DOI:10.1038/nm1497 |
| [11] | LIU J, CHENG E C, LONG R C, YANG S H, WANG L, CHENG P H, et al. Noninvasive monitoring of embryonic stem cells in vivo with MRI transgene reporter[J]. Tissue Eng Part C Methods , 2009, 15 :739–747. |
| [12] | EMERIT J, BEAUMONT C, TRIVIN F. Iron metabolism, free radicals, and oxidative injury[J]. Biomed Pharmacother , 2001, 55 :333–339. DOI:10.1016/S0753-3322(01)00068-3 |
| [13] | KIM H S, WOO J, LEE J H, JOO H J, CHOI Y, KIM H, et al. In vivo tracking of dendritic cell using MRI reporter gene, ferritin[J]. PLoS One , 2015, 10 :e0125291. DOI:10.1371/journal.pone.0125291 |
| [14] | NAUMOVA A V, REINECKE H, YARNYKH V, DEEM J, YUAN C, MURRY C E. Ferritin overexpression for noninvasive magnetic resonance imaging-based tracking of stem cells transplanted into the heart[J]. Mol Imaging , 2010, 9 :201–210. |
 2016, Vol. 37
2016, Vol. 37


