甾类激素又称类固醇类激素,指含有甾类母核的激素,主要包括肾上腺皮质激素和性激素,在维持各项生命活动、调节机体物质代谢等方面发挥重要作用[1]。肝脏是人体最主要的代谢器官,任何肝脏疾病都会影响其代谢过程和代谢产物,并可在细胞组织和体液中体现出来。激素与肝癌的发生、发展与复发有密切的关系[2-3],阐明激素水平在肝癌患者病程中的变化情况对于肝癌的诊断、治疗及预防复发具有现实的指导意义。内源性激素在人体内的含量很低,目前临床常用测定甾类激素的方法主要为放射免疫测定(RIA)和酶联免疫吸附(ELISA)法,其专属性及灵敏度都有待提高[4-6]。质谱联用技术具有专属性强、灵敏度高、准确度好的特点,已经越来越多地用于人体内微量成分的检测[7-10]。
本研究建立了一种灵敏、快速、简便的液相色谱-串联质谱(LC-MS/MS)法测定人体血清中内源性激素的含量,比较健康志愿者和原发性肝癌患者体内激素水平的差异。
1 材料和方法 1.1 仪器Agilent 1260 Infinity液相色谱仪、Agilent 6460三重四级杆质谱仪(Agilent Technologies,美国);雅培高速离心机(Abbott Laboratories,德国);XW 80A型涡旋混合器(上海医科大学仪器厂);Savant SpeedVac真空离心浓缩仪(Thermo Fisher,美国);Mettler AE240十万分之一电子天平(梅特勒-托利多,瑞士);Millipore-Q超纯去离子水净化仪(Millipore,美国);Orion Model 828型pH计(奥利龙,美国)。
1.2 试剂激素对照品包括雌酮(E1)、雌二醇(E2)、雌三醇(E3)、睾酮(T)、雄烯二酮(AD)、氢化可的松(HC)和黄体酮(P)均购自中国药品生物制品检定所(纯度>99%);衍生化试剂丹磺酰氯购自上海沪鼎生物有限公司(色谱试剂,需避光保存在-20℃环境下); 内标倍他米松、对羟基联苯(4-PP)购自上海科丰化学试剂有限公司(纯度>99%)。甲醇、乙腈为色谱纯(Honeywell公司,美国),甲酸为色谱纯(Sigma公司,美国),水为超纯去离子水,其他试剂为分析纯。
1.3 色谱条件色谱柱:Agilent Poroshell 120 EC-C18柱(2.1 mm×150 mm,2.7μm);流动相:A相为乙腈,B相为0.1%(V/V)甲酸水溶液;梯度洗脱,程序如下:0~5 min A∶B=40∶60,5~8 min A∶B=90∶10;流速:0.3 mL/min;平衡时间:3 min;柱温:35℃;进样量:10μL。
1.4 质谱条件离子源:电喷雾离子源(ESI);在正离子方式下采用动态多反应离子监测模式(dynamic MRM)进行二级扫描;用于定量分析的离子经MassHunter Optimizer软件自动优化后得出,7种甾类激素及内标优化后的质谱参数及保留时间见表 1,典型MRM色谱图如图 1。其中对羟基联苯作为雌激素(雌二醇、雌三醇、雌酮)定量的内标,倍他米松作为其余激素(氢化可的松、睾酮、雄烯二酮、黄体酮)定量的内标。
|
|
表 1 7种甾类激素及内标的保留时间及质谱参数 Tab 1 Tandem mass spectrometric parameters and retention time of seven steroid hormones and IS |
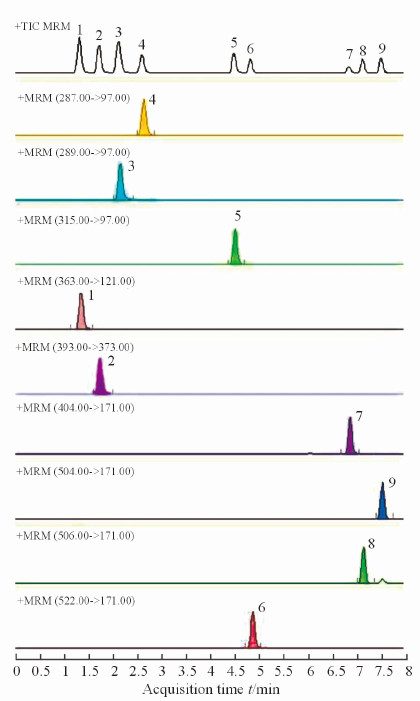
|
图 1 7种甾类激素及内标的典型色谱图 Fig 1 Typical MRM chromatograms of seven steroid hormones and internal standard |
1.5 甾类激素标准溶液及内标溶液的配制
精密称取雌三醇20.10 mg、雌二醇21.42 mg、雌酮19.00 mg、氢化可的松18.75 mg、睾酮20.60 mg、雄烯二酮16.58 mg、黄体酮21.35 mg,分别置于25 mL容量瓶中,加乙腈溶解并稀释至刻度,摇匀备用,即得7种对照品储备液,浓度分别为雌三醇804μg/mL、雌二醇857μg/mL、雌酮760μg/mL、氢化可的松750μg/mL、睾酮824μg/mL、雄烯二酮663μg/mL、黄体酮854μg/mL。移取各单个对照品储备液适量,混合置于10 mL容量瓶中,加乙腈定容至刻度,得混合对照品储备液。取此储备液适当体积移至10 mL容量瓶中,用乙腈依次逐级稀释成浓度梯度,配成混合对照品系列标准溶液。另精密称取对羟基联苯对照品11.09 mg,置于10 mL容量瓶中,加乙腈溶解并稀释至刻度,摇匀,得到浓度为1.109 mg/mL的内标储备液;取储备液适量逐级稀释,得到浓度为0.551 4 ng/mL的内标标准品溶液。精密称取倍他米松对照品12.04 mg,置于10 mL容量瓶中,加乙腈溶解并稀释至刻度,摇匀,得到浓度为1.204 mg/mL的内标储备液;取储备液适量逐级稀释,得到浓度为0.602 ng/mL的内标标准品溶液,上述溶液保存于4℃冰箱待用。
1.6 患者及健康志愿者的一般资料所有研究资料均来自2015年2-8月我院多个科室收治的肝癌患者,共收集原发性肝癌患者血清样本45例,其中男性34例(75.5%),女性11例(24.5%),男女比例为3.1∶1;年龄32~80岁,平均(51.2±9.9)岁。健康志愿者血清样本来自本院门诊体检中心,共收集43例,其中男性32例(74.4%),女性11例(25.6%),男女比例为2.9∶1;年龄30~81岁,平均为(50.7±10.4)岁。所有肝癌患者均经过明确的临床实验室诊断,同时也拥有影像学资料的证据。本研究中不同性别患者比例与我国罹患肝癌的平均男女比例相似(男性与女性的比例为3∶1[11])。健康志愿者经过身体检查证实具有正常的肝功能,没有病毒性肝炎、酒精性或非酒精性脂肪肝以及其他疾病。所有受试者在受试前1个月内均未使用任何激素类及可干扰内分泌的药物。该试验得到第二军医大学东方肝胆外科医院医学伦理委员会的批准,所有受检者入组前均签署知情同意书。
1.7 血清样品的收集及前处理方法所有受检者于清晨安静状态下抽取空腹血2 mL,不加抗凝剂,离心10 min后分装,保存于-80℃冰箱中。样品解冻至室温后,精密量取200μL于1.5 mL离心管中,加入20μL对羟基联苯(551.4 pg/mL)内标和1 mL乙酸乙酯溶液,涡旋3 min提取,4℃条件下13 800×g离心10 min。取上清液800μL转移至新的离心管内,用真空离心浓缩仪挥干,在残渣中加入100μL NaHCO3水溶液(pH 10.5),涡旋1 min。再加入100μL丹磺酰氯丙酮溶液(衍生化试剂),涡旋3 min混匀,置于60℃水浴中避光反应5 min后取出,13 800×g离心10 min,吸取100μL上清液置于进样瓶中,进样量为10μL。
2 结果 2.1 标准曲线和线性范围取空白血清200μL,不加激素标准溶液,按1.7项下方法操作,按1.3和1.4项下条件进样分析,记录空白血清样本中7种甾类激素的峰面积作为本底值。另取空白血清200μL,精密加入7种激素系列混标溶液20μL和内标溶液20μL,涡旋混匀,分别配成8个浓度的标准含甾类激素血清,每浓度点配制5份样品,按1.7项下方法处理血清样品,按1.3和1.4项下LC-MS/MS条件进样分析,记录色谱图。以添加浓度(X)为横坐标,各激素扣除空白后的峰面积与内标的峰面积比值(Y)为纵坐标,采用最小二乘法进行线性回归。回归方程、线性范围及相关系数见表 2,结果表明7种激素在相应的线性范围内均呈良好的线性关系。
|
|
表 2 7种甾类激素的标准曲线 Tab 2 Standard curves of seven steroid hormones |
2.2 定量限和检测限
以信噪比(S/N)>5作为定量下限,S/N>3作为检测限,测得7种甾类激素在血清中的检测限及定量限结果见表 2。
2.3 精密度试验分别制备低、中、高3个浓度(以睾酮为例:2.06、20.60、82.40 ng/mL)的标准含药血清,每个浓度平行操作5份,按1.7项下方法处理,进样分析,将被测物和内标的峰面积比值代入当日的随行标准曲线方程计算实测浓度,计算日内精密度相对标准偏差(RSD)。每天配制低、中、高3个浓度(以睾酮为例:2.06、20.60、82.40 ng/mL)的含药血清样品各5份,按1.7项下方法处理,连续测定3 d,并将对照品和内标的峰面积比值分别代入当日的随行标准曲线方程,根据实测浓度计算日间精密度RSD。结果表明7种甾类激素日内、日间精密度RSD均在15%以内。
2.4 准确度试验以相对回收率表示,分别制备含7种甾类激素的低、中、高浓度(以睾酮为例:2.06、20.60、82.40 ng/mL)标准含药血清,按1.7项下方法操作,每个浓度重复5份,进样分析,记录色谱峰面积,将被测物和内标峰面积的比值代入当日随行标准曲线方程,得到的实测浓度与理论加入浓度的比值即为相对回收率。结果表明7种甾类激素的准确度在87%~113%,RSD < 15%。
2.5 基质效应和提取回收率取空白血清200μL,按1.7项下方法操作,平行操作5份,进样分析得7种甾类激素的峰面积作为Set0;取空白血清200μL,加入一定浓度的7种甾类激素混合对照品溶液,按1.7项下方法分别制备低、中、高3个浓度(以睾酮为例:2.06、20.60、82.40 ng/mL)的标准含药血清,每个浓度平行操作5份,进样分析得到峰面积作为Set3;取空白血清200μL,按1.7项下方法操作,液液萃取得上清液后加入相应7种被测化合物的标准溶液,真空旋转离心挥干,使其浓度与Set3扣除本底后的待测理论浓度一致,每个浓度平行操作5份,进样分析得峰面积,作为Set2;将以上7种待测化合物的混合标准溶液用乙腈稀释,使其与Set3扣除本底后的待测理论浓度一致,进样分析得峰面积,重复进样5次,作为Set1。基质效应为(Set2-Set0)/Set1×100%,提取回收率为(Set3-Set0)/(Set2-Set0)×100%。低、中、高3种浓度(以睾酮为例:2.06、20.60、82.40 ng/mL)7种甾类激素的提取回收率均在80%~119%间,基质效应均在85%~112%间,具体结果见表 3,符合含量测定要求。
|
|
表 3 7种甾类激素的提取回收率和基质效应 Tab 3 Extraction recoveries and matrix effects of seven steroid hormones in human serum |
2.6 稳定性考察
制备含7种甾类激素的低、中、高浓度(以睾酮为例:2.06、20.60、82.40 ng/mL)标准含药血清,分别考察室温放置6 h后处理、处理后室温放置24 h、3个冻融循环以及-80℃保存30 d时的稳定性,测定结果的RSD均< 15%,表明样本在以上保存条件下均稳定。
2.7 样品测定结果用1.3和1.4项下LC-MS/MS法对人体内的7种甾类激素进行含量测定(黄体酮在大多数样品中含量低于最低定量限,因此在结果中不予讨论)。数据采用SPSS 18.0软件进行统计分析,与健康组相比,肝癌组患者雌激素水平升高,而雄激素水平降低,糖皮质激素变化不明显。其中,雌二醇和雌酮含量升高(P < 0.05),睾酮水平降低(P < 0.05),其余激素含量组间差异无统计学意义,结果见表 4。
|
|
表 4 甾类激素在肝癌患者和健康志愿者体内含量差异 Tab 4 The difference of 6 steroid hormones between two groups |
3 讨论
相对于雄激素和糖皮质激素,人血清中的雌激素浓度极低,据相关文献报道平均浓度均为pg级,且多采用生物法进行测定,如诊断实验室常用的RIA,检测限可达10 pg/mL[12]。预实验结果表明, 雌激素结构稳定,在传统的ESI和APCI源下较难离子化,所得检测限均达不到体内样品测定需求。有文献报道采用衍生化的方法提高雌激素的响应,选择合适的衍生化试剂可以大大增加灵敏度[13]。丹磺酰氯具有较强的荧光吸收,常用于结构中含有伯、仲氨基及酚羟基化合物的测定,反应条件温和,且衍生物稳定。雌激素结构中的酚羟基可以与丹磺酰氯中的酰氯基团发生反应,所生成的衍生物具有较好的色谱保留行为、分离选择性和更高的质谱响应。由于经衍生化后的样品呈碱性,因此色谱条件中流动相pH的调节也是影响分析物测定的关键因素。本实验发现在水相中加入一定量低挥发性电解质甲酸可以在很大程度上提高离子化效应,从而增加质谱响应,提高检测灵敏度。对所建立的方法进行验证,结果证明其线性、准确度、回收率、基质效应和稳定性均符合生物样品测定标准。
| [1] | FABREGAT A, KOTRONOULAS A, MARCOS J, JOGLAR J, ALFONSO I, SEGURA J, et al. Detection, synthesis and characterization of metabolites of steroid hormones conjugated with cysteine[J]. Steroids , 2013, 78 :327–336. DOI:10.1016/j.steroids.2012.11.017 |
| [2] | ZHANG Y. Understanding the gender disparity in bladder cancer risk:the impact of sex hormones and liver on bladder susceptibility to carcinogens[J]. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev , 2013, 31 :287–304. DOI:10.1080/10590501.2013.844755 |
| [3] | TANAKA K, SAKAI H, HASHIZUME M, HIROHATA T. Serum testosterone:estradiol ratio and the development of hepatocellular carcinoma among male cirrhotic patients[J]. Cancer Res , 2000, 60 :5106–5110. |
| [4] | BELAIDI N, GEORGES A, BROSSAUD J, CORCUFF J B. Aldosterone determination:comparison of a RIA assay and a CLIA assay[J]. Clin Biochem , 2015, 48 :89–92. DOI:10.1016/j.clinbiochem.2014.10.008 |
| [5] | HAYES L D, SCULTHORPE N, YOUNG J D, BAKER J S, GRACE F M. Critical difference applied to exercise-induced salivary testosterone and cortisol using enzyme-linked immunosorbent assay (ELISA):distinguishing biological from statistical change[J]. J Physiol Biochem , 2014, 70 :991–996. DOI:10.1007/s13105-014-0368-6 |
| [6] | MORENO-PEREZ O, ESCOIN C, SERNA-CANDEL C, PORTILLA J, BOIX V, ALFAYATE R, et al. The determination of total testosterone and free testosterone (RIA) are not applicable to the evaluation of gonadal function in HIV-infected males[J]. J Sex Med , 2010, 7 :2873–2883. DOI:10.1111/j.1743-6109.2010.01886.x |
| [7] | BVTTLER R M, MARTENS F, FANELLI F, PHAM H T, KUSHNIR M M, JANSSEN M J, et al. Comparison of 7 published LC-MS/MS methods for the simultaneous measurement of testosterone, androstenedione, and dehydroepiandrosterone in serum[J]. Clin Chem , 2015, 61 :1475–1483. DOI:10.1373/clinchem.2015.242859 |
| [8] | KOAL T, SCHMIEDERER D, PHAM-TUAN H, RÖHRING C, RAUH M. Standardized LC-MS/MS based steroid hormone profile-analysis[J]. J Steroid Biochem Mol Biol , 2012, 129 :129–138. DOI:10.1016/j.jsbmb.2011.12.001 |
| [9] | HANSEN M, JACOBSEN N W, NIELSEN F K, BJÖRKLUND E, STYRISHAVE B, HALLING-SØRENSEN B. Determination of steroid hormones in blood by GC-MS/MS[J]. Anal Bioanal Chem , 2011, 400 :3409–3417. DOI:10.1007/s00216-011-5038-8 |
| [10] | SOLDIN S J, SOLDIN O P. Steroid hormone analysis by tandem mass spectrometry[J]. Clin Chem , 2009, 55 :1061–1066. DOI:10.1373/clinchem.2007.100008 |
| [11] | HANAHAN D, WEINBERG R A. Hallmarks of cancer:the next generation[J]. Cell , 2011, 144 :646–674. DOI:10.1016/j.cell.2011.02.013 |
| [12] | MCDONALD J G, MATTHEW S, AUCHUS R J. Steroid profiling by gas chromatography-mass spectrometry and high performance liquid chromatography-mass spectrometry for adrenal diseases[J]. Horm Cancer , 2011, 2 :324–332. DOI:10.1007/s12672-011-0099-x |
| [13] | RAUH M. Steroid measurement with LC-MS/MS. Application examples in pediatrics[J]. J Steroid Biochem Mol Biol , 2010, 121 :520–527. DOI:10.1016/j.jsbmb.2009.12.007 |
 2016, Vol. 37
2016, Vol. 37


