2. 三峡大学第二临床医学院妇产科, 宜昌 443001
2. Department of Obstetrics and Gynecology, The Second Clinical Medicine College, China Three Gorges University, Yichang 443001, Hubei, China
宫颈癌是导致女性死亡的第三大原因[1]。世界范围大样本研究表明,几乎所有的宫颈癌及大多数宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)都存在人乳头瘤病毒(human papillomavirus, HPV)感染[2-3]。宫颈癌的发生是一个多因素、多步骤、多基因共同作用的结果,从HPV感染到癌变形成需经历一个漫长的过程,大约需要10~20年,且感染大多呈潜伏状态,早期开展大规模HPV感染的筛查是预防宫颈癌发生的关键性措施。目前应用于临床预防宫颈癌筛查的方法有细胞病理学检测和分子生物学检测2种[4],即基于薄层液基细胞学检测(TCT)系统进行的细胞病理学检测和以实时定量PCR和分子杂交为基础的分子生物学检测,但这2种方法都具有检测成本高、检测效率低、检测型别覆盖率不全面等缺点。因此,寻求一种高准确性、低成本、覆盖型别全面的检测方法很有必要。本课题组前期找到了一段可用于诱导识别所有HPV主要外壳蛋白(major capsid protein,L1)的抗体诱导物,是一段长30个氨基酸残基的多肽,位于HPV L1 C末端一段高度保守的序列内[5-6],本研究基于本课题组前期对该HPV L1 C末端保守序列诱导的单克隆抗体检测能力的研究[7],来探讨HPV L1 C末端共同序列诱导的单克隆抗体对宫颈脱落细胞内HPV的检测能力,探索研发用于临床筛查HPV广谱ELISA试剂盒的可行性。
1 材料和方法 1.1 HPV L1 C末端共同序列多肽诱导的单克隆抗体的制备及其反应位点和效价的检测委托上海耀强生物有限公司人工合成一段30个氨基酸长度的HPV L1 C末端保守序列多肽,序列为EVNLKEKFSADLDQFPLGRKFLLQAGLKAK,其C末端连接一个半胱氨酸得到EC31,并合成以该保守序列为基础的15个氨基酸残基长、N端起相互错开5个氨基酸残基的4个小肽(EF15、EK15、DA15、PK15)。单克隆抗体委托北京天成生物有限公司制备。方法简述如下:将合成的EC31分别与载体蛋白钥孔血蓝蛋白(KLH)和牛血清白蛋白(BSA)偶联,形成EC31-KLH(免疫抗原)和EC31-BSA(检测抗原),将EC31-KLH溶于生理盐水中,加入等体积佐剂制成乳化剂,免疫雌性BALB/c小鼠,取免疫后的小鼠脾细胞,与SP2/0骨髓瘤细胞进行融合,制备杂交瘤细胞株。采用ELISA方法筛选出阳性杂交瘤细胞株,经多次克隆获得稳定的单克隆细胞株,以腹水瘤的形式生产抗体,对抗体进行纯化,得到2株纯化小鼠单克隆抗体3A9和5A4,并且将以上抗体进行生物素化标记,形成生物素标记化单克隆抗体,检测2株单克隆抗体的反应位点及其效价,然后分装、冻干备用。
1.2 标本采集收集2014年4月至2015年6月于三峡大学第二临床医学院妇科门诊进行宫颈脱落细胞HPV感染检查的剩余标本,均达到满意标本量。所有标本均来自妇科门诊首诊患者, 均于-80℃保存备用。所有受检者在获取其标本之前均被告知研究意义,并签署患者知情同意书。
1.3 临床检验结果的取得所有标本均经检验科使用广东凯普生物科技有限公司生产的HPV分型检测试剂盒(国药准字S20060011)进行HPV分型检测,该分型检测试剂盒是已经获得国家批准的可以应用于临床检测的试剂盒,其能检出21种HPV型别(6、11、42、43、44、16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、CP8304)的感染。检验科HPV阳性检出结果包括阳性感染及其感染的型别。从病理科取得其中做过TCT检查标本的检查结果, TCT诊断采用2001年国际癌症协会推荐的TBS (the Bethesda system)诊断标准,诊断包括:(1)无上皮内病变或恶性病变(NIML);(2)鳞状细胞异常, 包括意义不明确的非典型鳞状细胞(ASC-US)、不典型鳞状细胞不能除外高级别鳞状上皮内病变(ASC-H)、低级别鳞状上皮内病变(LSIL)、高级别鳞状上皮内病变(HSIL)、鳞状细胞癌(SCC);(3)腺细胞异常(AGUS);(4)腺癌(AC)。
1.4 宫颈脱落细胞标本免疫组化检测将宫颈脱落细胞保存液离心,取脱落细胞,PBS清洗3次,均匀滴在免疫组化防脱载玻片上,室温晾干,75%乙醇固定,3%H2O2处理内源性过氧化物酶,5%牛血清白蛋白室温封闭。采用1:2 000稀释的生物素标记的小鼠单克隆抗体3A9和5A4混合作为一抗,4℃过夜,PBS冲洗,加入1:5 000稀释的亲和素标记的辣根过氧化物酶,DAB显色,苏木精复染细胞核,最后洗涤、脱水、透明、树胶封片,显微镜观察,留图。用生殖器尖锐湿疣病理切片作为免疫组化阳性对照。
1.5 统计学处理应用SPSS 19.0统计学软件进行数据处理,计数资料以率(百分比)表示,组间差异的比较采用χ2检验和Kappa一致性检验。检验水准(α)为0.05。
2 结果 2.1 HPV L1 C末端共同序列多肽诱导的单克隆抗体的反应位点和效价经北京天成生物有限公司ELISA方法检测,纯化单克隆抗体3A9的效价为1:640 000(D值1.372 2),5A4效价为1:640 000(D值1.390 0)。经小肽封闭实验检测3A9的反应位点和5A4的反应位点,3A9反应表位在DA15和PK15氨基酸序列区间内,而5A4反应表位在EK15和DA15的氨基酸序列区间内。
2.2 检验科分型检测试剂盒检测结果共收集到384例临床标本,患者年龄为18~76岁,集中于25~50岁(占86.46%,332/384)。检验科HPV分型检测试剂盒测得阳性例数为63例,阳性检出率为16.41%(63/384)。
2.3 病理科TCT检测结果在384例标本中,做过TCT检查的标本数为339例,患者年龄为21~76岁,集中于30~55岁(占82.60%,280/339)。诊断为宫颈病变者15例,检出率为4.42%(15/339),其中ASC-US 11例、LSIL 3例、HSIL 1例,未见腺细胞异常和宫颈癌病例。
2.4 检验科分型检测试剂盒检测TCT阳性标本结果这15例细胞学阳性患者,临床医院检验科应用HPV分型检测试剂盒检测阳性例数为6例(ASC-US 3例,LSIL 2例,HSIL 1例),总检出率为40.00%(6/15),其中ASC-US检出符合率27.27%(3/11)、LSIL检出符合率66.67%(2/3)、HSIL检出符合率100%(1/1)。
2.5 光镜免疫组化方法检测标本HPV感染结果共对380例宫颈脱落细胞标本进行了免疫组化检测,共检测出120例HPV阳性标本,HPV总检出率为31.58%(120/380),对HPV分型检测试剂盒检出阳性的61例标本以单克隆抗体进行免疫组化检测,阳性例数为56例,符合率为91.80%(56/61)。有HPV感染的阳性细胞表现为细胞核或者胞质着色,呈黄褐色,且细胞核常较大,或呈异形性。无HPV感染的细胞为阴性反应,胞质不着色,或颜色浅淡,细胞核小,且呈蓝色(图 1)。
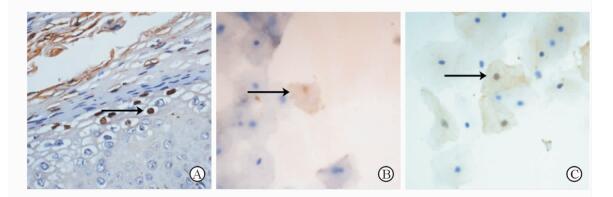
|
图 1 生殖器疣及宫颈脱落细胞标本的免疫组织化学检测 Fig 1 Immunohistochemical staining of genital condyloma acuminatum and cervical exfoliated cell specimens |
2.6 TCT阳性细胞的免疫组化检测结果
进行免疫组化检测的380例标本中,有14例TCT检查阳性标本,免疫组化方法检测阳性例数为10例,检出率为71.43%(10/14);对这14例TCT异常标本而言,HPV分型检测试剂盒阳性检出例数为5例,并且这5例阳性标本应用免疫组化检测也全部是阳性;另外这14例标本通过免疫组化均可看出细胞病理学有异常(表 1)。说明免疫组化对TCT阳性标本的检出符合度高于分型检测试剂盒。病变标本的免疫组化结果见图 2。其余4例免疫组化检测阴性的标本,HPV分型检测试剂盒检测也为阴性,但其免疫组化涂片染色结果也显示出细胞形态的改变。
|
|
表 1 TCT阳性细胞的免疫组化检测结果 Tab 1 The detection result of TCT positive specimens by IHC |

|
图 2 TCT阳性标本的免疫组化检测 Fig 2 Immunhistochemical staining of the TCT positive specimens |
2.7 统计学分析结果
经χ2检验分析,分型检测试剂盒检测和免疫组织化学检测对宫颈脱落细胞标本内HPV检查结果差异有统计学意义(P < 0.05, 表 2)。两种结果进行Kappa一致性分析,得到Kappa=0.52。
|
|
表 2 免疫组化法检测结果与分子生物学检测结果比较 Tab 2 Comparison of IHC detection result and Human Papillomavirus Genotyping Diagnosis Kit result |
3 讨论
宫颈癌是妇科常见恶性肿瘤之一,目前的统计数据显示宫颈癌已经成为继乳腺癌之后第二大威胁女性生命的恶性肿瘤,在某些发展中国家甚至超过乳腺癌位于第一位。全世界每年约有371 200例新发病例,其中80%在发展中国家。我国宫颈癌的发生率和死亡率约占全世界的1/3,每年平均有132 300例新发宫颈癌患者,总发病率为0.27‰[8]。
西方发达国家由于经济条件允许,可以广泛开展HPV感染的分子生物学筛查。据报道发达国家通过有组织的宫颈癌筛查,使宫颈癌发病率减少30%~60%[9]。现已上市的检测HPV的方法有多种,如二代杂交捕获(HCⅡ)技术、PCR或基因芯片技术等,但是由于HPV基因变异的问题,新的HPV型别还在不断出现,现有的型别又在不断变异[10-11],以通用性引物为基础的PCR检测出现漏检和错检是很正常的。也就是说现今商用的分子生物学检测没有一个能做到型别全覆盖,经常出现错检、漏检。因此,寻求一种高准确性、低成本、覆盖型别全面的检测方法很有必要。
本课题组前期研究对由HPV L1 C末端共同保守序列多肽制备的抗HPV L1单克隆及多克隆抗体采用ELISA、蛋白免疫印迹法及免疫组织化学方法,分别从免疫学和形态学角度对抗体的检测能力进行了鉴定,结果证实这些单克隆抗体或多克隆抗体可以特异性地检测出多型别的HPV L1,对型别相同的HPV其检测能力与市售的多价抗HPV L1单克隆抗体(Millipore公司生产,可检测HPV 1、6、11、16、18、31型别)基本相当[7]。
本研究按国家免疫组织化学检测试剂盒制备规范要求,采用HPV L1 C末端共同序列诱导的2种不同反应位点的生物素标记单克隆抗体3A9和5A4混合作为检测抗体,进行直接法的免疫组化检测,并采用高敏感性的生物素-亲和素系统显色。作为由HPV感染的鳞状上皮的良性病变,尖锐湿疣在上皮的表层有晚期蛋白L1和L2的表达,用以组装形成完整的病毒颗粒[12], 因此,尖锐湿疣可以作为良好的L1表达阳性对照。本研究用于对照的基于PCR技术的广东凯普生物科技有限公司生产的HPV分型检测试剂盒是已经获得国家批准的可以应用于临床检测的试剂盒,我们选择该试剂盒作为检测的金标准,以检测我们制备的单克隆抗体对有HPV感染的临床标本的HPV检测能力。检测结果显示,受检标本及阳性对照标本中某些细胞细胞核和(或)胞质被染成黄褐色,与邻近正常细胞相比差异明显,说明反应是特异性的,这些细胞有HPV L1蛋白表达。在本实验中可见以细胞病理学的检测结果为对照,凡是TCT检测阳性的标本,只要HPV分型检测试剂盒检测为阳性,本组单克隆抗体免疫组化检测也全部是阳性;免疫组化检测阳性的TCT标本,即便是分型检测结果为阴性,其细胞病理学均有异常。说明本组抗体既与HPV分型检测试剂盒有很高的检出一致性,也与TCT细胞病理学的检测结果高度符合。因此,本组抗体的免疫组化结果具有较高的可信度。单克隆抗体的检出率高于分型检测试剂盒的检出率,2种检测方法相比差异具有统计学意义(P < 0.05)。对这2种检测方法结果进行Kappa一致性分析,虽然一致性一般,但是这是由于2种检测方法差异具有统计学意义造成的。另外本实验标本HPV阳性检出率明显高于HPV分型检测试剂盒的检出率,分析差异如此明显的原因,可能系HPV分型检测试剂盒能够检出的型别有限。而本研究的免疫组织化学检测方法标本处理简单,抗原损失少,且本抗体为广谱HPV检测抗体,故阳性检出率相对较高。此外,本实验应用单克隆抗体免疫组化方法既可以检出HPV的感染,又可以清楚看到宫颈脱落细胞的形态改变,包括细胞大小、细胞核的大小、细胞形状等形态方面的改变,可以为宫颈脱落细胞的筛查提供HPV检测和细胞病理形态双重诊断依据。
综上所述,本研究初步证实本研究制备的单克隆抗体对宫颈脱细胞内的HPV具有良好的检出能力,同时,对多型别HPV具有良好的广谱性反应能力。这一结果为后继研制经济、高效、广覆盖的HPV筛查试剂盒奠定了良好的基础。
| [1] | ZAGOURI F, SERGENTANIS T N, CHRYSIKOS D, FILIPITS M, BARTSCH R. Molecularly targeted therapies in cervical cancer. A systematic review[J]. Gynecol Oncol , 2012, 126 :291–303. DOI:10.1016/j.ygyno.2012.04.007 |
| [2] | SÁNCHEZ-LANDER J, CORTIÑAS P, LOUREIRO C L, PUJOL F H, MEDINA F, CAPOTE-NEGRÍN L, et al. Human papillomavirus in invasive cervical cancer and cervical intraepithelial neoplasia 2 and 3 in venezuela:a cross-sectional study[J]. Cancer Epidemiol , 2012, 36 :e284–e287. DOI:10.1016/j.canep.2012.04.005 |
| [3] | DE S S, QUINT W G, ALEMANY L, GERAETS D T, KLAUSTERMEIER J E, LLOVERAS B, et al. Human papillomavirus genotype attribution in invasive cervical cancer:a retrospective cross-sectional worldwide study[J]. Lancet Oncol , 2010, 11 :1048–1056. DOI:10.1016/S1470-2045(10)70230-8 |
| [4] | KITCHENER H C, ALMONTE M, GILHAM C, DOWIE R, STOYKOVA B, SARGENT A, et al. ARTISTIC:a randomised trial of human papillomavirus (HPV) testing in primary cervical screening[J]. Health Technol Assess , 2009, 13 :1–150. |
| [5] | 姜波玲, 肖长义, 叶红. HPVL 1共同保守序列多肽对多价性HPV阳性临床标本的检测[J]. 肿瘤 , 2008, 28 :864–868. |
| [6] | 姜波玲, 肖长义, 袁太宁, 叶红, 王雅琴, 黎家华, 等. HPV L1 C-末端保守序列短肽体液免疫学特性[J]. 免疫学杂志 , 2009 (3) :239–242. |
| [7] | 孙伟, 肖长义, 李志英, 叶红, 王雅琴, 袁太宁, 等. L1 C-末端共同序列多肽抗体检测宫颈液基细胞学标本中人乳头瘤病毒[J]. 第二军医大学学报 , 2014, 35 :873–878. |
| [8] | 孙金娥, 肖长义, 付冰冰, 李志英, 叶红, 黎家华, 等. 抗HPV L1小鼠单克隆抗体及兔多克隆抗体的制备[J]. 免疫学杂志 , 2013, 29 :1079–1083. |
| [9] | WU Y, CHEN Y, LI L, YU G, ZHANG Y, HE Y. Associations of high-risk HPV types and viral load with cervical cancer in China[J]. Clin Virol , 2006, 35 :264–269. DOI:10.1016/j.jcv.2005.07.011 |
| [10] | PARKIN D M, BRAY F J, FERLAY J, PISANI P. Global cancer statistics, 2002[J]. CA Cancer Clin , 2005, 55 :74–108. DOI:10.3322/canjclin.55.2.74 |
| [11] | BELLO B, SPINILLO A, ALBERIZZI P, CESARI S, GARDELLA B, SILINI E M. Time trends of human papillomavirus type distribution in Italian women with cervical intraepithelial neoplasia (CIN)[J]. Gynecol Oncol , 2009, 115 :262–266. DOI:10.1016/j.ygyno.2009.07.029 |
| [12] | FREITAS A C, GURGEL A P, CHAGAS B S, COIMBRA E C, DO AMARAL C M. Susceptibility to cervical cancer:an overview[J]. Gynecol Oncol , 2012, 126 :304–311. DOI:10.1016/j.ygyno.2012.03.047 |
| [13] | DOORBAR J, QUINT W, BANKS L, BRAVO I G, STOLER M, BROKER T R, et al. The biology and life-cycle of human papillomaviruses[J]. Vaccine , 2012, 30 (Suppl 5) :F55–F70. |
 2016, Vol. 37
2016, Vol. 37


