2. 第二军医大学海军医学系2012 级学员, 上海 200433;
3. 第二军医大学药学院无机化学教研室, 上海 200433
2. Student of Grade 2012, Faculty of Naval Medicine, Second Military Medical University, Shanghai 200433, China;
3. Department of Inorganic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
创面愈合是一项非常复杂的过程。目前,国内外创面修复的手段有封闭负压引流技术、生长因子治疗技术、创面应用敷料治疗技术、酶学清创治疗技术、组织工程技术、高压氧治疗技术、干细胞和基因治疗技术、自体组织移植技术、物理技术(包括电磁、超声、激光等)。其中以创面应用敷料技术最为方便快捷,且在国外已有相对成熟的产品,如法国优格公司生产的安普贴系列、英国施乐辉公司的安舒妥系列、美国施贵宝公司的多爱敷凝胶系列等。但上述产品仅对轻度创伤具有良好的修复作用,且创伤修复周期相对较长[1-4]。
纳米粒是大小为10~1 000 nm的固态胶体颗粒,可作为药物传输的载体[5-6]。纳米载药系统是运用纳米载药技术而产生的一种新型药物载体,具有靶向性、控释性和表面可修饰性等特点,可以有效通过黏膜表面并转运进入体循环[7]。壳聚糖作为新型药物载体材料,具有优异的生物降解性、生物相容性、生物黏附性和促进药物吸收的作用[8-9]。驻极体是一类能够长期储存空间电荷和极化电荷的功能电介质材料,具有外静电场效应、微电流效应、压电效应和热释电效应等;其中驻极体外电场效应可对外提供长期稳定的静电场。驻极体透皮给药系统是一种以驻极体作为电驱动源,通过打开皮肤角质层脂质双分子间隙和拓宽毛囊孔径来增加药物通透量的新型经皮给药手段[10-13]。
本研究采用表皮生长因子(epidermal growth factor,EGF)作为模型药物,以季铵化壳聚糖为载体材料、三聚磷酸钠(TPP)为交联剂,采用离子交联法在不同表面电位驻极体产生的外静电场下制备壳聚糖生长因子纳米粒。通过粒径-zeta电位仪检测纳米粒的粒径和zeta电位,透射电镜观察纳米粒的形态、分散度,以及外静电场对纳米粒制备和表征的影响,旨在优化纳米粒的制备方法,提高药物的经皮给药效率。
1 材料和方法 1.1 材料和试剂聚丙烯(polypropylene,PP)膜为日本东丽株式会社生产的商品膜,膜厚13μm。季铵化壳聚糖购自南通绿神生物工程有限公司。三聚磷酸钠(TPP)、冰醋酸、磷酸二氢钾、氢氧化钠、EGF均购自上海国药集团化学试剂有限公司。
1.2 驻极体的制备用栅控恒压电晕充电系统(大连理工大学静电与特种电源研究所)对双裸面PP膜进行充电,充电针压为-10 kV,栅压分别为500、1 000和1 500 V,充电时间为7 min,制备成不同表面电位的正、负极性PP驻极体。
1.3 季铵化壳聚糖生长因子纳米粒的制备 1.3.1 EGF溶液的配制准确称取0.4 g氢氧化钠固体,置于100 mL容量瓶中,加水溶解,稀释定容至刻度,得到0.1 mol/L的氢氧化钠溶液。再精确称取1.361 g磷酸二氢钾固体,置于200 mL的容量瓶中,加适量水溶解后加入0.1 mol/L的氢氧化钠溶液79 mL,加水定容至刻度、混匀,即得pH 7.4的PBS缓冲液。取用0.625 mL PBS将100μg EGF溶解,得质量浓度为160μg/mL的EGF溶液。
1.3.2 空白纳米粒和季铵化壳聚糖生长因子纳米粒的制备配制质量浓度为1、2、5 mg/mL的季铵化壳聚糖溶液,分别取各浓度季铵化壳聚糖溶液2 mL,置于JB-3型定时恒温磁力搅拌器(上海雷磁新泾仪器有限公司)中后滴加2 mL质量浓度为1 mg/mL的TPP水溶液,室温下磁力搅拌30 min,得空白纳米粒。在上述两种溶液的基础上再滴加2μL质量浓度为160μg/mL的EGF溶液,同条件下制备得季铵化壳聚糖生长因子纳米粒。
1.3.3 不同电场条件下季铵化壳聚糖生长因子纳米粒的制备分别在栅压为500、1 000和1 500 V下驻极体产生的外静电场中按1.3.2项下方法制备季铵化壳聚糖生长因子纳米粒。
1.4 纳米粒表征的测定取1滴新鲜制备的纳米粒混悬液,滴至300目的铜网上,停留3 min后,烘干,置于透射电镜(JEM1230,日本JEOL公司)下观察纳米粒的表面形态并拍照。观察各组纳米粒的形态、分散度及稳定性;用Zen3600HS粒径-zeta电位仪(英国Malvern公司)测定各组纳米粒的粒径和zeta电位,测量8次取平均值。
2 结果和讨论 2.1 季铵化壳聚糖生长因子纳米粒的制备 2.1.1 空白纳米粒的形态与分布采用离子交联法制备的空白纳米粒(季铵化壳聚糖与TPP质量浓度比为2∶1)的表面形态如图 1所示,纳米粒呈类球形、分布较为均匀、稳定性强。粒径-zeta电位分析仪测得空白纳米粒的平均粒径为(200.0±7.4) nm,平均zeta电位为(12.75±0.65) mV。结果表明用离子交联法制备季铵化壳聚糖纳米粒的方法可行,其粒径值符合经皮给药的要求。

|
图 1 空白纳米粒的透射电镜形态 Fig 1 Morphology of blank nanoparticles under transmission electron microscope |
2.1.2 季铵化壳聚糖的浓度对纳米粒粒径的影响
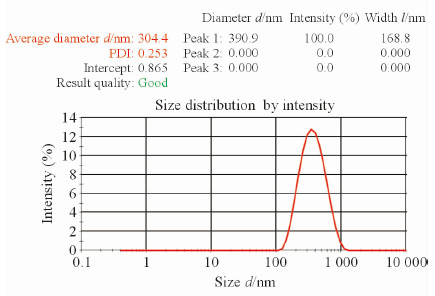
透射电镜下观察季铵化壳聚糖生长因子纳米粒的形态和粒径分布,结果显示,季铵化壳聚糖生长因子纳米粒的形态与空白纳米粒类似、分布较均匀,聚合度和分散度也没有发生明显变化;但季铵化壳聚糖生长因子纳米粒的粒径增加,平均粒径为(296.2±12.3) nm,其粒径分布如图 2所示。分析其原因可能是因为在纳米粒的制备过程中,EGF与纳米粒聚合时使EGF被包裹于纳米粒内或吸附于纳米粒表面,导致纳米粒粒径增大。粒径-zeta电位分析仪测得季铵化壳聚糖生长因子纳米粒的平均zeta电位为(11.1±0.7) mV,与空白纳米粒相比并无太大变化,表明季铵化壳聚糖生长因子纳米粒具有良好的稳定性。
|
图 2 季铵化壳聚糖生长因子纳米粒的粒径分布 Fig 2 Particle size distribution of the EGF-loading chitosan nanoparticles |
为进一步探究季铵化壳聚糖浓度对制备纳米粒粒径的影响,保持TPP的浓度不变,配制季铵化壳聚糖浓度不同的季铵化壳聚糖生长因子纳米粒混悬液,测量其粒径与zeta电位。结果(表 1)显示,季铵化壳聚糖生长因子纳米粒的粒径随季铵化壳聚糖浓度的增加而增大,提示季铵化壳聚糖的浓度可能是调控季铵化壳聚糖生长因子纳米粒粒径的主要因素。当季铵化壳聚糖质量浓度与TPP质量浓度之比为2∶1时,所得纳米粒的zeta电位最高,为(34.1±0.9) mV,可见此浓度配比下制备的季铵化壳聚糖生长因子纳米粒的稳定性最高。从经皮转运的角度出发,实验后期一般是将纳米粒制剂外敷局部给药,因此,本研究选择粒径最小、稳定性相对较高的季铵化壳聚糖生长因子纳米粒(季铵化壳聚糖与TPP的质量浓度之比为2∶1)进行后期的实验研究。
|
|
表 1 不同季铵化壳聚糖浓度下壳聚糖生长因子纳米粒的粒径和zeta电位 Tab 1 Size and zeta potential of the EGF-loading nanoparticles with different chitosan concentrations |
2.2 不同电场条件下季铵化壳聚糖生长因子纳米粒的形态及分布 2.2.1 正极性驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒
分别在+500、+1 000和+1 500 V驻极体静电场作用下制备得3种经正极性驻极体处理的季铵化壳聚糖生长因子纳米粒。结果(图 3)发现,+1 000 V季铵化壳聚糖生长因子纳米粒的形态和无静电场处理后的纳米粒类似,但出现更多粒径较小的纳米粒,个别区域存在纳米粒团聚现象。这可能是由于静电场将季铵化壳聚糖生长因子纳米粒极化,产生正、负带电体,静电相吸作用导致的团聚现象。

|
图 3 +1 000 V驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒的透射电镜形态 Fig 3 Transmission electron microscopic findings of the EGF-loading chitosan nanoparticles under +1 000 V electret electrostatic field |
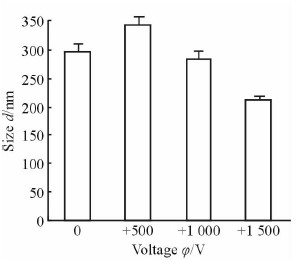
此外,研究(图 4)发现,在正极性驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒的平均粒径随电压的升高而减小;+500 V驻极体静电场作用下制备的纳米粒的平均粒径为(343.4±13.1) nm,高于不加电场时纳米粒的平均粒径(296.2±12.3) nm。但在+500 V驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒的平均zeta电位小于10 mV,表明在此条件下制备的季铵化壳聚糖生长因子纳米粒的粒径增大可能是由于纳米颗粒不稳定,导致团聚加剧所致。而+1 000 V驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒粒径基本接近无电场作用下的季铵化壳聚糖生长因子纳米粒;至+1 500 V时,纳米粒粒径急剧减小至(211.8±3.3) nm。综上可见,外静电场的场强大小是影响季铵化壳聚糖生长因子纳米粒粒径值的因素,要寻找较小粒径的季铵化壳聚糖生长因子纳米粒,为后期纳米粒经皮进入人体循环系统做前期准备,必须选择合适的电场参数进行处理。
|
图 4 正极性驻极体静电场作用下制备的季铵化壳聚糖生长因子溶液纳米粒的粒径值 Fig 4 EGF-loading nanoparticle size under positive electret electrostatic field |
2.2.2 负极性驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒
分别在-500、-1 000和-1 500 V驻极体静电场作用下制备得3种季铵化壳聚糖生长因子纳米粒。结果(图 5)发现,在-1 000 V驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒分布不均、团聚现象明显增多。

|
图 5 -1 000 V驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒的透射电镜形态 Fig 5 Transmission electron microscopic findings of the EGF-loading chitosan nanoparticles under-1 000 V electret electrostatic field |
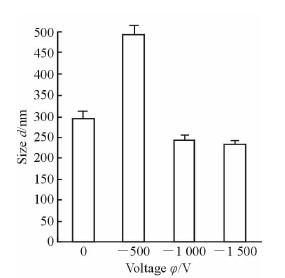
此外,由图 6可见,在负极性驻极体静电场作用下,季铵化壳聚糖生长因子纳米粒的粒径亦随所加电压绝对值的增大而减小。当电压绝对值较小(-500 V)时,壳聚糖生长因子纳米粒的粒径大于无电场处理时的纳米粒;至-1 000 V,纳米粒粒径小于无电场作用时的纳米粒;至-1 500 V时,纳米粒粒径进一步减小,但幅度不大。因此,正、负极性驻极体静电场处理后的季铵化壳聚糖生长因子纳米粒粒径的变化规律一致。
|
图 6 负极性驻极体静电场作用下制备的季铵化壳聚糖溶液生长因子纳米粒的粒径值 Fig 6 EGF-loading chitosan nanoparticle size under negative electret electrostatic field |
2.2.3 电场参数对壳聚糖纳米粒表面性征参数的影响
为探究电场极性驻极体静电场处理后的季铵化壳聚糖生长因子纳米粒的稳定性,本研究检测了+1 000 V、-1 000 V季铵化壳聚糖生长因子纳米粒的zeta电位,结果发现,+1 000 V季铵化壳聚糖生长因子纳米粒的平均zeta电位为(14.2±1.1) mV,高于未经静电场处理的纳米粒(11.1±0.7) mV;而-1 000 V季铵化壳聚糖生长因子纳米粒的平均zeta电位仅为(8.4±1.0) mV,表明负极性驻极体处理后的季铵化壳聚糖生长因子纳米粒的稳定性和表面性征较差。
为深入探究电场参数对季铵化壳聚糖生长因子纳米粒的极化影响,将空白纳米粒溶液、未经静电场处理的季铵化壳聚糖生长因子纳米粒溶液、+1 000 V和-1 000 V季铵化壳聚糖生长因子纳米粒溶液分别放置1、2、4、8、24、48、72、96 h后测各溶液纳米粒粒径。结果发现,72 h时各溶液样本纳米粒粒径平均值变化明显。与初始时刻相比,空白纳米粒的平均粒径由(200.0±7.4) nm增大至(441.9±11.7) nm,未经静电场处理的壳聚糖生长因子纳米粒由(296.2±12.3) nm增大至(337.1±23.8) nm,而+1 000 V季铵化壳聚糖生长因子纳米粒由(285.3±8.4) nm减小为(67.0±5.0) nm,-1 000 V季铵化壳聚糖生长因子纳米粒由(243.4±17.5) nm减小为(81.7±2.7) nm。结果表明,随着时间的推移,未经静电场处理的纳米粒自然团聚现象加剧;而静电场处理后的纳米粒会形成粒径更小的纳米粒。原因可能是去除静电场后,随着时间的推移,季铵化壳聚糖生长因子纳米粒发生了去极化,纳米粒表面双电层的电量减小,静电排斥作用占主导地位,壳聚糖纳米粒分子分解,交联成更小粒径的纳米粒。
3 结论季铵化壳聚糖的浓度是影响季铵化壳聚糖生长因子纳米粒粒径的重要因素。静电场处理后的季铵化壳聚糖生长因子纳米粒的形态、粒径和zeta电位与驻极体的极性和表面电位密切相关,其中正极性驻极体静电场作用下制备的季铵化壳聚糖生长因子纳米粒表面性征优于负极性驻极体。去除静电场后,随着时间的推移,季铵化壳聚糖生长因子纳米粒会发生去极化过程。因此,要制备粒径适当、稳定性好的纳米粒,必须选择合理的电场参数。
| [1] | FU X B, LI H H. Mesenchymal stem cells and skin wound repair and regeneration:possibilities and questions[J]. Cell Tissue Res , 2009, 335 :317–321. |
| [2] | SORRELL J M, CAPLAN A I. Topical delivery of mesenchymal stem cells and their function in wounds[J]. Stem Cell Res Ther , 2010, 1 :1–6. |
| [3] | 冯永强, 冷婷婷, 王一兵. 电场对创面愈合的影响[J]. 中国美容医学 , 2008, 17 :1550–1552. |
| [4] | NUCCITELLI R, NUCCITELLI P, RAMLATCHAN S, SANGER R, SMITH P J. Imaging the electric field associated with mouse and human skin wounds[J]. Wound Repair Regen , 2008, 16 :432–441. |
| [5] | DDMGE C, VRANCKX H, BALSCHMIDT P. Poly (alkyl-cyanoacrylate) nanospheresfororal adminstration of insulin[J]. J Pharm Sci , 1997, 86 :1403–1409. |
| [6] | 奇云. 21世纪的纳米医学展望[J]. 现代诊断与治疗 , 2001, 12 :1547. |
| [7] | 欧歌, 廖德华, 张凯, 戴伟, 向大熊. 采用离子交联法制备胰岛素纳米粒的研究进展[J]. 中南药学 , 2013, 11 :116–120. |
| [8] | 任慧梅, 曾令冰, 曾明. 壳聚糖纳米粒作为疫苗佐剂的研究进展[J]. 中国生物制品学杂志 , 2012, 25 :786–788. |
| [9] | 李典, 徐若诗, 徐小平. 壳聚糖微纳米粒子的制备及其在黏膜给药中的应用[J]. 华西药学杂志 , 2014, 29 :219–221. |
| [10] | GUO X, LIANG Y Y, LIU H Y, CUI L L, JIANG J. Study on the electrostatic and piezoelectric properties of positive electret cyclosporine A patch[J]. J Physics , 2013, 418 :012148. |
| [11] | CUI L L, MA L, LIANG Y Y, LIU H Y, GUO X, JIANG J. Enhancing effect of negative PP electret on transdermal delivery of cyclosporine A solution in vitro and its synergistic effect with ethyl oleate[J]. J Physics , 2013, 418 :012149. |
| [12] | CUI L L, LIANG Y Y, MA L, GUO X, LIU H Y, JIANG J. The combinational effect of PP electret and monoolein on transdermal delivery of cyclosporine A in vitro[J]. J Electrostatics , 2013, 71 :224–227. |
| [13] | JIANG J, LIANG Y Y, DONG F J, MA L, LIU H Y, CUI L L. Penetration and stability of external electrostatic field of PP electret through skin[J]. IEEE Trans , 2012, 19 :1137–1142. |
 2016, Vol. 37
2016, Vol. 37


