2. 武警河南总队医院泌尿外科, 郑州 450052;
3. 解放军458 医院泌尿外科, 广州 510602;
4. 第二军医大学长海医院泌尿外科, 上海 200433;
5. 南京大学医学院附属金陵医院、南京军区南京总医院泌尿外科, 南京 210002
2. Department of Urology, Hospital of Chinese People's Armed Police Forces Henan Headquarters, Zhengzhou 450052, Henan, China;
3. Department of Urology, No. 458 Hospital of PLA, Guangzhou 510602, Guangdong, China;
4. Department of Urology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
5. Department of Urology, Jinling Hospital, Nanjing University School of Clinical Medicine, General Hospital, PLA Nanjing Military Area Command, Nanjing 210002, Jiangsu, China
肾细胞癌(renal cell carcinoma,RCC)是肾脏最常见的恶性疾病,在所有肾脏恶性疾病中约占90%[1],近30%的患者在诊断时已发生转移[2],而转移性肾癌对放化疗具有高度的抵抗性,5年生存率仅为5%~15%[3]。近年来以苹果酸舒尼替尼(sunitinib)为代表的新型小分子靶向药物极大改善了晚期肾癌的治疗前景,其中位无进展生存期是接受细胞因子治疗患者的2倍,总缓解率也明显提高[4-5]。但目前仍有相当比重的患者无法获得临床获益,且靶向药物并不能保持持久疗效,多数患者会在治疗开始的6~15个月出现耐药甚至进展[6]。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是一类丝/苏氨酸蛋白激酶,在细胞的增殖、分化及凋亡等进程中发挥重要作用[7]。研究表明,p38MAPK信号通路在肿瘤靶向耐药中发挥了重要作用[8],但国内外对于p38在肾癌中的作用鲜见报道。本研究通过RNA干扰技术沉默肾癌786-O细胞株的p38基因,观察该过程是否对肾癌细胞生物学特性以及舒尼替尼的敏感性产生影响,为肾癌的治疗监测、预后以及靶向耐药方面提供一定的理论依据。
1 材料和方法 1.1 主要材料与试剂人肾癌细胞株786-O(ATCC公司),RPMI 1640培养基(Gibco公司),p38兔抗人单抗(货号4511,Cell Signaling公司),Lipofectamine 2000、反转录ABI试剂盒(Invitrogen公司),Transwell侵袭小室(货号3470,Corning公司),C1052细胞周期试剂盒(碧云天生物技术研究所)。生物分光光度计(SmartSpec plus, Bio-Rad公司),离心机、蛋白电泳及流式细胞仪等常规仪器和试剂均由第二军医大学长海医院中心实验室提供。
1.2 引物设计及合成阳性对照、阴性对照和2条小干扰RNA(siRNA)序列均由上海吉玛化学技术有限公司合成、纯化,siRNA531:正义链为5′-GAG CUG AAC AAG ACA AUC UTT-3′,反义链为5′-AGA UUG UCU UGU UCA GCU CTT-3′;siRNA659:正义链为5′-GUC CAU CAU UCA UGC GAA ATT-3′, 反义链为5′-UUU CGC AUG AAU GAU GGA CTT-3′;阴性对照siRNA:正义链为5′-UUC UCC GAA CGU GUC ACG UTT-3′,反义链为5′-ACG UGA CAC GUU CGG AGA ATT-3′。
1.3 786-O细胞株培养及siRNA瞬时转染人肾癌细胞株786-O置入含10%胎牛血清(FBS)的RPMI 1640培养液中,于37℃、5%CO2饱和湿度孵箱中培养,倒置显微镜下观察细胞生长情况,按1∶3传代。收集处于对数生长期的786-O细胞,胰酶消化,加入新鲜培养液重悬,显微镜下计数。实验分组为转染无义siRNA的阴性对照组、siRNA531转染组(siRNA531组)、siRNA659转染组(siRNA659组)和仅加转染试剂的空白对照组。转染前24 h 786-O细胞经胰酶消化配成密度为1×105/mL的细胞悬液,每孔用2 mL含FBS的新鲜培养液接种在6孔板上,待细胞汇合达到50%~70%,转染前半小时更换为无血清培养液。取9μL siRNA和6μL Lipofectamine 2000,加入250μL的Opti-MEM稀释并充分混合,室温静置20 min形成siRNA/Lipofectamine 2000复合物;各组分别加入不同siRNA/Lipofectamine 2000复合物,轻轻混匀,4~6 h后更换新鲜含FBS培养液。
1.4 RT-PCR检测p38 mRNA的表达采用TRIzol法提取细胞总RNA,各组取等量RNA用反转录试剂盒按说明书行反转录得cDNA,RT-PCR检测各组细胞p38基因的表达水平。p38引物序列:上游5′-CTG GAT TTT GGA CTG GCTCG-3′;下游5′-GGT GTT CCT GTC AGA CGC ATA-3′。RT-PCR条件:预变性95℃30 s;95℃15 s、60℃30 s,进行40个循环。实验重复4次。
1.5 蛋白质印迹法检测p38蛋白的表达分别取阴性对照组、siRNA531组、siRNA659组和空白对照组细胞,采用RIPA裂解液提取细胞总蛋白,每孔上样20μL行10%SDS-PAGE分离,半干电转PVDF膜,5%脱脂奶粉室温封闭2 h。一抗(1∶500)4℃过夜,二抗室温温育2 h,ECL显色,X线片曝光,经显影定影处理后,使用凝胶成像系统检测各组条带灰度值并定量。
1.6 CCK-8法检测786-O细胞的增殖活性及对舒尼替尼的敏感性分别取对数生长期的阴性对照组、siRNA531组、siRNA659组和空白对照组786-O细胞,经胰酶消化后调整细胞密度为1×104/mL,以每孔0.2 mL将细胞悬液加入96孔培养板中。各孔分别于转染后1、2、3、4、5 d时加入90μL RPMI 1640培养液和10μL CCK-8,培养箱中放置1 h后用酶标仪检测各孔在450 nm处的光密度(D)值。另取阴性对照组、siRNA531组和siRNA659组细胞,每组再分别设置实验孔、不加舒尼替尼的对照孔和只有培养液的空白孔;转染24 h后弃去原培养液,各孔分别加浓度为0.1、0.2、0.5、1.0、2.0、5.0和10μmol/mL的舒尼替尼,每孔200μL,继续培养48 h后以上述方法检测各孔D值。细胞存活率计算公式:细胞存活率(%)=[D实验孔-D空白孔]/[D对照孔-D空白孔]×100%,并根据细胞存活率计算其IC50值。
1.7 流式细胞仪检测786-O细胞周期分别取阴性对照组、siRNA531组、siRNA659组和空白对照组786-O细胞,细胞转染48 h后用不含EDTA的胰酶消化收集,冰冷PBS清洗2次,预冷70%乙醇固定,4℃过夜。上机前离心去除乙醇,PBS清洗3次,100 mg/L RNase A 37℃消化40 min;50 g/L PI 4℃染色1 h,流式细胞仪检测各组细胞DNA含量。
1.8 Transwell小室侵袭实验检测细胞的侵袭能力分别取阴性对照组、siRNA531组、siRNA659组和空白对照组786-O细胞,在含10%FBS的RPMI 1640培养液中培养至对数生长期,加入无血清RPMI 1640培养液继续培养24 h。在预先铺有基质胶的Transwell小室上室加入100μL无血清培养的786-O细胞(1×105/mL),下室加入含10%FBS的RPMI 1640培养液。37℃、5%CO2培养箱中孵育24 h后取出,PBS冲洗3次,棉签轻轻拭去微孔膜上层的细胞,0.1%结晶紫染色30 min,倒置显微镜下随机选取6个视野照相、计数细胞,取平均数。
1.9 统计学处理采用SPSS 20.0统计软件进行分析,计量数据以x±s表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
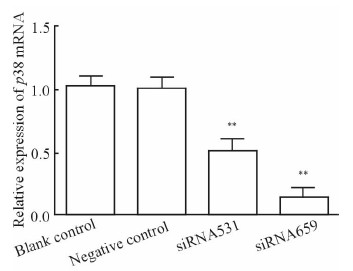
2 结果 2.1 siRNA对各组细胞p38 mRNA表达的影响结果(图 1)表明,siRNA531组和siRNA659组细胞p38 mRNA的表达水平均下降,与对照组比较差异有统计学意义(P<0.01),其中siRNA659组p38 mRNA表达下降更为明显
|
图 1 转染siRNA后各组细胞p38 mRNA的表达 Fig 1 Effect of siRNA interference on p38 mRNA expression in each group |
.2.2 siRNA对各组细胞p38蛋白表达的影响
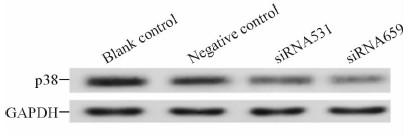
与阴性对照组、空白对照组比较,siRNA531组、siRNA659组p38蛋白的表达水平明显下降,其中siRNA659组p38蛋白表达下降更为明显(图 2),表明合成的两条siRNA均可抑制p38蛋白的表达。
|
图 2 转染siRNA后各组细胞p38蛋白的表达水平 Fig 2 p38 protein expression in 786-O cells transfected with siRNA in each group |
2.3 siRNA对各组细胞增殖活性及舒尼替尼敏感性的影响
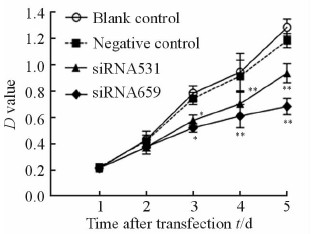
结果(图 3)显示,第3天开始,siRNA531组、siRNA659组786-O细胞的增殖开始受到抑制,3~5 d内两组的增殖水平均低于空白对照组和阴性对照组(P<0.05, P<0.01);其中siRNA659组受到的增殖抑制作用更为明显,但两组比较差异无统计学意义。
|
图 3 转染siRNA后各组细胞的增殖情况 Fig 3 786-O cell proliferation detected by CCK-8 after transfected with siRNA |
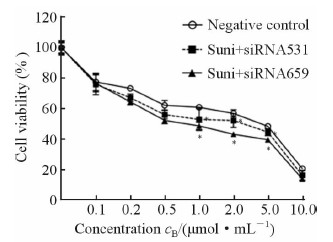
同样使用CCK-8法检测各组细胞对舒尼替尼的药物敏感性,结果(图 4)发现,随着舒尼替尼作用浓度的增加,786-O细胞的生存率逐渐降低,siRNA659组下降更为明显,舒尼替尼浓度为1.0~5.0μmol/mL时与阴性对照组相比差异有统计学意义(P<0.05)。阴性对照组舒尼替尼的IC50值为(5.4±0.2)μmol/mL,siRNA531组为(3.2±0.3)μmol/mL,siRNA659组(1.4±0.1)μmol/mL,组间差异均有统计学意义(P<0.05)。
|
图 4 转染siRNA后各组细胞对舒尼替尼的药物敏感性比较 Fig 4 Comparison of drug sensitivities between experimental groups and control group |
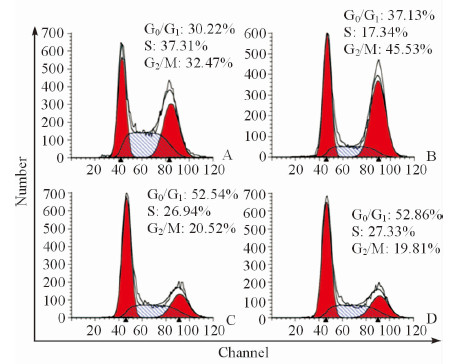
2.4 siRNA对各组细胞周期的影响
流式细胞术检测转染siRNA后各组786-O细胞周期的变化,siRNA531组、siRNA659组G1期细胞数量明显多于阴性对照组和空白对照组,且两组786-O细胞出现G0/G1阻滞,见图 5。
|
图 5 p38基因沉默对786-O细胞周期的影响 Fig 5 Effect of p38 gene silencing on the 786-O cell cycle in each group |
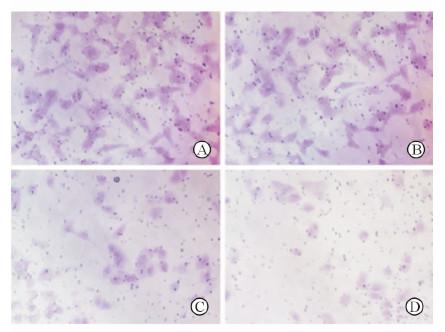
2.5 Transwell小室侵袭实验结果
Transwell小室侵袭实验结果(图 6)显示,siRNA531组、siRNA659组细胞的侵袭能力明显低于阴性对照组细胞,其中siRNA659组细胞侵袭能力下降更为显著。各组细胞24 h穿过微孔膜的细胞数分别为空白对照组85.62±7.57、阴性对照组76.27±5.08、siRNA531组56.43±6.02、siRNA659组34.00±8.12,siRNA531组、siRNA659组与空白对照组和阴性对照组比较差异均有统计学意义(P<0.01)。
|
图 6 转染siRNA后各组细胞的侵袭情况 Fig 6 Effect of p38 siRNA on 786-O cell invasion as determined by transwell assays |
3 讨论
p38MAPK是丝氨酸/苏氨酸激酶高度相关的蛋白激酶超家族,共有4个成员,分别是p38α、p38β、p38γ和p38δ[9],是细胞内重要的信号转导系统之一,存在于大多数细胞内。p38活化环上的苏氨酸和酪氨酸两个位点几乎在所有不良刺激的作用下都会被MAPK激酶(MAP kinase kinases, MKKs)双磷酸化,从而被激活[10]。活化的p38家族成员能通过磷酸化下游的蛋白激酶、转录因子及胞质蛋白等底物调控肿瘤细胞做出各种不同的响应。p38MAPK信号通路与肿瘤细胞生长、增殖、运动及靶向耐药等相关。Kim等[11]研究发现,在H-Ras诱导的细胞侵袭和转移中,抑制p38MAPK的活性可以降低细胞的运动能力。Sossey-Alaoui等[12]通过采用RNA干扰技术抑制WAVE3基因的表达来降低磷酸化p38表达,结果降低了MDA-MB-231细胞的侵袭能力。Rudalska等[8]研究发现通过短发夹RNA干扰沉默p38/ATF2信号通路后,耐药肝癌小鼠对索拉非尼的治疗敏感性增加,生存期延长;而质粒活化转染p38使其过表达后,人肝癌细胞对索拉非尼的敏感性降低。本研究发现,抑制p38的表达可抑制肾癌786-O细胞的增殖和侵袭能力,对靶向药物舒尼替尼的敏感性增加,表明肾癌细胞中p38的表达在肾癌细胞增殖、转移以及对靶向药物耐药方面发挥着关键作用。
由于RNA干扰具有高度的序列专一性和有效的干扰,可以特异地将特定基因沉默,从而获得基因功能丧失或基因表达量降低,已成为功能基因组学的一种强有力的研究工具[13],但针对同一靶基因的不同siRNA序列的沉默效率不同[14]。本研究构建了2条针对p38的siRNA,并将其转染至肾癌786-O细胞株,通过RT-PCR及蛋白质印迹法检测技术,发现两条siRNA均不同程度地抑制了该细胞株中p38 mRNA及其蛋白的表达;其中siRNA659组p38 mRNA及蛋白表达水平下降更为明显,提示siRNA高效转染可下调p38基因表达。
肿瘤细胞增殖和侵袭能力是恶性肿瘤进展的重要生物学特征。本研究抑制p38基因表达后,采用Transwell小室法及CCK-8法分别检测细胞的侵袭能力、增殖能力及其对靶向药物的敏感性,研究发现,与阴性对照组和空白组比较,自72 h起siRNA531组、siRNA659组细胞的增殖均发生降低,其中siRNA659组细胞的增殖降低更明显,表明p38基因沉默可抑制肾癌786-O细胞增殖,提示p38基因在肾癌细胞生长、分化方面具有重要作用。侵袭实验结果发现抑制786-O细胞p38基因表达后,细胞侵袭能力明显受到抑制,且干扰效率越高,细胞侵袭能力受抑制越明显。流式细胞术检测发现,p38基因沉默可使786-O细胞阻滞于G0/G1期。在舒尼替尼的药物敏感性实验中,siRNA531组、siRNA659组对舒尼替尼的敏感性增强,且p38基因的干扰效率越高,肾癌786-O细胞株对舒尼替尼的敏感性越强。研究表明虽然舒尼替尼对包括血管上皮生长因子受体(vascular endothelial growth factor receptor,VEGFR) 1、2、3,血小板源性生长因子受体(platelet-derived growth factor receptor,PDGFR)α、β和干细胞因子等血管形成有关生长因子受体有抑制作用,但仍可能通过p38MAPK信号通路使肾癌细胞增殖转移;或活化的p38可激活下游MEK/ERK信号通路,导致肿瘤细胞的增殖、转移以及对舒尼替尼的耐药作用。
综上所述,本研究初步证实了p38与肾癌细胞的增殖、侵袭密切相关,干扰p38的表达可以增强肾细胞癌靶向药物治疗的敏感性。p38MAPK信号通路在肾细胞癌耐药中具有重要作用。本研究为下一步动物体内实验提供了理论及实验基础,为寻找晚期肾癌患者靶向耐药新机制和增敏的分子靶点提供了理论依据。
| [1] | LOPEZ-BELTRAN A, SCARPELLI M, MONTIRONI R, KIRKALI Z. 2004 WHO classification of the renal tumors of the adults[J]. Eur Urol , 2006, 49 :798–805. DOI:10.1016/j.eururo.2005.11.035 |
| [2] | SIEGEL R, MA J, ZOU Z, JEMAL A. Cancer statistics, 2014[J]. CA Cancer J Clin , 2014, 64 :9–29. DOI:10.3322/caac.21208 |
| [3] | JEMAL A, SIEGEL R, XU J, WARD E. Cancer statistics, 2010[J]. CA Cancer J Clin , 2010, 60 :277–300. DOI:10.3322/caac.20073 |
| [4] | SONPAVDE G, CHOUEIRI T K, ESCUDIER B, FICARRA V, HUTSON T E, MULDERS P F, et al. Sequencing of agents for metastatic renal cell carcinoma:can we customize therapy?[J]. Eur Urol , 2012, 61 :307–316. DOI:10.1016/j.eururo.2011.10.032 |
| [5] | MOTZER R J, HUTSON T E, TOMCZAK P, MICHAELSON M D, BUKOWSKI R M, RIXE O, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma[J]. N Engl J Med , 2007, 356 :115–124. DOI:10.1056/NEJMoa065044 |
| [6] | RINI B I, ATKINS M B. Resistance to targeted therapy in renal-cell carcinoma[J]. Lancet Oncol , 2009, 10 :992–1000. DOI:10.1016/S1470-2045(09)70240-2 |
| [7] | MALM S W, HANKE N T, GILL A, CARBAJAL L, BAKER A F. The anti-tumor efficacy of 2-deoxyglucose and D-allose are enhanced with p38 inhibition in pancreatic and ovarian cell lines[J]. J Exp Clin Cancer Res , 2015, 34 :31. DOI:10.1186/s13046-015-0147-4 |
| [8] | RUDALSKA R, DAUCH D, LONGERICH T, MCJUNKIN K, WUESTEFELD T, KANG T W, et al. In vivo RNAi screening identifies a mechanism of sorafenib resistance in liver cancer[J]. Nat Med , 2014, 20 :1138–1146. DOI:10.1038/nm.3679 |
| [9] | ONO K, HAN J. The p38 signal transduction pathway:activation and function[J]. Cell Signal , 2000, 12 :1–13. DOI:10.1016/S0898-6568(99)00071-6 |
| [10] | RAINGEAUD J, GUPTA S, ROGERS J S, DICKENS M, HAN J, ULEVITCH R J, et al. Pro-inflammatory cytokines and environmental stress cause p38 mitogen-activated protein kinase activation by dual phosphorylation on tyrosine and threonine[J]. J Biol Chem , 1995, 270 :7420–7426. DOI:10.1074/jbc.270.13.7420 |
| [11] | KIM M S, LEE E J, KIM H R, MOON A. p38 kinase is a key signaling molecule for H-Ras-induced cell motility and invasive phenotype in human breast epithelial cells[J]. Cancer Res , 2003, 63 :5454–5461. |
| [12] | SOSSEY-ALAOUI K, RANALLI T A, LI X, BAKIN A V, COWELL J K. WAVE3 promotes cell motility and invasion through the regulation of MMP-1, MMP-3, and MMP-9 expression[J]. Exp Cell Res , 2005, 308 :135–145. DOI:10.1016/j.yexcr.2005.04.011 |
| [13] | OBBARD D J, JIGGINS F M, HALLIGAN D L, LITTLE T J. Natural selection drives extremely rapid evolution in antiviral RNAi genes[J]. Curr Biol , 2006, 16 :580–585. DOI:10.1016/j.cub.2006.01.065 |
| [14] | 李劲涛, 杨军, 张秀丽, 谭兴. RNAi最新研究概况[J]. 细胞与分子免疫学杂志 , 2007 :1077–1079. |
 2016, Vol. 37
2016, Vol. 37


