2. 上海交通大学医学院附属上海市第九人民医院辅助生殖科, 上海 200011
2. Department of Assisted Reproduction, The 9th People's Hospital of Shanghai, School of Medicine, Shanghai Jiaotong University, Shanghai 200011, China
子宫内膜异位症(endometriosis,EM)是具有活性的子宫内膜组织(腺体和间质)出现在子宫内膜以外部位的一种常见妇科疾病。生殖期妇女EM的发病率为5%~10%,且与不孕症高度相关[1]。目前普遍认为EM相关性不孕是由多方面因素导致的,卵母细胞在卵泡中发育和卵巢颗粒细胞分泌的卵泡液构成了排卵前卵母细胞的微环境,已有研究证实EM患者体内存在卵母细胞质量损伤和卵泡液成分异常[2-5]。内异方是治疗EM的有效中药复方[6-8]。本研究通过对小鼠生发泡(germinal vesicle,GV)期卵母细胞进行体外成熟(in vitro maturation,IVM)培养,观察EM患者卵泡液对卵母细胞成熟的影响以及内异方药物血清的干预作用。
1 材料和方法 1.1 实验动物雌性昆明小鼠7只,8周龄,清洁级,体质量(38±5) g;雌性昆明小鼠30只,3~4周龄,清洁级,体质量(15±4) g,均由上海交通大学医学院附属上海市第九人民医院实验动物中心许可证号:SYXK(沪)2012-0007]提供。常规小鼠颗粒饲料喂养,自由摄食和饮水,光照12 h(6:00~18:00)和黑暗12 h(18:00~6:00)交替,恒温23℃。
1.2 主要试剂及仪器调制人类输卵管液 (modulated human tubal fluid,mHTF;Merck Millipore,USA),KSOM胚胎培养液(Merck Millipore,USA),山羊血清(Merck Millipore,USA),二氢乙啶(dihydroethidium,DHE;Sigma,USA),代血清 (serum substitute supplement,SSS;Irvine Scientific,USA),孕马血清促性腺激素PMSG;赤峰博恩药业有限公司,批准文号:(2012)050074564]。体视显微镜(奥林巴斯SZX10),超分辨率显微镜(奥林巴斯IX73),激光扫描共聚焦显微镜(Zeiss LSM 700)。
1.3 内异方药物血清制备生大黄6 g(后下)、桃仁9 g、水蛭9 g、莪术9 g、淫羊藿15 g、菟丝子15 g、鳖甲9 g(先煎)、巴戟天12 g、黄芪15 g,将上述饮片常规煎煮,过滤,合并两次滤液,浓缩成每毫升生药含量为1.32 g的药液,冷却后装入灭菌药瓶,置4℃冰箱备用。 按成人剂量的5倍即8.25 g/(kg·d)]对8周龄小鼠进行灌胃,每次0.25 mL,每日早、晚2次,连续7 d。对小鼠进行眼球取血,置于4℃冰箱静置1 h后,300×g 离心20 min,无菌收集血清。将血清经2 μm 微孔滤膜过滤除菌,-20℃冻存备用。实验前经56℃、30 min灭活。
1.4 卵泡液样本收集收集样本来源于2015年7月至9月在上海市第九人民医院辅助生殖科进行体外受精和胚胎移植(IVF-ET)治疗的20例不孕症患者,其中EM患者(10例)为经腹腔镜或剖腹手术确诊者,对照组患者(10例)为因输卵管因素导致不孕者。纳入标准:年龄25~35岁;1年内未采取任何避孕措施,性生活正常而没有成功妊娠;卵巢功能正常,月经第3天(D3)基础促卵泡激素(FSH) 4~10 U/L、黄体生成素(LH) 4~10 U/L、雌二醇(E2) 200~293 pmol/L;卵泡液采集前3个月内没有接受过任何手术;体质量指数(BMI) 18~25 kg/m2;男方精液检查正常。两组患者均采用相同控制性超排卵方案[9],即从月经第3天开始每日给予尿促性腺激素(HMG;上海丽珠集团丽珠制药厂,批准文号:国药准字H20023864)150~225 IU和安宫黄体酮(MPA;浙江仙琚制药股份有限公司,批准文号:国药准字H33020829)10 mg;从月经第7~8天开始监测卵泡,每2~4 d经阴道超声观察并记录发育卵泡数。当有3个优势卵泡直径达到18 mm时,当天肌内注射醋酸曲普瑞林(达必佳;德国辉凌制药有限公司,进口药品注册证号:H20100365) 0.1 mg和人绒毛膜促性腺激素(HCG;上海丽珠集团丽珠制药厂,批准文号:国药准字44020673) 1 000 IU。注射醋酸曲普瑞林和HCG 34~36 h后,行经阴道超声引导下穿刺取卵术。取卵过程中保留第1管无血无冲洗液的卵泡液,300×g 离心10 min,取上清,-20℃冻存备用。
1.5 GV期卵母细胞的收集3~4周龄小鼠腹腔注射PMSG 7.5 IU,48 h后颈椎脱臼法处死,立即解剖腹腔,取下双侧卵巢,放入预平衡过的mHTF(含10% SSS)中。用已消毒的刀片将卵巢组织剁碎,释放卵泡中的卵母细胞。吸取全部含卵巢组织的培养液,经100 μm的滤网过滤后,再经40 μm的滤网过滤。将40 μm的滤网翻面倒置,充分冲洗内面,收集全部冲洗液。在体视显微镜下用自制拾卵针在该冲洗液中吸出GV期卵母细胞,放入新的mHTF(含10% SSS)中,待移入培养皿。
1.6 GV期卵母细胞的IVM培养及干预方法将卵母细胞分为空白对照组(A组)、对照卵泡液组(B组)、EM卵泡液组(C组)和内异方血清组(D组),A组用KSOM胚胎培养基培养,B组采用KSOM胚胎培养基+20%对照患者卵泡液培养,C组采用KSOM胚胎培养基+20% EM患者卵泡液培养,D组采用KSOM胚胎培养基+20% EM患者卵泡液+20%内异方药物血清培养。取卵前4 h将4种培养液于培养皿中做成大小约 20 μL的微滴,每个培养皿中放入约6个微滴,矿物油覆盖,在37℃、5% CO2培养箱(Thmorgan160R)中预平衡。GV期卵母细胞收集完成后,用拾卵针在每个微滴中放入10枚卵母细胞,在培养箱中继续培养16 h。
1.7 观察指标及方法 1.7.1 卵母细胞成熟率收集各组活细胞,超分辨率显微镜下观察细胞情况。GV期卵母细胞:细胞中可见未破裂的GV;MⅠ期卵母细胞:GV核膜破裂,核仁消失,核内物质与核质混合,第一极体未排出;孤雌激活 (parthenogenetic activation,PA)卵母细胞:卵母细胞孤雌发育,未受精已二分裂;细胞死亡:细胞质皱缩;MⅡ期卵母细胞:GV破裂,第一极体排出[10]。
1.7.2 卵母细胞内活性氧(reactive oxygen species,ROS)的检测收集各组活细胞,加入至含0.5 μmol/L DHE的甘油液滴中,37℃孵育30 min。适当洗涤后,各组卵母细胞随甘油液滴置于照相皿中,经激光共聚焦显微镜观察并拍摄荧光照片。各组荧光照片经软件Image pro plus 6.0(Media Cybernetics,USA)分析其积分光密度(IOD)和荧光面积(AREA),计算平均光密度(MOD,MOD=IOD/AREA),即为平均荧光强度。平均荧光强度值反映细胞内的ROS水平。
1.8 统计学处理采用SPSS 21.0软件进行统计学分析,计数资料采用χ2 检验,计量资料采用SNK-q 检验。检验水准(α)为0.05。
2 结 果 2.1 各组细胞IVM培养结果各组GV期卵母细胞经16 h IVM培养后,在超分辨率显微镜下观察形态(图 1),可见未成熟卵母细胞(如GV期、MⅠ期、异常或死亡)以及成熟卵母细胞(即MⅡ期)。由表 1可见,A组细胞成熟率(236/289,81.7%)高于B、C、D 3组(P<0.01);C组有124个(42.5%)细胞发育至MⅡ期,低于B组(165/293,56.3%)和D组(151/296,51.0%),差异有统计学意义(P<0.05)。
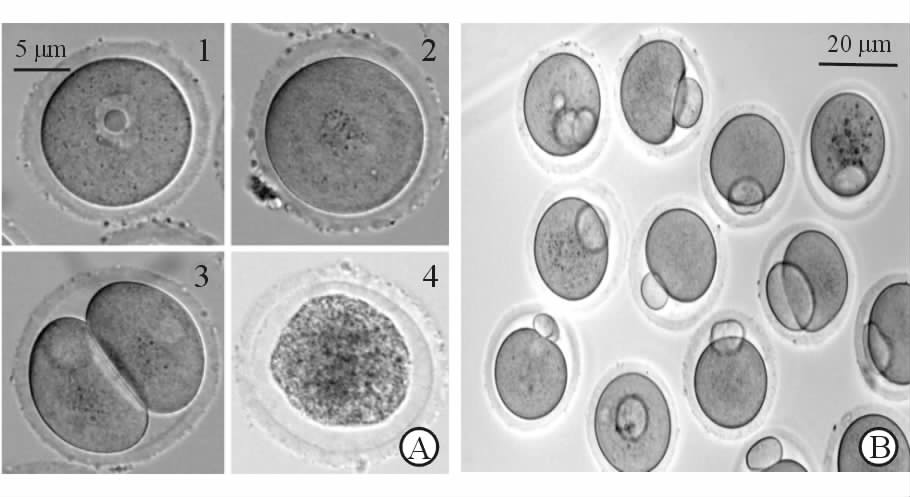
|
图 1 卵母细胞经体外成熟培养后的不同形态 Fig 1 Stages of oocytes maturation in vitro |
|
|
表 1 各组卵母细胞体外成熟培养分期结果比较 Tab 1 Stage of oocytes maturation in vitro in 4 groups |
2.2 各组细胞ROS水平比较
经IVM培养后,A组DHE染色细胞数为215个、B组为238个、C组为265个、D组为267个。经激光共聚焦显微镜拍摄各组荧光照片,见图 2。C组细胞平均荧光强度(0.056 8±0.025 1)高于A组(0.014 8±0.005 1,P<0.05)和B组(0.037 1±0.010 2,P<0.05);D组平均荧光强度(0.050 4±0.007 0)低于C组,但差异无统计学意义(P=0.335)。
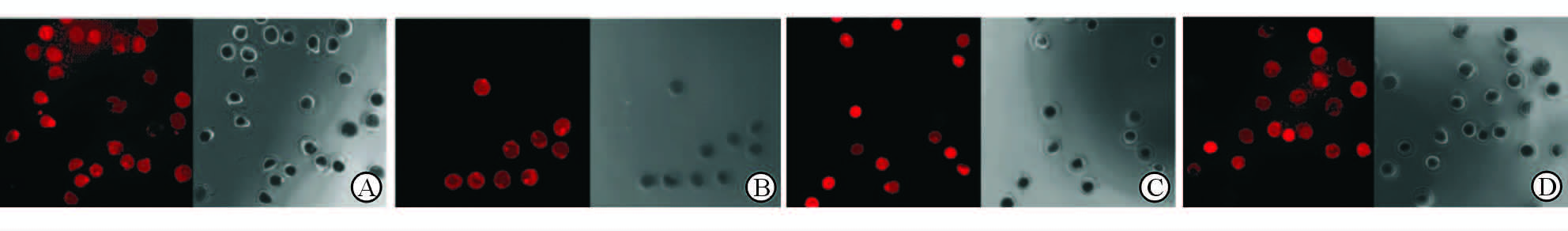
|
图 2 各组卵母细胞体外成熟培养后ROS水平检测 Fig 2 Reactive oxygen species (ROS) level of oocytes maturation in vitro in 4 groups |
3 讨 论
卵泡液主要由卵巢颗粒细胞分泌,包绕在卵细胞周围,构成卵母细胞在排卵前所处的微环境,对卵母细胞成熟有重要影响[11]。已有学者对EM患者的卵泡液进行研究,将其与正常女性或由其他原因导致的不孕患者的卵泡液进行蛋白质组学的比较,发现两者存在明显差别[4-5]。还有研究表明EM患者不孕的原因之一是卵母细胞的质量受损[2, 12-13]。EM患者卵泡液的成分异常很可能会影响卵母细胞的成熟,损伤卵子的质量,导致后续受精及胚胎发育缺陷[14]。本研究采用IVM培养的方法,将EM患者的卵泡液加入至小鼠卵母细胞IVM培养基中,观察其对卵母细胞成熟的影响。研究结果显示,同样是不孕症,相较非EM患者,EM患者的卵泡液降低了小鼠卵母细胞IVM培养的成熟率,说明EM患者的卵泡液阻碍了小鼠卵母细胞的成熟过程。
为探讨EM患者的卵泡液阻碍小鼠卵母细胞成熟的机制,本研究观察了EM患者的卵泡液在IVM培养过程中是否会增加卵母细胞内的ROS水平。ROS源于氧化代谢,正常情况下细胞内的ROS水平与细胞抗氧化功能处于平衡状态。如果ROS水平过高,细胞就会被氧化应激损伤[15]。氧化应激会诱导染色体端粒损伤,导致染色体不稳定性增加[16]。已有研究证实EM患者卵泡液中的ROS水平明显高于正常对照者[17-18]。本研究采用DHE荧光探针的方法标记细胞内的超氧化物阴离子,根据荧光的强度判断细胞内的ROS水平。结果显示,与对照组相比,EM患者卵泡液组卵母细胞内的ROS水平明显升高,说明EM患者卵泡液加强了卵母细胞内的氧化应激,这很可能是导致IVM培养成熟率降低的重要因素。
中医认为EM的病机属"肾虚血瘀"[19]。肾主生殖,不仅主宰着"肾-天癸-冲任-胞宫"之间的协调,还通过胞脉直接作用于胞宫,而胞宫的生殖功能为产生月经和孕育胎儿,故有"经水出诸肾""肾主生殖"之说[20]。EM出血属"离经之血",亦为瘀血,瘀积日久,形成癥瘕;瘀血阻滞胞脉,两精不能结合,以致不孕。内异方以温肾化瘀通腑为主要治则,治疗EM临床疗效满意[21-22]。已有研究表明,内异方有调节生殖内分泌、降低炎症介质、抑制异位内膜侵袭等作用[6-7, 23-24]。本研究结果显示,内异方药物血清可以改善EM患者卵泡液对小鼠卵母细胞成熟的损害,提高卵母细胞的成熟率;内异方药物血清组卵母细胞内的ROS水平虽然较EM患者卵泡液组低,但差异无统计学意义。提示这种干预作用可能与氧化应激有关,具体还有待进一步证实。
| [1] | 钱海墨, 齐聪, 李久现. 子宫内膜异位症所致不孕症中医治疗概述. 中医杂志[J]. 2010,51 :853–855. |
| [2] | BARCELOS I D, VIEIRA R C, FERREIRA E M, MARTINS W P, FERRIANI R A, NAVARRO P A. Comparative analysis of the spindle and chromosome configurations of in vitro-matured oocytes from patients with endometriosis and from control subjects: a pilot study. Fertil Steril[J]. 2009, 92 :1749–1752 . |
| [3] | MANSOUR G, SHARMA R K, AGARWAL A, FALCONE T. Endometriosis-induced alterations in mouse metaphase Ⅱ oocyte microtubules and chromosomal alignment: a possible cause of infertility. Fertil Steril[J]. 2010, 94 :1894–1899 . |
| [4] | LO TURCO E G, CORDEIRO F B, LOPES P H, GOZZO F C, PILAU E J, SOLER T B, et al. Proteomic analysis of follicular fluid from women with and without endometriosis: new therapeutic targets and biomarkers. Mol Reprod Dev[J]. 2013, 80 :441–450 . |
| [5] | LO TURCO E G, SOUZA G H, GARCIA J S, FERREIRA C R, EBERLIN M N, BERTOLLA R P. Effect of endometriosis on the protein expression pattern of follicular fluid from patients submitted to controlled ovarian hyperstimulation for in vitro fertilization. Hum Reprod[J]. 2010, 25 :1755–1766 . |
| [6] | 韩洁, 周巧玲, 张丹英, 翟东霞, 蔡在龙, 俞超芹. 内异方对子宫内膜异位症黏附侵袭的作用及机制. 中国中西医结合杂志[J]. 2011,31 :1113–1117. |
| [7] | 王瑞霞, 俞超芹, 俞瑾, 宋艳华, 石书芳. 内异方对子宫内膜异位症生殖内分泌调节的实验研究. 南京中医药大学学报[J]. 2005,21 :231–233. |
| [8] | 俞超芹, 俞瑾, 宋艳华. 俞氏内异方组治疗子宫内膜异位症临床研究. 生殖医学杂志[J]. 2005,14 :143–147. |
| [9] | WANG Y, CHEN Q, WANG N, CHEN H, LYU Q, KUANG Y. Controlled ovarian stimulation using medroxyprogesterone acetate and hMG in patients with polycystic ovary syndrome treated for IVF: a double-blind randomized crossover clinical trial. Medicine (Baltimore)[J]. 2016, 95 . |
| [10] | NAGY A.小鼠胚胎操作实验手册[M].孙青原,陈大元 主译.北京:化学工业出版社,2006:15-27. |
| [11] | REVELLI A, DELLE PIANE L, CASANO S, MOLINARI E, MASSOBRIO M, RINAUDO P. Follicular fluid content and oocyte quality: from single biochemical markers to metabolomics. Reprod Biol Endocrinol[J]. 2009, 7 :40–53 . |
| [12] | KATSOFF B, CHECK J H, DAVIES E, WILSON C. Evaluation of the effect of endometriosis on oocyte quality and endometrial environment by comparison of donor and recipient outcomes following embryo transfer in a shared oocyte program. Clin Exp Obstet Gynecol[J]. 2006, 33 :201–202 . |
| [13] | RAJANI S, CHATTOPADHYAY R, GOSWAMI S K, GHOSH S, SHARMA S, CHAKRAVARTY B. Assessment of oocyte quality in polycystic ovarian syndrome and endometriosis by spindle imaging and reactive oxygen species levels in follicular fluid and its relationship with IVF-ET outcome. J Hum Reprod Sci[J]. 2012, 5 :187–193 . |
| [14] | DA BROI M G, MALVEZZI H, PAZ C C, FERRIANI R A, NAVARRO P A. Follicular fluid from infertile women with mild endometriosis may compromise the meiotic spindles of bovine metaphaseⅡ oocytes. Hum Reprod[J]. 2014, 29 :315–323 . |
| [15] | LIU L, TRIMARCHI J R, NAVARRO P, BLASCO M A, KEEFE D L. Oxidative stress contributes to arsenic-induced telomere attrition, chromosome instability, and apoptosis. J Biol Chem[J]. 2003, 278 :31998–32004 . |
| [16] | 刘 颖,魏兆莲.氧化应激与子宫内膜异位症伴不孕的临床研究进展[J/CD].中华临床医师杂志(电子版), 2011,5:4493-4495. |
| [17] | SINGH A K, CHATTOPADHYAY R, CHAKRAVARTY B, CHAUDHURY K. Altered circulating levels of matrix metalloproteinases 2 and 9 and their inhibitors and effect of progesterone supplementation in women with endometriosis undergoing in vitro fertilization. Fertil Steril[J]. 2013, 100 :127–134 . |
| [18] | PRIETO L, QUESADA J F, CAMBERO O, PACHECO A, PELLICER A, CODOCEO R, et al. Analysis of follicular fluid and serum markers of oxidative stress in women with infertility related to endometriosis. Fertil Steril[J]. 2012, 98 :126–130 . |
| [19] | 李祥云, 刘健, 胡晓梅, 方幼毅, 李路, 郑锦, 等. 补肾祛瘀法治疗子宫内膜异位症的临床研究. 中医杂志[J]. 1997,38 :292–293. |
| [20] | 沈慰, 俞超芹. 从肾论治卵巢早衰. 中西医结合学报[J]. 2006,4 :653–656. |
| [21] | 俞超芹, 翟美芙. 内异方治疗子宫内膜异位症56例临床观察. 浙江中医杂志[J]. 1996,10 :209–210. |
| [22] | 宋艳华, 俞瑾, 俞超芹. 俞氏内异方结合中药灌肠外敷治疗子宫内膜异位症36例临床观察. 中国中西医结合杂志[J]. 2005,25 :748–749. |
| [23] | 俞超芹, 刘玉环, 彭新萍, 李瑾, 潘瑞萍, 凌昌全. 子宫内膜异位症白细胞介素-8与白细胞介素-10水平及内异方对其调节作用. 中国中西医结合杂志[J]. 2000,20 :603–605. |
| [24] | 徐玲, 周巧玲, 韩洁, 张丹英, 董惠娟, 蔡在龙, 等. 内异方药物血清对子宫内膜异位症血管生成的影响. 中西医结合学报[J]. 2012,10 :800–806. |
 2016, Vol. 37
2016, Vol. 37


