2. 解放军93277部队卫生队, 沈阳 110032;
3. 解放军463医院血液净化中心, 沈阳 110042
2. Medical Team, No. 93277 Troop of PLA, Shenyang 110032, Liaoning, China;
3. Blood Purification Center, No. 463 Hospital of PLA, Shenyang 110042, Liaoning, China
骨关节炎(osteoarthritis,OA)是临床常见的一种退变性疾病,它不仅影响患者的关节功能及生活质量,也严重影响整个社会健康水平[1-2]。关节软骨退变和软骨缺损为OA的主要病理改变,在软骨缺损区重建透明软骨、实现关节软骨的功能是治疗该疾病的难点[3]。用组织工程的方法可在缺损区形成真正的透明软骨,实现关节软骨功能,其中将滑膜间充质干细胞(synovium-derived stem cells,SDSCs)作为种子细胞来修复软骨缺损是目前研究的主流方向[4-7]。该方法首先在体外培养SDSCs并进行软骨诱导分化,然后植入OA关节的软骨缺损区,诱导分化后的细胞将会受到周围关节液的影响。目前研究证明,急性膝关节损伤的关节液可促进软骨形成,而慢性损伤的关节液对软骨形成起抑制作用[8]。OA是关节表面退行性疾病,关节液中含有多种炎症介质和细胞因子。本研究采用体外实验,将OA关节液加入诱导后SDSCs的培养液中,模拟体内的OA关节环境,观察OA关节液对SDSCs的软骨分化能力的影响,进一步验证SDSCs作为修复OA关节软骨缺损的种子细胞的可能性。
1 材料和方法 1.1 SDSCs的分离培养选取因膝关节OA Ⅳ期行膝关节置换的病例12例,其中男4例,女8例,平均年龄(64.4±5.1)岁。术前向患者交代实验目的,所有入选患者均签署知情同意书。保存手术中切除的滑膜组织标本,并抽取关节液备用。将标本置入加有PBS的培养皿中,剪除脂肪和结缔组织,分离出滑膜组织,用PBS冲洗3次。用小组织剪将滑膜片剪成1~2 mm大小的小碎块后移入直径为35 mm的培养皿中,加入Ⅰ型胶原酶(0.4 g/100 mL,Biosharp)4 mL,在37℃、5%CO2培养箱中消化4 h。将组织消化液经120目尼龙网(70 μm)过滤,用移液管将过滤液移入离心管中,560×g离心10 min后弃去上清液。获得的细胞用PBS重悬,560×g离心10 min,重复3次,弃去含胶原酶的上清液。使用含10%胎牛血清(FBS,Hyclone)的DMEM培养液培养细胞,在37℃、5%CO2培养箱中培养24 h,弃去未贴壁细胞,贴壁细胞即为原代SDSCs。继续培养约7 d,用0.05%胰蛋白酶-0.02%EDTA消化后进行传代培养。
1.2 SDSCs表面标记物鉴定取培养后第4代SDSCs,弃去原有培养液,用PBS漂洗2次,加入1 mL 0.25%胰蛋白酶。镜下观察,当细胞稍微变圆时,加入含血清培养液终止反应,离心收集细胞;加入固定液,重悬细胞,摇床摇动30 min,离心收集细胞,PBS漂洗2次,去除多余固定液;最后用PBS重悬细胞,使细胞密度达到1×107/mL。流式管中加入带有FITC或PE标记的CD44、CD45、CD90、CD105抗体(均购自eBioscience),冰上孵育30 min,离心收集细胞,小心吸尽上清,PBS漂洗2次。用1%多聚甲醛 500 μL 重悬细胞,上流式细胞仪检测。
1.3 成软骨诱导配制诱导培养液:高糖DMEM培养液(Gibco)+100 mg/mL丙酮酸钠+40 mg/mL脯氨酸+50 mg/mL抗坏血酸+100 mmol/L地塞米松+10 ng/mL转化生长因子β3(TGF-β3)+1 mg/mL牛血清白蛋白+10% FBS。选择生长状态良好的第4代SDSCs,PBS清洗2次,加入0.25%的胰蛋白酶消化,室温消化1 min左右;加入DMEM完全培养液终止反应,收集细胞混合液,560×g离心3 min。离心后去上清,加入1 mL的DMEM完全培养液,重悬细胞,制成细胞悬液,并进行计数。以8×105个细胞/管将细胞接种至15 mL离心管中,672×g离心3 min,去上清,加入成软骨诱导液5 mL。同时再以1×105个细胞每孔将细胞接种至24孔板中,培养诱导,待细胞贴壁后(此时细胞密度达70%),加入成软骨诱导液1 mL,每3 d换液1次,诱导21 d。将成软骨诱导分化21 d所得组织经4%甲醛溶液固定,常规脱水,石蜡包埋,切片厚度4 μm,进行阿利辛兰染色和番红O染色,显微镜下观察。
1.4 OA关节液处理及分组第4代SDSCs经成软骨诱导分化21 d后,分为实验组和对照组。将实验组中5%的培养液更换为OA关节液,每3 d换液1次,处理16 d;对照组不更换含OA关节液的培养液,其余同实验组。
1.5 软骨小球直径测量测量两组细胞团培养形成的软骨小球的最大直径和最小直径,取其平均值作为软骨小球直径。
1.6 成软骨相关基因表达检测采用实时定量PCR检测两组成软骨相关基因COL Ⅱ、Aggrecan、SOX9 mRNA的表达。提取细胞总RNA,用SuperScriptTM试剂盒(Invitrogen)合成cDNA。引物序列COL Ⅱ: F 5′-CAA GAA CAG CAT TGC CTA TCT G-3′,R 5′-CCA TCC TTC AGG GCA GTG TA-3′;SOX9: F 5′-TAA AGG CAA CTC GTA CCC AAA T-3′,R 5′-GTC CAG TTT CTC GTT GAT TTC G-3′; Aggrecan: F 5′-CAC CTA CAA ACG CAG ACT ACA GA-3′,R 5′-AAA GCG ACA AGA AGA GGA CAC C-3′; β-actin: F 5′-CTT AGT TGC GTT ACA CCC TTT CTT G-3′,R 5′-CTG TCA CCT TCA CCG TTC CAG TTT-3′。实时定量PCR反应体系:SYBR Green PCR Master Mix 21 μL,上游引物和下游引物各1 μL,cDNA模板2 μL。利用ExicyclerTM 96荧光定量仪(韩国BIONEER公司)进行荧光定量分析。
1.7 关节软骨标志性蛋白检测采用蛋白质印迹法检测关节软骨标志性蛋白COL Ⅱ、Aggrecan、SOX9蛋白的表达。用NP-40裂解液(碧云天生物技术研究所)裂解细胞,提取蛋白质,BCA蛋白浓度测定试剂盒(碧云天生物技术研究所)定量。行SDS-PAGE,转膜,脱脂奶粉封闭。加入一抗(COL Ⅱ、Aggrecan抗体购自Santa Cruz,SOX9抗体购自Abcam,β-actin抗体购自康成生物工程有限公司)孵育,加入二抗孵育。ECL化学发光染色。
1.8 统计学处理采用SPSS 11.0软件对各组数据进行统计学分析。结果以x±s表示,采用两样本均数比较的t检验比较两组之间的差异,检验水准(α)为0.05。
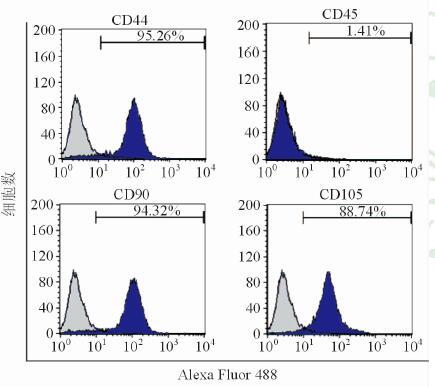
2 结果 2.1 获得的SDSCs具备成软骨分化能力采用流式细胞术鉴定第4代SDSCs的相关表面标记物CD44、CD45、CD90、CD105,结果显示CD45阴性,CD44、CD90、CD105阳性,与SDSCs的特点相符(图 1)。经成软骨诱导后,细胞团逐渐变大,形成透明样软骨小球,阿利辛兰染色可见细胞外基质中的蛋白聚糖被染成深蓝色(图 2A),番红O染色显示细胞外基质中的蛋白聚糖被染成红色(图 2B),表明本研究分离培养的SDSCs具备成软骨分化能力。
|
图 1 流式细胞术显示滑膜间充质干细胞(SDSCs)表面CD45阴性,CD44、CD90、CD105阳性 |

|
图 2 滑膜间充质干细胞(SDSCs)成软骨诱导后阿利辛兰染色(A)和番红O染色(B)结果 |
2.2 OA关节液促进软骨小球增长
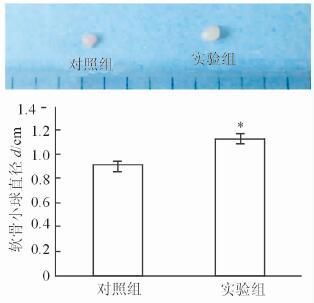
实验组成软骨诱导生成的软骨小球经OA关节液处理16 d后,肉眼观察发现其直径大于对照组,而且形状更规则,表面更光滑。经测量,实验组软骨小球直径大于对照组(P<0.05,图 3)。
|
图 3 两组软骨小球肉眼观及直径的比较 *P<0.05与对照组比较. n=6,x±s |
2.3 OA关节液促进关节软骨标志蛋白合成
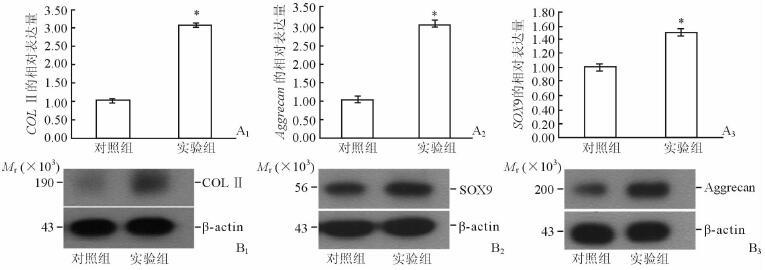
实时定量PCR结果显示,实验组细胞经OA关节液处理16 d后,其关节软骨常用标志性基因COL Ⅱ、Aggrecan、SOX9 mRNA的表达高于对照组(P<0.05,图 4A1~4A3);蛋白质印迹结果与此一致(图 4B1~4B3)。说明OA关节液促进了COL Ⅱ、Aggrecan、SOX9的合成,对SDSCs的软骨形成能力有促进作用。
|
图 4 两组细胞COL Ⅱ、Aggrecan、SOX9 mRNA和蛋白的表达 A1~A3: 实时定量PCR检测mRNA表达; B1~B3: 蛋白质印迹分析检测蛋白表达. *P<0.05与对照组比较. n=6,x±s |
3 讨论
OA患者的关节液中含有多种成分,包括多种基质成分(如糖胺聚糖、硫酸软骨素、透明质酸等)、结晶(如焦磷酸钙盐、磷灰石)及多种细胞因子和炎症因子[9-10]。研究表明,有些细胞因子及炎症因子可对SDSCs的软骨分化能力起到促进作用。TGF具有诱导SDSCs向软骨细胞分化、合成软基质的作用,可提高COL Ⅱ的合成;胰岛素样生长因子同样有促进SDSCs软骨分化的作用,而且与TGF联合应用,其促进作用大于两种因子的单独使用,可以产生更多的透明软骨细胞外基质成分糖胺聚糖[11]。骨形态发生蛋白(BMP)家族中的BMP-2和BMP-7对SDSCs软骨分化的促进作用大于TGF-β1,其中BMP-7和TGF-β1的协同应用可提高SDSCs的软骨分化能力[12]。
本研究结果显示,采用OA关节液处理的实验组软骨小球直径大于对照组,而且实验组形成的软骨小球形状比对照组更加规则、表面更加光滑,说明OA关节液有促进SDSCs软骨分化后软骨基质合成的作用;实验组细胞表面COL Ⅱ、Aggrecan、SOX9 3种透明软骨标志性基因的表达量及蛋白的合成量明显高于对照组,说明OA关节液有上调COL Ⅱ、Aggrecan、SOX9 3种基因表达及蛋白合成的作用,进一步证明OA关节液能够促进SDSCs软骨形成。以上实验结果说明OA关节液有促进SDSCs软骨分化的作用,提示SDSCs可作为修复OA关节软骨缺损的种子细胞。但OA关节液中含有各种成分和因子,其促进SDSCs软骨分化的机制可能较为复杂,有待深入研究。
| [1] | DUARTE J H. Osteoarthritis: autophagy prevents age-related OA. Nat Rev Rheumatol[J]. 2015, 11 :683. |
| [2] | ZAMBON S, SIVIERO P, DENKINGER M, LIMONGI F, VICTORIA CASTELL M, VAN DER PAS S, et al. Role of osteoarthritis, comorbidity, and pain in determining functional limitations in older populations: European project on osteoarthritis. Arthritis Care Res (Hoboken)[J]. 2016, 68 :801–810 . |
| [3] | ERHART-HLEDIK J C, FAVRE J, ANDRIACCHI T P. New insight in the relationship between regional patterns of knee cartilage thickness, osteoarthritis disease severity, and gait mechanics. J Biomech[J]. 2015, 48 :3868–3875 . |
| [4] | HENDERSON I, FRANCISCO R, OAKES B, CAMERON J. Autologous chondrocyte implantation for treatment of focal chondral defects of the knee-a clinical, arthroscopic, MRI and histologic evaluation at 2 years. Knee[J]. 2005, 12 :209–216 . |
| [5] | MINAS T. Autologous chondrocyte implantation for focal chondral defects of the knee. Clin Orthop Relat Res[J]. 2001, 391 (Suppl) :S349–S361 . |
| [6] | NIEMEYER P, KÖSTLER W, SALZMANN G M, LENZ P, KREUZ P C, SVDKAMP N P. Autologous chondrocyte implantation for treatment of focal cartilage defects in patients age 40 years and older: a matched-pair analysis with 2-year follow-up. Am J Sports Med[J]. 2010, 38 :2410–2416 . |
| [7] | BARRY F P, MURPHY J M. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol[J]. 2004, 36 :568–584 . |
| [8] | MOUISEDDINE M, MATHIEU N, STEFANI J, DEMARQUAY C, BERTHO J M. Characterization and histological localization of multipotent mesenchymal stromal cells in the human postnatal thymus. Stem Cells Dev[J]. 2008, 17 :1165–1174 . |
| [9] | TCHETVERIKOV I, RONDAY H K, VAN EL B, KIERS G H, VERZIJL N, TEKOPPELE J M, et al. MMP profile in paired serum and synovial fluid samples of patients with rheumatoid arthritis. Ann Rheum Dis[J]. 2004, 63 :881–883 . |
| [10] | GOBEZIE R, KHO A, KRASTINS B, SARRACINO D A, THORNHILL T S, CHASE M, et al. High abundance synovial fluid proteome: distinct profiles in health and osteoarthritis. Arthritis Res Ther[J]. 2007, 9 :R36. |
| [11] | SAKIMURA K, MATSUMOTO T, MIYAMOTO C, OSAKI M, SHINDO H. Effects of insulin-like growth factor Ⅰ on transforming growth factor β1 induced chondrogenesis of synovium-derived mesenchymal stem cells cultured in a polyglycolic acid scaffold. Cells Tissues Organs[J]. 2006, 183 :55–61 . |
| [12] | MIYAMOTO C, MATSUMOTO T, SAKIMURA K, SHINDO H. Osteogenic protein-1 with transforming growth factor-beta1: potent inducer of chondrogenesis of synovial mesenchymal stem cells in vitro. J Orthop Sci[J]. 2007, 12 :555–561 . |
 2016, Vol. 37
2016, Vol. 37


