甲状腺相关性眼病(thyroid-associated ophthalmopathy,TAO)是一种以炎症反应紊乱为特征的器官特异性自身免疫性疾病[1],与Graves病(Graves disease,GD)密切相关,是GD最常见、最重要的甲状腺外器官损害。TAO活动期主要病理特征为眼外肌和球后结缔组织中大量淋巴细胞浸润,其中大多数为CD4+T细胞,其次为CD8+T细胞,并伴随少量B细胞、巨噬细胞等浸润,提示T淋巴细胞在TAO发病中起重要作用[2]。程序性死亡蛋白1(programmed death-1,PD-1)属于负性共刺激分子,主要表达在活化的CD4+、CD8+T细胞表面,它通过与其配体结合从而发挥负性调控T细胞的活化及维持免疫耐受的作用[3]。Newby等[4]对英国高加索人群进行单核苷酸多态性(single nucleotide polymorphism,SNP)检测后发现,PD-1基因的多态性可能与GD发病相关,但是关于PD-1在TAO中的表达及其意义尚不明确。本研究通过观察TAO患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中CD4+、CD8+T细胞百分比和细胞表面PD-1表达水平的改变及其与病程、实验室指标、疾病活动性、疾病严重程度之间的关系,初步探讨PD-1在TAO发病机制中的意义与诊断价值。
1 资料和方法 1.1 研究对象TAO组:2015年3月至2015年10月在第二军医大学长征医院内分泌科初诊住院的TAO患者,均符合Bartlay诊断标准,根据EUGOGO标准[5]进行临床活动性评分(CAS评分)及严重程度分级。GD组:同期经本院门诊初诊且未接受药物治疗的GD患者,临床诊断符合美国甲状腺学会标准,眼眶MRI排除眼部改变。健康对照组:同期在本院体检的健康者。3组人群在采集血标本前3个月内均未接受过免疫抑制剂和糖皮质激素的治疗,且排除其他自身免疫性疾病、过敏性疾病和严重感染等情况;育龄女性尿妊娠试验阴性。本研究经第二军医大学长征医院医学伦理委员会批准,所有受试者均签署知情同意书。
1.2 TAO活动性及严重程度评价方法TAO活动性临床评分标准(EUGOGO CAS评分,7分法):(1) 自发性眼球疼痛;(2) 眼球凝视时疼痛;(3) 眼睑水肿;(4) 眼睑红斑;(5) 结膜充血;(6) 球结膜水肿;(7) 肉阜肿胀。上述每项临床表现积1分,CAS评分≥3分为TAO疾病活动期。TAO严重程度分级标准(EUGOGO):(1) 轻度,即眼睑挛缩<2 mm,轻度软组织受累,眼球突出度<25 mm,无或一过性复视,无角膜外露或视神经受累;(2) 中重度,即眼睑挛缩≥2 mm,或中重度软组织受累,或眼球突出度≥25 mm,或持续性、非持续性复视,或角膜轻度外露,无视神经受累;(3) 威胁视力,即重度角膜外露或视神经受累。
1.3 主要仪器与试剂FITC标记的抗人CD4、CD8a抗体、PE标记的抗人PD-1抗体均购自美国eBioscience公司,人淋巴细胞分离液购自美国CEDARLANE公司,Accuri C6流式细胞仪购自美国BD公司。人游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)检测试剂盒(电化学发光法)及人促甲状腺素受体抗体(TRAb)、过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TgAb)检测试剂盒(电化学发光法)和Cobas E601型全自动电化学发光免疫分析仪均购自德国Roche公司。
1.4 实验方法 1.4.1 PBMC悬液的制备EDTA-K2抗凝管收集各组受试者清晨空腹状态下外周静脉血2 mL,加入2 mL PBS稀释,轻轻混匀后加到预先加有4 mL人淋巴细胞分离液的离心管上层,2 560×g离心10 min。取中间白膜层(即PBMC层),PBS清洗3次,加入1 mL含1%胎牛血清的RPMI1640培养基重悬细胞,即得PBMC悬液。
1.4.2 PBMC中CD4+、CD8+ T细胞及其表面PD-1的流式检测对PBMC悬液进行细胞计数,PBS稀释,调整待测细胞密度为106/mL。取200 μL细胞悬液,853×g离心5 min(4℃),取沉淀用预冷PBS 1 mL润洗2次,重悬于100 μL PBS;分别加入相应的抗体5 μL,轻轻混匀,4℃避光孵育1~2 h,同时以不加抗体作为阴性对照。2 560×g离心10 min,弃上清,沉淀加入200 μL PBS重悬,用流式细胞仪进行检测。
1.4.3 FT3、FT4、TSH与TRAb、TPOAb、TgAb的检测使用FT3、FT4、TSH、TRAb、TPOAb、TgAb电化学发光法检测试剂盒,严格按照试剂盒说明书操作,用第二军医大学长征医院生化实验室Cobas E601型全自动电化学发光免疫分析仪进行检测。
1.5 统计学处理采用SPSS 16.0软件完成所有统计分析。计量资料采用x±s描述,分类变量以百分率(%)描述。计量资料的组间比较,如果数据资料为正态分布且方差齐采用方差分析或t检验,否则采用秩和检验;计数资料的组间比较采用χ2检验。为了控制混杂因素的影响应用偏相关进行分析,采用Pearson法进行相关性分析。检验水准(α)为0.05。
2 结果 2.1 病例一般资料TAO组患者21例,GD组患者21例,健康对照组受试者20例,3组人群性别构成、年龄、眼病病程、吸烟情况、甲状腺功能、甲状腺相关抗体水平等见表 1。3组组间性别构成、年龄、吸烟情况比较差异均无统计学意义(P>0.05),具有可比性。TAO组与健康对照组受试者之间眼病病程、FT3、TSH、TRAb、TPOAb水平差异有统计学意义(P<0.05);GD组与健康对照组之间FT3、FT4、TSH、TRAb、TPOAb、TGAb水平差异均有统计学意义(P<0.05);TAO组与GD组之间眼病病程、FT3、FT4、TSH、TPOAb、TGAb水平差异有统计学意义(P<0.05)。
|
|
表 1 3组研究对象基线特征比较 Tab 1 Baseline characteristic of the participants in three groups |
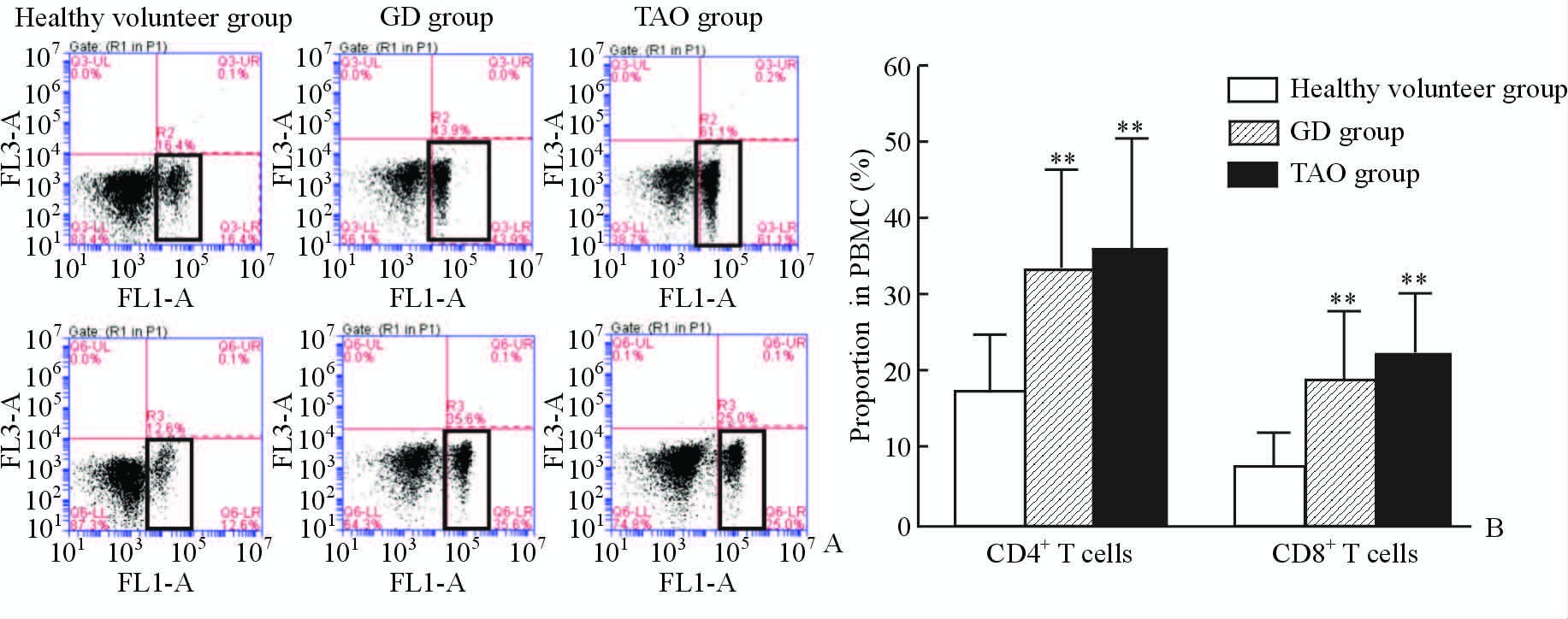
2.2 3组人群PBMC中CD4+、CD8+T细胞百分比
TAO组患者PBMC中CD4+、CD8+T细胞所占百分比分别为(35.9±14.5)%、(22.2±8.4)%,GD组分别为(33.1±13.1)%、(18.6±9.2)%,均高于健康对照组[(17.4±7.4)%、(7.7±4.8)%],差异有统计学意义(P<0.01);TAO组与GD组之间差异无统计学意义(P>0.05,图 1)。
|
图 1 3组受试者PBMC中CD4+、CD8+T细胞百分比 Fig 1 Proportions of CD4+,CD8+T cells of PBMC in three groups |
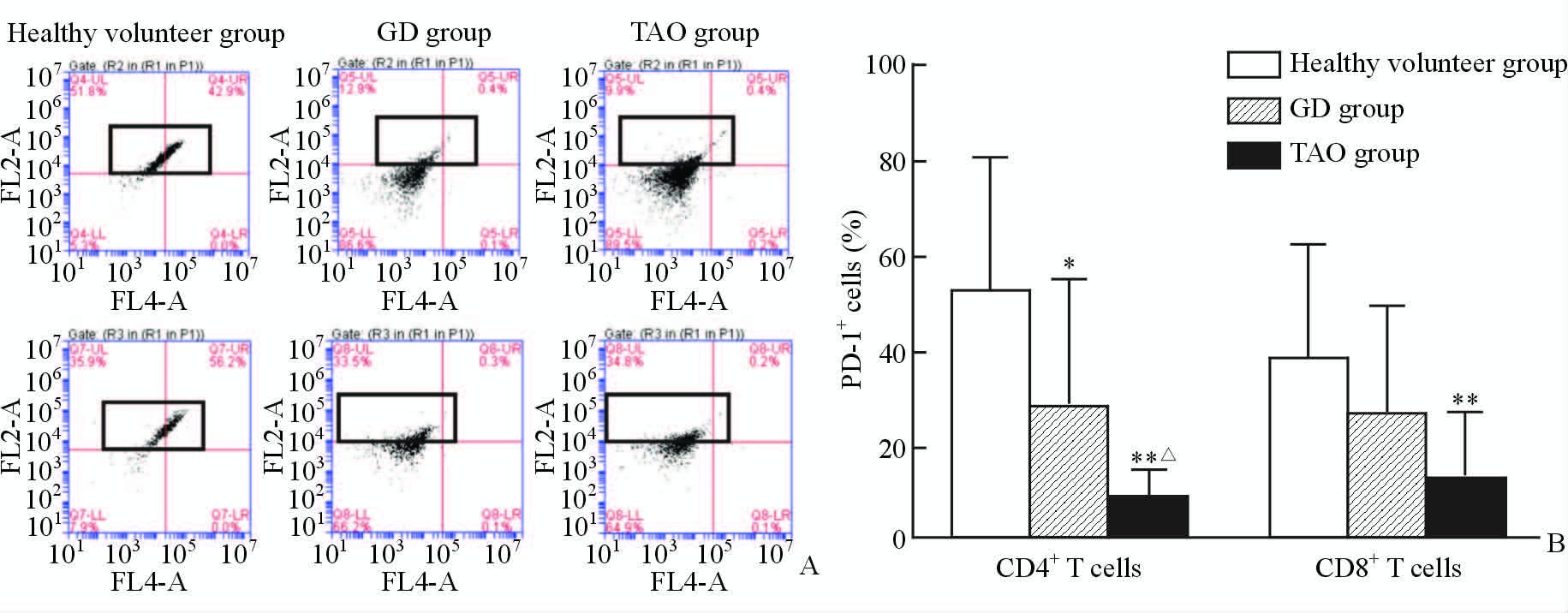
2.3 3组受试者PBMC和CD组CD4+、CD8+T细胞表面PD-1的表达
TAO组和GD组患者PBMC中CD4+T细胞表面PD-1的表达率分别为(8.3±6.4)%和(28.0±26.6)%,均低于健康对照组[(52.2±28.6)%],且TAO组低于GD组,差异均有统计学意义(P<0.01,P<0.05)。TAO组和GD组患者PBMC中CD8+T细胞表面PD-1的表达率为(12.7±13.4)%,低于健康对照组[(38.2±24.2)%],差异有统计学意义(P<0.01);GD组为(26.6±23.2)%,与TAO组及健康对照组之间差异均无统计学意义(P>0.05,图 2)。
|
图 2 3组受试者PBMC中CD4+、CD8+T细胞表面PD-1的表达率 Fig 2 PD-1 expression in CD4+,CD8+T cells of PBMC in three groups |
2.4 3组受试者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率与病程、甲状腺功能及甲状腺相关抗体的关系
3组受试者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率与其病程、甲状腺功能和甲状腺相关抗体水平之间的相关性采用偏相关分析,结果(表 2)显示,3组受试者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率与其病程、FT3、FT4、TSH、TRAb、TPOAb及TGAb水平均无相关性(P>0.05)。
|
|
表 2 3组受试者PBMC中CD4+、CD8+T细胞及其表面PD-1表达率与病程、甲状腺功能、甲状腺相关抗体的偏相关分析 Tab 2 Partial correlation analysis between the proportions of CD4+,CD8+T cells in PBMC,PD-1 expression on cell surface in TAO patients and disease course,thyroid functions and levels of thyroid antibodies |
2.5 TAO患者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率与患者病程、甲状腺功能及甲状腺相关抗体的关系
TAO患者PBMC中CD8+T细胞百分比与患者病程呈正相关(r=0.478,P=0.028),与甲状腺功能及甲状腺相关抗体无相关性(P>0.05);CD8+T细胞表面PD-1表达率、CD4+T细胞百分比及其细胞表面PD-1表达率与患者病程、甲状腺功能和甲状腺相关抗体之间均无相关性(表 3)。
|
|
表 3 TAO患者PBMC中CD4+、CD8+T细胞及其表面PD-1表达率与病程、甲状腺功能、甲状腺相关抗体的相关性 Tab 3 Correlation analysis between the proportions of CD4+,CD8+T cells in PBMC,PD-1 expression on cell surface in TAO patients and desease course,thyroid functions and levels of thyroid antibodies |
2.6 PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率与TAO疾病活动性和严重程度的关系
根据CAS评分结果将TAO患者分为2个亚组,其中活动期组10例、非活动期组11例,2组患者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率差异均无统计学意义(P>0.05,表 4)。根据TAO严重程度分级标准将TAO患者分为轻度组和中重度组2个亚组,其中轻度组11例、中重度组10例,2组患者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率差异也均无统计学意义(P>0.05,表 4)。
|
|
表 4 PBMC中CD4+、CD8+T细胞百分比及其表面PD-1表达率与TAO患者疾病活动性和严重程度的关系 Tab 4 Relationship between the proportions of CD4+,CD8+T cells in PBMC,PD-1 expression on cell surface and activity and severity of TAO |
3 讨论
TAO是一种具有潜在致盲性的严重眼眶疾病,多发生于GD患者或既往有GD病史的患者中,因此又称为Graves眼病(Graves ophthalmopathy,GO)[6]。据报道GD患者中TAO患病率可高达25%~50%[7]。两病在发病机制上有一定联系,存在共同抗原,由遗传、环境及免疫因素相互作用、共同致病[8]。
目前普遍认为免疫因素在TAO的发病机制中占主导地位,其中以T细胞免疫为主,其免疫学基础是在TAO患者眼眶组织中发现大量CD4+T细胞浸润,其次为CD8+T细胞[2]。浸润的T细胞活化后可释放干扰素(IFN)-γ、白介素(IL)-1β、IL-2、肿瘤坏死因子(TNF)-α等细胞因子及白细胞调节素,诱导眼眶成纤维细胞合成并释放透明质酸,参与TAO患者眼眶组织病理改变[6]。同样,T细胞免疫在GD的发病中也具有重要作用[9]。其中一个主要环节是抗原提呈细胞识别抗原并呈递给T细胞,T细胞活化后进一步增殖、分化为辅助性CD4+T细胞及细胞毒性CD8+T细胞,发挥分泌炎性因子及攻击靶细胞等作用,参与炎性反应及组织损伤[10]。既往研究也发现GD患者外周血与甲状腺组织中CD4+、CD8+T细胞百分比升高[11],但有关TAO患者PBMC中CD4+、CD8+T细胞百分比改变的报道较少。本研究发现GD组患者PBMC中CD4+、CD8+T细胞百分比均高于健康对照组(P<0.01),与以往研究相一致,进一步佐证PBMC中CD4+、CD8+T细胞的激活参与了GD的发病;而TAO组患者PBMC中CD4+、CD8+T细胞百分比也高于健康对照组(P<0.01),且与GD组之间差异无统计学意义,提示TAO与GD存在相似的全身免疫紊乱状态。PBMC中CD4+、CD8+T细胞激活与TAO发病相关,其发挥作用的机制可能和GD相同,与目前普遍认同的两病存在共同自身免疫发病机制的学说相一致。该研究结果具有一定的临床意义,PBMC中CD4+、CD8+T细胞比值升高可作为TAO及GD疾病诊断的一个重要免疫学指标,提示患者的全身免疫紊乱状态。
TAO与GD在发病上虽然有相似的免疫机制,但并不是所有GD患者均发生TAO,而TAO也可发生在其他自身免疫性甲状腺疾病的患者中[1]。因此,虽然TAO患者眼眶组织与GD发病过程中甲状腺病理改变之间存在联系,但是发病机制并不完全相同,TAO发病机制中可能有其独特的免疫学异常。为进一步探讨TAO与GD两病中T细胞免疫紊乱的特点,本研究对TAO与GD患者PBMC中CD4+、CD8+T细胞表面PD-1的表达率进行了检测。PD-1是近年发现的负性共刺激分子之一,主要在活化的T细胞表面表达,在B细胞及树突状细胞表面亦有表达。PD-1通过与其配体PD-L1、PD-L2结合,阻断T细胞增殖活化、减少细胞因子合成,但不增加细胞死亡,从而发挥免疫抑制作用[12]。近年来,多项动物实验研究证实PD-1通路在阻断免疫反应中发挥重要作用[3],而基因组学研究发现人类某些种族人群PD-1基因SNP与其自身免疫性疾病高发风险相关[12],提示PD-1在自身免疫性疾病中具有重要作用。本研究结果显示TAO组及GD组患者PBMC中CD4+T细胞表面PD-1的表达率、TAO组患者PBMC中CD8+T细胞表面PD-1的表达率低于健康对照组,提示PD-1表达异常可能是TAO及GD的发病机制之一。缺乏PD-1的负性调控作用,外周血T细胞“逃逸”免疫耐受而过度活化增殖,对自身抗原产生持续的免疫应答,通过释放炎性因子和增强细胞溶解作用促进炎症反应的发生,导致机体组织损伤;其中TAO患者CD4+、CD8+T细胞均参与致病过程,而GD患者以CD4+T细胞免疫为主。同时,TAO组患者PBMC中CD4+、CD8+T细胞表面PD-1的表达率低于GD组,其中CD4+T细胞表面PD-1的表达率差异有统计学意义(P<0.05),提示TAO患者CD4+T细胞生物学活性更强,自身免疫紊乱可能更严重、更持久。PBMC中CD4+T细胞表面PD-1表达率的下调水平可以作为鉴别TAO和GD的一项参考指标。
此外,在对TAO组进行相关性分析时发现,TAO组患者PBMC中CD8+T细胞百分比与患者病程呈正相关,提示随着TAO患者病程的延长,其PBMC中CD8+T细胞百分比增加,在细胞免疫中发挥的作用越大,尽早干预治疗可能有助于控制病情的发展。然而,TAO组患者CD4+、CD8+T细胞百分比及其表面PD-1的表达率与患者TAO疾病活动性及严重程度无明显相关,表明PD-1表达率不能作为TAO病情严重程度及活动性的指标。但以上结果尚需要大样本研究进一步证实。
本研究仍存在一定的局限性,研究检测的T细胞来源于患者外周血循环中,而TAO患者眼眶组织中浸润的T细胞在细胞来源及分布上均与外周血有所差异,且受不同微环境因素的影响,其表面共刺激分子的表达亦可能不同。下一步研究将检测TAO患者眼眶组织中浸润的CD4+、CD8+T细胞百分比及其表面PD-1的表达水平,进一步明确PD-1与TAO眼部病理改变机制之间的关系。
综上,本研究结果显示TAO患者PBMC中CD4+、CD8+T细胞百分比升高、其表面PD-1的表达下调,提示TAO患者PBMC中CD4+、CD8+T细胞百分比及其表面PD-1的表达参与TAO的自身免疫过程。PBMC中CD4+、CD8+T细胞百分比升高、CD4+T细胞表面PD-1表达率下调均可作为了解患者疾病状态的重要免疫学指标,对其深入研究将有助于我们进一步明确TAO的发病机制,为TAO疾病的治疗和预防提供新靶点。
| [1] | BAHN R S. Graves' ophthalmopathy. N Engl J Med[J]. 2010, 362 :726–738 . |
| [2] | PAPPA A, LAWSON J M, CALDER V, FELLS P, LIGHTMAN S. T cells and fibroblasts in affected extraocular muscles in early and late thyroid associated ophthalmopathy. Br J Ophthalmol[J]. 2000, 84 :517–522 . |
| [3] | YAO S, CHEN L P. PD-1 as an immune modulatory receptor. Cancer J[J]. 2014, 20 :262–264 . |
| [4] | NEWBY P R, ROBERTS-DAVIES E L, BRAND O J, HEWARD J M, FRANKLYN J A, GOUGH S C, et al. Tag SNP screening of the PDCD1 gene for association with Graves' disease. Clin Endocrinol(Oxf)[J]. 2007, 67 :125–128 . |
| [5] | BARRIO-BARRIO J, SABATER A L, BONET-FARRIOL E, VELÁZQUEZ-VILLORIA, GALOFRÉ J C. Graves' ophthalmopathy: VISA versus EUGOGO classification, assessment, and management. J Ophthalmol[J]. 2015, 2015 :249125. |
| [6] | BAHN R S. Current insights into the pathogenesis of Graves' ophthalmopathy. Horm Metab Res[J]. 2015, 47 :773–778 . |
| [7] | LYER S, BAHN R. Immunopathogenesis of Graves' ophthalmopathy:the role of the TSH receptor. Best Pract Res Clin Endocrinol Metab[J]. 2012, 26 :281–289 . |
| [8] | BAHN R S. Clinical review 157: pathophysiology of Graves' ophthalmopathy: the cycle of disease. J Clin Endocrinol Metab[J]. 2003, 88 :1939–1946 . |
| [9] | BAGNASCO M, VENUTI D, PRIGIONE I, TORRE G C, FERRINI S, CANONICA G W. Graves' disease: phenotypic and functional analysis at the clonal level of the T-cell repertoire in peripheral blood and in thyroid. Clin Immunol Immunopathol[J]. 1988, 47 :230–239 . |
| [10] | WIERSINGA W M. Thyroid autoimmunity. Endocr Dev[J]. 2014, 26 :139–157 . |
| [11] | BEN-SKOWRONEK I, SZEWCZYK L, KULIK-RECHBERGER B, KOROBOWICZ E. The differences in T and B cell subsets in thyroid of children with Graves' disease and Hashimoto's thyroiditis. World J Pediatr[J]. 2013, 9 :245–250 . |
| [12] | GIANCHECCHI E, DELFINO D V, FIERABRACCI A. Recent insights into the role of the PD-1/PD-L1 pathway in immunological tolerance and autoimmunity. Autoimmun Rev[J]. 2013, 12 :1091–1100 . |
 2016, Vol. 37
2016, Vol. 37


