2. 贵州大学动物科学学院高原山地动物遗传育种与繁殖教育部重点实验室, 贵阳 550025;
3. 贵州大学农学院, 贵阳 550025
2. Key Laboratory of Animal Genetics, Breeding and Production of Ministry of Education in the Pleteau Mountain Region, College of Animal Science, Guizhou University, Guiyang 550025, Guizhou, China;
3. College of Agriculture, Guizhou University, Guiyang 550025, Guizhou, China
Bloom解旋酶是RecQ家族中的重要成员,其能够与多种蛋白因子相互作用,影响蛋白因子的功能。据报道Bloom解旋酶的低表达可以上调P53蛋白的表达[1],而P53是肿瘤抑制基因之一。本课题组前期研究也表明,在多种癌细胞(如胃癌、肺癌、前列腺癌等)中存在Bloom解旋酶基因的高表达,由此推断Bloom解旋酶的高表达抑制了P53蛋白的表达,使其无法诱导细胞凋亡进而导致细胞癌变[2]。通过体外对Bloom解旋酶的药物实验发现,某些药物作用于与DNA结合的Bloom解旋酶时会抑制酶的活性,从而阻碍Bloom解旋酶与DNA的结合[3]。前列腺癌是发病率和病死率较高的男性恶性肿瘤,由于目前对前列腺癌发病的分子机制缺乏准确的理解,致使大多数前列腺癌虽然在早期就可以被诊断出来,但仍找不到有效的靶向分子治疗手段。RNA干扰(RNA interference,RNAi)是近年逐渐流行起来的一种基因沉默技术,由于其可以特异性剔除或沉默特定靶基因的表达,已被广泛应用于探索基因功能及恶性肿瘤的基因治疗领域[4-10]。本课题组前期根据小干扰RNA(small interfering RNA,siRNA)的设计原则[11]成功构建了针对Bloom解旋酶基因的RNAi载体,并通过荧光定量PCR和蛋白质印迹法证实了重组RNAi载体能够在mRNA和蛋白水平抑制Bloom解旋酶的表达[12]。本实验旨在研究抑制Bloom解旋酶基因的表达后前列腺癌PC3细胞的增殖、迁移、侵袭及凋亡能力的变化,拟为促进前列腺癌靶向药物的研究奠定基础。
1 材料和方法 1.1 材料与试剂前列腺癌PC3细胞购自中国科学院上海细胞库,由贵州大学动物科学学院高原山地动物遗传育种与繁殖教育部重点实验室传代保存。脂质体购自Invitrogen公司,Opti-MEM购自Gibco公司,MTT、多聚甲醛购自北京鼎国昌盛生物技术有限责任公司,Transwell小室、细胞培养板购自Corning公司,结晶紫、二甲亚砜(DMSO)购自北京索莱宝科技有限公司,Matrigel胶购自BD公司,Hoechst/PI双染试剂购自巴傲得生物科技有限公司。二氧化碳培养箱购自Thermo公司,T1-DH荧光倒置显微操作系统购自Nikon公司,Synergy H1全功能酶标仪购自BioTek公司。实验用水均为Milli-Q超纯水系统制成的超纯水。本实验中使用的干扰载体为前期已构建好的干扰载体:构建重组载体所用的空载体CMV-copGFP-T2A-Puro-H1-MCS购自广州辉骏公司,两条具有干扰效率的shRNA序列由上海吉玛公司合成。将空载体和shRNA经酶切后连接成重组RNAi载体。
1.2 重组载体转染PC3细胞将PC3细胞按1×105/孔的密度接种于24孔培养板,加入DMEM/F12培养液(含10%胎牛血清,100 U/mL卡那霉素,100 U/mL氨苄霉素),37℃、5%CO2培养至细胞融合度为80%左右。使用实验室前期成功构建的两条针对于Bloom解旋酶基因的重组RNAi载体shRNA-1和shRNA-2分别转染PC3细胞,即为shRNA-1组和shRNA-2组;以未转染重组RNAi载体的PC3细胞为未转染对照组。各转染组每孔载体用量为1.25 μL,脂质体用量为2 μL,载体和脂质体分别用无血清的Opti-MEM稀释。转染6 h后更换为含10%胎牛血清的无抗生素DMEM/F12培养液,转染24~48 h后荧光倒置显微镜下观察转染效率。
1.3 MTT法检测转染后细胞的增殖情况取处于对数生长期的PC3细胞调节密度为1×104/mL,接种于96孔培养板中,每孔200 μL,每组设6个复孔。边缘孔用无菌PBS填充,同时设调零孔(调零孔中不含细胞,其他操作与实验组和对照组无异),置于37℃、5%CO2培养箱中培养。分别在转染后24、48、72 h时取出培养板,弃去原培养液,无菌PBS洗涤,各孔均加入180 μL无血清培养液和20 μL MTT(5 mg/mL)。继续孵育4 h后弃去培养液,每孔加入DMSO 150 μL,震荡10 min,用酶标仪检测波长为490 nm时光密度(D)值,计算细胞的增殖率。细胞增殖率(%)= (D实验组―D调零组)/(D对照组―D调零组)×100%。实验重复3次。
1.4 Transwell小室法检测细胞的侵袭能力取适用于24孔板的Transwell小室,在冰上用无血清的Opti-MEM将Matrigel胶按 1∶3的稀释倍数稀释,以每孔50 μL的量包被于Transwell小室的上室,37℃条件下放置30 min使Matrigel胶凝固,吸掉残液及未凝固的胶后加入无血清的Opti-MEM于37℃平衡30 min。重组RNAi载体转染细胞48 h后,胰酶消化细胞,用无血清的培养液调整细胞密度至5×104/mL。于上室内加入200 μL细胞悬液,下室加入600 μL含10%胎牛血清的培养液,在37℃、5%CO2的条件中培养24 h后取出Transwell小室。PBS冲洗膜,用无菌棉签擦净上室未穿膜的细胞,4%多聚甲醛固定20 min,PBS冲洗数次;0.1%结晶紫染色20 min,显微镜下计数穿过室膜的细胞。每组设4个平行滤膜。
1.5 Transwell小室法检测细胞的迁移能力Transwell 小室上室不需要铺Matrigel胶,其余操作同1.4项,显微镜下计数穿膜细胞。
1.6 细胞划痕实验取对数生长期的细胞以5×104/孔的密度接种于6孔板,重组RNAi载体转染细胞48 h后,用10 μL移液枪头在6孔板中已贴板底的细胞群中间位置呈“一”字型划痕,分别在0、24 和48 h时在显微镜下测量划痕的宽度,根据公式计算细胞划痕迁移距离:细胞划痕迁移距离=(0 h划痕宽度-实验时间点划痕宽度)/2。每组细胞设4个实验样本,重复4次。
1.7 Hoechst/PI双染法鉴定转染后细胞的凋亡情况按照试剂盒说明先将每10 μL的Hoechst33342/PI用2 mL的Dilution Buffer稀释(避光)。取出已转染48 h的细胞,弃去原培养液,每孔加入500 μL稀释好的Hoechst33342/PI双染试剂,放入细胞培养箱中孵育10 min;弃去染色液,无菌PBS冲洗细胞后尽快置于荧光倒置显微镜下观察结果。
1.8 统计学处理采用SPSS 19.0软件进行分析,实验数据均以x±s表示,组间差异比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 细胞转染效率重组RNAi载体上带有GFP绿色荧光标记,转染进细胞后会发出绿色荧光。转染细胞24 h后,在荧光倒置显微镜下观察,发现shRNA-1组和shRNA-2组细胞均呈现绿色荧光,表明重组RNAi载体成功转染细胞(图 1)。

|
图 1 重组RNAi载体转染后细胞发出绿色荧光 Fig 1 PC3 cells transfected with recombinant vectors displaying green fluorescence |
2.2 细胞增殖情况
采用MTT法检测重组RNAi载体转染后各组细胞的增殖情况,结果发现转染后不同时间点shRNA-1组和shRNA-2组的细胞增殖率与对照组相比均降低,差异有统计学意义(P<0.05,表 1)。
|
|
表 1 转染后各组细胞不同时间点的细胞增殖率 Tab 1 Proliferation of PC3 cells transfected with the recombinant vectors at different time points |
2.3 细胞侵袭能力
采用Transwell小室法检测重组RNAi载体转染后各组细胞的侵袭能力,通过在显微镜下观察计数后发现shRNA-1组的穿膜细胞数为(119±24)个、shRNA-2组(118±30)个,与对照组[(227±38)个]相比差异均具有统计学意义(P<0.05)。结果见图 2。
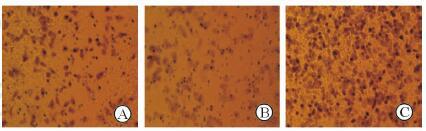
|
图 2 转染后各组细胞的体外侵袭能力 Fig 2 Invasion ability of cells transfected with recombinant vectors in vitro in each group |
2.4 细胞迁移能力
采用Transwell小室法检测重组RNAi载体转染后各组细胞的迁移能力,通过在显微镜下观察计数显示shRNA-1组的穿膜细胞数为(122±13)个、shRNA-2组(121±47)个,均低于对照组(277±32)个,差异有统计学意义(P<0.05)。结果见图 3。

|
图 3 转染后各组细胞的体外迁移能力 Fig 3 Migration ability of cells transfected with recombinant vectors in vitro in each group |
2.5 划痕实验结果
通过细胞划痕实验检测重组RNAi载体转染后各组细胞的迁移情况,分别在划痕后第0、24、48 小时观察各组细胞的划痕迁移距离,结果显示shRNA-1组和shRNA-2组细胞的划痕愈合能力均低于对照组,且48 h时差异具有统计学意义(P<0.05,图 4,表 2)。

|
图 4 转染后各组细胞的划痕愈合情况 Fig 4 Wound healing ability of cells transfected with recombinant vectors in each group |
|
|
表 2 转染后各组细胞的划痕迁移距离 Tab 2 Migration distance of cells transfected with recombinant vectors in each group |
2.6 细胞凋亡情况
Hoechst/PI双染后在荧光显微镜下观察重组RNAi载体转染后各组细胞的凋亡情况,结果发现shRNA-1组和shRNA-2组细胞呈现明显的亮蓝色,有核质固缩、形态萎缩等现象,与对照组相比细胞凋亡情况明显增加(图 5)。
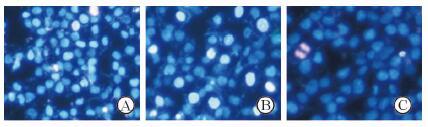
|
图 5 转染后各组细胞的凋亡情况 Fig 5 Cells apoptosis after transfected with recombinant vectors in each group |
3 讨论
Bloom解旋酶在DNA代谢和维持染色体稳定等方面具有重要作用[13]。端粒酶是端粒DNA重复序列延伸过程中的关键酶,端粒中的串联重复序列能够与多种蛋白结合形成特殊的T环结构[14]。在正常细胞中随着细胞分裂的进行端粒逐渐变短,导致细胞衰老凋亡;而在癌细胞中Bloom解旋酶能够通过扰乱端粒的T环结构来辅助端粒复制[15],从而维持端粒稳定,导致癌细胞的永生化。考虑到Bloom解旋酶在核酸代谢和稳定遗传中的作用,以Bloom解旋酶为靶标设计抗癌药物已成为一个新途径。
目前国内外对于前列腺癌的治疗以根治性手术为主要治疗手段,结合化疗、放疗、激素等方法。但前列腺癌早期无明显症状,一旦发现多已属于晚期,导致很多患者失去根治性手术的机会,故生存率不高[16]。寻找与前列腺癌发生、发展相关的蛋白并进行靶向治疗是目前前列腺癌研究的热点[17]。因此,基因治疗或生物学治疗作为新型的肿瘤治疗手段正日益受到重视[18]。
癌细胞具有侵袭转移、生长过快及不易杀死等特点,在细胞癌变过程中难以有效控制,它是肿瘤细胞与宿主细胞之间一系列复杂多因素、多环节相互作用的结果[19]。解决癌细胞易转移扩散等难题是前列腺癌基因治疗的关键核心,同时对肿瘤组织进行特异性靶向杀伤而不损伤机体的正常组织也是肿瘤治疗的理想目标[20]。RNAi技术是研究基因功能和抑制基因表达的有效方法,适用于研究和抑制肿瘤细胞中异常基因或蛋白质的表达[21],而对其他基因无害,可为肿瘤的治疗提供靶点。该技术目前已广泛地应用于肿瘤的诊断[22]、特异性治疗药物的开发合成[23]及基因治疗[21]中。
本研究结合Bloom解旋酶可以作为特异性分子靶标的研究报道[24]及本课题组前期的研究结果,利用针对于人类Bloom解旋酶基因的RNAi载体,在体外将其转染进入前列腺癌PC3细胞中,通过MTT法、Transwell小室法、划痕实验及Hoechst/PI双染实验发现,设计合成的RNAi载体靶向抑制了PC3细胞中Bloom解旋酶基因的表达,有效阻碍了癌细胞的增殖、迁移、侵袭并促进其凋亡。上述结果表明RNAi技术或许能解决由于癌细胞生长过快、不易调控、难以杀死等特点造成的传统癌症治疗手段术后易复发且难以根治的难题,为抗前列腺癌靶向药物的开发研究及基因治疗提供有力依据。
| [1] | KANEKO H, FUKAO T, KASAHARA K, YAMADA T, KONDO N. Augmented cell death with Bloom syndrome helicase deficiency. Mol Med Rep[J]. 2011, 4 :607–609 . |
| [2] | 孟惠惠, 许厚强, 刘金河, 王时雄. 三种癌细胞株中Bloom综合征解旋酶(BLM)的表达水平高于正常细胞. 细胞与分子免疫学杂志[J]. 2014,30 :649–651. |
| [3] | 刘金河, 许厚强, 孟惠惠, 罗霂榃. 甘草次酸对Bloom解旋酶生物学特性的影响. 中国生物化学与分子生物学报[J]. 2014,30 :919–926. |
| [4] | RAMACHANDRAN P V, IGNAEIMUTHU S. RNA interference——a silent but an efficient therapeutic tool. Appl Biochem Biotechnol[J]. 2013, 169 :1774–1789 . |
| [5] | JIN X, SUN T, ZHAO C, ZHENG Y, ZHANG Y, CAI W, et al. Strand antagonism in RNAi: an explanation of differences in potency between intracellularly expressed siRNA and shRNA. Nucleic Acids Res[J]. 2012, 40 :1797–1806 . |
| [6] | SELKIRK M E, HUANG S C, KNOX D P, BRITTON C. The development of RNA interference (RNAi) in gastrointestinal nematodes. Parasitology[J]. 2012, 139 :605–612 . |
| [7] | PENG A, WANG L, FISHER L A. Greatwall and Polo-like kinase 1 coordinate to promote checkpoint recovery. J Biol Chem[J]. 2011, 286 :28996–29004 . |
| [8] | GONDI C S, RAO J S. Concepts in vivo siRNA delivery for cancer therapy. J Cell Physiol[J]. 2009, 220 :285–291 . |
| [9] | KIM D H, ROSSI J J. Strategies for silencing human disease using RNA interference. Nat Rev Genet[J]. 2007, 8 :173–184 . |
| [10] | ANTHONY R V, CANTLON J D. Ribonucleic acid interference:a new approach to the in vivo study of gene function. J Anim Sci[J]. 2007, 85 (13 Suppl) :E18–E19 . |
| [11] | TUSCHL T. Expanding small RNA interference. Nat Biotechnol[J]. 2002, 20 :446–448 . |
| [12] | 罗霂榃, 许厚强, 刘忠伟, 段志强, 赵佳福, 吴萍, 等. 人前列腺癌PC3细胞Bloom解旋酶基因干扰载体的构建. 中国细胞生物学学报[J]. 2015,37 :1497–1502. |
| [13] | DE MUYT A, JESSOP L, KOLAR E, SOURIRAJAN A, CHEN J, DAYANI Y, et al. BLM helicase ortholog Sgs1 is a central regulator of meiotic recombination intermediate metabolism. Mol Cell[J]. 2012, 46 :43–53 . |
| [14] | O'SULLIVAN R J, KARLSEDER J. Telomeres: protecting chromosomes against genome instability. Nat Rev Mol Cell Biol[J]. 2010, 11 :171–181 . |
| [15] | OPRESKO P L. Telomere ResQue and preservation——roles for the Werner syndrome protein and other RecQ helicase. Mech Ageing Dev[J]. 2008, 129 (1/2) :79–90 . |
| [16] | 王新敏, 章乐, 赵静, 李强, 倪钊, 李应龙, 等. PAK6基因沉默对前列腺癌细胞放疗敏感性研究. 石河子大学学报(自然科学版)[J]. 2015,33 :732–735. |
| [17] | 姚杰, 刘秉乾, 魏金星. 人前列腺癌组织中PCA-1及Ki-67 蛋白的表达. 郑州大学学报(医学版)[J]. 2013,48 :198–200. |
| [18] | 龚丹丹, 崔飞伦, 范钰. TROP-2基因小干扰RNA转染对前列腺癌细胞黏附、迁移和侵袭的影响. 山东医药[J]. 2012,52 :17–19. |
| [19] | 李玉兵, 江少波, 任小刚, 孙洁, 谢立平. RNA干扰TGF-β信号通路对人膀胱癌T24细胞迁移和侵袭能力的影响. 医学研究杂志[J]. 2013,42 :150–154. |
| [20] | 李长锋, 张斌, 王志成, 杨海山, 潘奇正. 靶向survivin的RNAi联合X线照射对肺腺癌A549细胞周期、凋亡及增殖的影响. 中国老年学杂志[J]. 2009,29 :542–544. |
| [21] | IZQUIERDO M. Short interfering RNAs as a tool for cancer gene therapy. Cancer Gene Ther[J]. 2005, 12 :217–227 . |
| [22] | GRIMM D, WANG L, LEE J S, SCHVRMANN N, GU S, BÖRNER K, et al. Argonaute proteins are key determinants of RNAi efficacy,toxicity,and persistence in the adult mouse liver. J Clin Invest[J]. 2010, 120 :3106–3119 . |
| [23] | 任惠文, 杨宝学. RNA干扰相关肿瘤治疗药物的研究进展. 中华肿瘤杂志[J]. 2012,34 :801–804. |
| [24] | NGUYEN G H, DEXHEIMER T S, ROSENTHAL A S, CHU W K, SINGH D K, MOSEDALE G, et al. A small molecule inhibitor of the BLM helicase modulates chromosome stability in human cells. Chem Biol[J]. 2013, 20 :55–62 . |
 2016, Vol. 37
2016, Vol. 37


