2. 第二军医大学药学院生化药学教研室, 上海 200433;
3. 解放军成都军区昆明总医院肿瘤科, 昆明 650010;
4. 第二军医大学长海医院泌尿外科, 上海 200433
2. Department of Biochemical Pharmacy, School of Pharmacy, Second Military Medical University, Shanghai 200433, China;
3. Department of Oncology, Kunming General Hospital, PLA Chengdu Military Area Command, Kunming 650010, Yunnan, China;
4. Department of Urology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
PR域蛋白(PRDM)是近年来新发现的Kruppel样锌指基因产物家族的亚型,在细胞分化和恶性转化中起着重要作用[1]。现已发现该家族有17个成员,分别是PRDM1~17,其末端都存在具有转录调控作用的PR结构域和SET结构域[2]。PRDM5(PFM2)被认为是一个抑癌基因[3],Deng等[4]研究发现重组腺病毒表达的PRDM5能引起感染的肿瘤细胞出现G2/M的阻滞并促进肿瘤细胞发生凋亡;Watanabe等[5]发现,在胃肠道癌细胞系过表达PRDM5能抑制癌细胞的生长。但目前关于PRDM5在前列腺癌中的表达和作用还未见相关研究报道。本研究以PRDM5慢病毒感染低表达PRDM5的前列腺癌22Rv1细胞,通过细胞倍增实验、平板克隆实验和软琼脂克隆形成实验,探讨PRDM5在前列腺癌中的作用。
1 材料和方法 1.1 主要材料及试剂前列腺癌22Rv1细胞系由第二军医大学长海医院泌尿外科保存,用含10%胎牛血清(FBS)的DMEM/RPMI 1640混合培养基在37℃、7%CO2条件下培养。DMEM培养基、RPMI 1640培养基、胰蛋白酶、青霉素G钠和氯霉素购自Gibco公司,FBS购自SAFC Biosciences公司,二甲亚砜(DMSO)、嘌呤霉素(puromycin,PM)购自Sigma公司,多西环素(doxycycline,DOX)购自生工生物工程(上海)股份有限公司,RNApure超纯总RNA快速提取试剂盒、EASYspin组织/细胞RNA快速提取试剂盒购自北京艾德来生物科技有限公司,pZERO/Blunt零背景快速克隆试剂盒、TIANprep快速质粒小提试剂盒、DNA Marker、DNA纯化试剂盒购自天根生化科技(北京)有限公司,T4 DNA 连接酶购自NEB公司,Bgl Ⅱ、Age Ⅰ、Nde Ⅰ和Cla Ⅰ限制性内切酶购自宝生物工程有限公司(TaKaRa)。 Pure YieldTM 质粒小提试剂盒购自Promega公司,LipofectamineTM 2000转染试剂购自Invitrogen公司,化学发光试剂盒购自Thermo公司,兔抗PRDM5单克隆抗体购自Abcam公司,actin多克隆抗体购自Sigma公司,山羊抗小鼠IgG-HRP(sc-2005)、山羊抗兔IgG-HRP(sc-2004)购自Santa Cruz公司。
1.2 PCR引物的设计、合成利用NCBI网上的GenBank数据库(http://www.ncbi.nlm.nih.gov/gene/)以及Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对基因序列进行查找和序列比对。采用DNAMAN 6.0、Vector NTI suite 8.0及Primer Premier 5.0等软件进行基因序列分析和引物设计。根据GenBank数据库中的人PRDM5基因序列(NM_018699.2),应用Primer Premier 5.0软件设计引物:Forward 5′-aaA CCG GTC ACC ATG CTG GGC ATG TAC GTG CC-3′,Reverse 5′-aaA TCG ATT TAG CTG TCA GCT ACA CCA TGG-3′。引物由Invitrogen公司合成。从人cDNA文库中克隆获得人PRDM5基因,5′端和3′端分别设计Age Ⅰ(ACC GGT)和Cla Ⅰ(ATC GAT)酶切位点,用于表达载体的定向克隆。人PRDM5基因内部1 013 bp处存在一个Nde Ⅰ位点,设计NdeF(5′-ACG TCA TAT GAT CAC CCA CTC AG-3′)和NdeR(5′-GAT CAT ATG ACG TTT TAG CTG ATT AG-3′)引物进行分段PCR扩增,最后以Nde Ⅰ酶切位点进行拼接。
1.3 PRDM5基因的克隆和慢病毒表达载体的构建以人PRDM5的cDNA为模板进行PCR,反应结束后,用1%琼脂糖凝胶进行电泳,切取目的片段,用DNA纯化试剂盒进行目的片段的回收,连接克隆载体。连接产物转化大肠杆菌感受态细胞,将细胞均匀涂布于含氨苄青霉素的LB琼脂平板表面,于37℃孵箱中倒置培养过夜。挑取单克隆接种于加入氨苄青霉素的LB培养液中摇菌,进行质粒抽提和酶切鉴定。将鉴定正确的克隆送测序公司测序。将测序正确的克隆质粒分别用AgeⅠ和Nde Ⅰ、Nde Ⅰ和Cla Ⅰ双酶切,慢病毒载体质粒pLV-TOF用Age Ⅰ和Cla Ⅰ双酶切。回收pZERO/Blunt-PRDM5酶切产物中的目的片段和pLV-TOF酶切产物中的载体部分,以T4 DNA连接酶进行连接。转化铺板后进行质粒抽提和酶切鉴定,将鉴定正确的克隆进行保种。
1.4 携带PRDM5基因的慢病毒的包装转染前24 h将生长状态良好的293T细胞接种到直径为6 cm的平皿中,细胞融合度达到约80%时进行病毒包装,转染前更换2 mL新鲜含血清培养基。在1.5 mL离心管中加入2.4 μg pLV-PRDM5(pLV-Luc作为阴性对照)和7.6 μg包装质粒Mix,加入250 μL无血清培养基,轻柔吹打混匀;在另一个1.5 mL离心管中以250 μL无血清培养基稀释10 μL LipofectamineTM 2000脂质体,轻柔吹打混匀,室温静置5 min。将含LipofectamineTM 2000的培养基加入到质粒DNA中,轻轻混匀,室温放置孵育20 min,以形成转染复合物;然后将上述混合物加到细胞培养皿中,培养6~8 h后更换新鲜培养基5 mL,放回孵箱培养;分别于转染后48 h和72 h收集上清,4℃、350×g离心15 min,去除细胞沉淀和细胞碎片;分装,-80℃保存。采用有限稀释法测定病毒滴度。
1.5 稳定表达PRDM5的前列腺癌22Rv1细胞株的建立选取PRDM5低表达的22Rv1细胞株进行病毒感染。培养次日,更换新鲜培养基;48 h后加入抗生素PM进行稳转筛选。该慢病毒系统为Tet-off系统,加入DOX溶液(质量浓度0.5 μg/μL)暂时抑制目的基因的表达,隔天补加或更换一次含有PM和DOX的培养基。药物筛选约1周,获得稳定表达PRDM5的22Rv1/LV-PRDM5细胞和22Rv1/LV-Luc对照细胞。收集细胞,采用RIPA蛋白裂解液提取细胞总蛋白,聚丙烯酰胺凝胶电泳,半干电转PVDF膜,5%脱脂奶粉室温封闭2 h。一抗4℃孵育过夜,二抗室温温育2 h,化学发光试剂盒显色,ChemiDocTM System凝胶成像系统拍照。
1.6 细胞倍增实验将稳定表达PRDM5的22Rv1/LV-PRDM5细胞株和22Rv1/LV-Luc对照细胞撤药3 d后,消化,计数,铺板,每种细胞设6个复孔,每孔1×105个细胞,次日取24、48、72 h 3个时间点,每个时间点消化细胞进行细胞计数,最后统计数据,在网上(http://www.doubling-time.com/compute.php)进行在线计算,得到每组细胞的倍增时间。
1.7 平板克隆实验撤药3 d后,用0.25%的胰蛋白酶消化细胞,用含10%FBS的RPMI 1640/DMEM培养基配成单个细胞悬液,以2 500/皿接种于直径为10 cm的培养皿,37℃、5%CO2培养箱中培养2周。出现肉眼可见的细胞克隆时,终止培养,弃去培养液,以1×PBS洗2次;10%甲醛固定20 min,弃甲醛;用0.1%结晶紫染色15 min,弃染色液;流水缓慢洗去染液,空气干燥。采用Bio-Rad Quantity One软件对克隆进行拍照计数。
1.8 软琼脂克隆形成实验撤药3 d后,用胰酶消化细胞,制成单细胞悬液。调整细胞密度为5×104/mL,取1 mL细胞悬液加入146 μL 2.5%琼脂糖,迅速混匀,按500 μL/孔加入含0.5%底层胶的24孔板中,常温放置30 min以上。待上层胶完全凝固,放入孵箱中培养2周。用0.1%结晶紫进行染色,在显微镜下观察集落形成情况并拍照计数。
1.9 统计学处理实验数据采用SPSS 19.0统计软件进行分析。计数资料分析采用χ2检验。实验组与对照组两组资料均数的比较采用t检验。检验水准(α)为0.05。
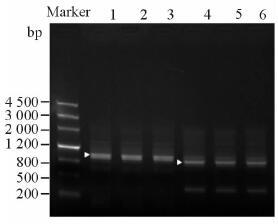
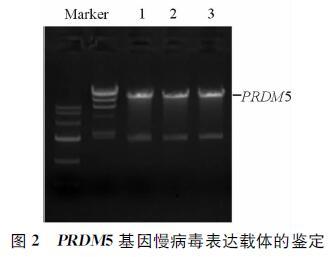
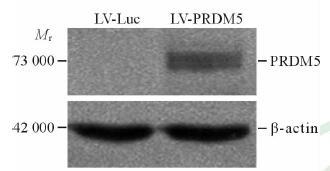
2 结果 2.1 成功获得稳定表达PRDM5的前列腺癌22Rv1细胞通过PCR分段克隆方法获得PRDM5序列,电泳结果显示,PCR产物大小基本正确,但有非特异性条带(图 1),需要在后期克隆的酶切鉴定和测序中进行选择。将克隆获得的正确PRDM5基因序列的2个片段同时装入慢病毒表达载体pLV-TOF中,通过Age Ⅰ 和Cla Ⅰ 双酶切,确定目的基因的插入。电泳结果显示,3个克隆均插入了目的基因PRDM5(图 2)。通过将携带PRDM5基因的慢病毒感染22Rv1细胞,经PM筛选阳性克隆后,用蛋白质印迹法检测转染后细胞中PRDM5蛋白的表达,结果显示,PRDM5基因已成功转入22Rv1细胞中(图 3)。
|
图 1 PRDM5基因的PCR克隆 Fig 1 PCR cloning of PRDM5 gene |
|
图 2 PRDM5基因慢病毒表达载体的鉴定 Fig 2 Identification of PRDM5 gene lentiviral expression vector |
|
图 3 PRDM5基因慢病毒感染后前列腺癌22Rv1细胞中PRDM5表达的鉴定 Fig 3 Identification of PRDM5 expression in prostate cancer cell line 22Rv1 infected with PRDM5 gene lentiviral vector |
2.2 PRDM5对前列腺癌22Rv1细胞的抑制作用
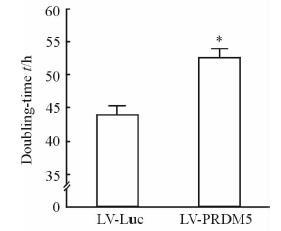
细胞倍增实验结果显示,经LV-Luc感染后的22Rv1细胞倍增时间为(44.0±1.3)h,而经LV-PRDM5感染的22Rv1细胞倍增时间为(52.5±1.4) h,比LV-Luc组延长约8.5 h(P<0.05,图 4)。
|
图 4 PRDM5对前列腺癌22Rv1细胞倍增时间的影响 Fig 4 Effect of PRDM5 on multiplication rate of prostate cancer cells 22Rv1 |
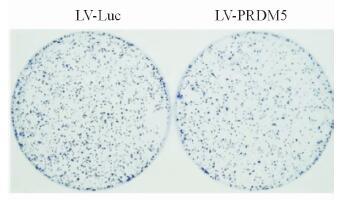
平板克隆实验结果显示,经LV-Luc感染后的22Rv1细胞克隆数为(1 361±123)/皿,而经LV-PRDM5感染后的22Rv1细胞克隆数为(1 114±98)/皿,统计分析显示LV-PRDM5组的细胞克隆形成数低于LV-Luc组(P<0.05)。而从克隆大小上看,LV-Luc组的大克隆细胞数目多于LV-PRDM5组(图 5)。
|
图 5 PRDM5对前列腺癌22Rv1细胞克隆形成能力的影响 Fig 5 Effect of PRDM5 on clone formation rate of prostate cancer cells 22Rv1 |
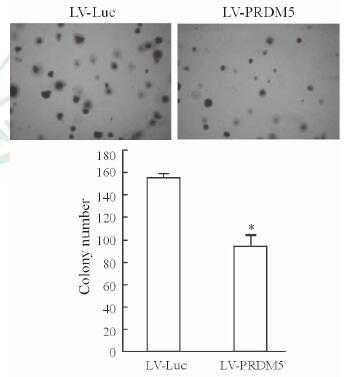
软琼脂克隆形成实验结果显示,经LV-PRDM5感染后的22Rv1细胞的克隆形成数为(94.6±8.7)/孔,而经LV-Luc感染后的22Rv1细胞的克隆形成数约为LV-PRDM5组的1.63倍(P<0.05)。同时PRDM5表达后细胞的克隆变小,提示PRDM5的表达可能抑制前列腺癌22Rv1细胞的非锚着依赖性生长能力(图 6)。
|
图 6 PRDM5对前列腺癌22Rv1细胞的非锚着依赖性生长能力的影响 Fig 6 Effect of PRDM5 on anchorage independent growth rate of prostate cancer cells 22RV1 |
3 讨论
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,是老年男性的好发肿瘤。在西方发达国家,前列腺癌是男性发病率最高的恶性肿瘤,病死率也仅次于肺癌[6-7],严重威胁男性健康。我国前列腺癌发病率虽然与欧美国家相比要低,但是近年已明显有逐年增高的趋势,而且病死率远高于欧美国家[8-9]。与大多数肿瘤一样,前列腺癌的发生和发展也是多基因参与的多因素、多步骤的过程,涉及癌基因的激活和抑癌基因的失活。
PRDM5是近年确认的抑癌基因PRDM家族成员[4],位于人染色体4q25~q26,有一个编码630个氨基酸的开放阅读框架,N末端含有一个PR结构域和16个锌指结构序列。研究发现PRDM5与多种肿瘤的发生和发展有关[5, 10-13],但在前列腺癌中还未见相关研究报道。本研究通过基因转染手段上调前列腺癌22Rv1细胞中的PRDM5的表达,以探讨PRDM5在前列腺癌中的作用。目前基因转染途径很多,而慢病毒是较为有效的一种,它具有毒力低、感染效率高、容纳外源性基因片段大等特点。本研究构建了可调控的PRDM5慢病毒表达系统,将其感染低表达PRDM5的前列腺癌22Rv1细胞,获得了稳定的可调控表达的细胞。通过细胞倍增、克隆形成等体外实验发现,过表达PRDM5可延长前列腺癌22Rv1细胞的倍增时间,抑制细胞的克隆形成能力和非锚着依赖性生长能力。
本研究表明PRDM5可作为一个抑癌基因抑制前列腺癌细胞增殖,提示其可能在前列腺癌的发生和发展中起着重要作用,有望成为前列腺癌治疗的新靶点。但PRDM5是如何发挥抑癌作用的,其中涉及哪些下游信号通路分子,还需要进行深入的探讨。
| [1] | FOG C K, GALLI G G, LUND A H. PRDM proteins: important players in differentiation and disease. Bioessays[J]. 2012, 34 :50–60 . |
| [2] | FUMASONI I, MEANI N, RAMBALDI D, SCAFETTA G, ALCALAY M, CICCARELLI F D. Family expansion and gene rearrangements contributed to the functional specialization of PRDM genes in vertebrates. BMC Evol Biol[J]. 2007, 7 :187. |
| [3] | MEANI N, PEZZIMENTI F, DEFLORIAN G, MIONE M, ALCALAY M. The tumor suppressor PRDM5 regulates Wnt signaling at early stages of Zebrafish development. PLoS One[J]. 2009, 4 :e4273. |
| [4] | DENG Q, HUANG S. PRDM5 is silenced in human cancers and has growth suppressive activities. Oncogene[J]. 2004, 23 :4903–4910 . |
| [5] | WATANABE Y, TOYOTA M, KONDO Y, SUZUKI H, IMAI T, OHE-TOYOTA M, et al. PRDM5 identified as a target of epigenetic silencing in colorectal and gastric cancer. Clin Cancer Res[J]. 2007, 13 :4786–4794 . |
| [6] | JEMAL A, SIEGEL R, WARD E, MURRAY T, XU J, THUN M J. Cancer statistics, 2007. CA Cancer J Clin[J]. 2007, 57 :43–66 . |
| [7] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015. CA Cancer J Clin[J]. 2015, 65 :5–29 . |
| [8] | SIM H G, CHENG C W. Changing demography of prostate cancer in Asia. Eur J Cancer[J]. 2005, 41 :834–845 . |
| [9] | 彭鹏, 龚杨明, 鲍萍萍, 柯居中, 向詠梅, 张敏璐, 等. 中国2008年前列腺癌发病、死亡和患病情况的估计及预测. 中华流行病学杂志[J]. 2012,33 :1056–1059. |
| [10] | CHENG H Y, CHEN X W, CHENG L, LIU Y D, LOU G. DNA methylation and carcinogenesis of PRDM5 in cervical cancer. J Cancer Res Clin Oncol[J]. 2010, 136 :1821–1825 . |
| [11] | SHU X S, GENG H, LI L, YING J, MA C, WANG Y, et al. The epigenetic modifier PRDM5 functions as a tumor suppressor through modulating WNT/β-catenin signaling and is frequently silenced in multiple tumors. PLoS One[J]. 2011, 6 :e27346. |
| [12] | TAN S X, HU R C, TAN Y L, LIU J J, LIU W E. Promoter methylation-mediated downregulation of PRDM5 contributes to the development of lung squamous cell carcinoma. Tumour Biol[J]. 2014, 35 :4509–4516 . |
| [13] | BOND C E, BETTINGTON M L, PEARSON S A, MCKEONE D M, LEGGETT B A, WHITEHALL V L. Methylation and expression of the tumour suppressor, PRDM5, in colorectal cancer and polyp subgroups. BMC Cancer[J]. 2015, 15 :20. |
 2016, Vol. 37
2016, Vol. 37


