2. 第二军医大学长海医院脑血管病中心, 上海 200433;
3. 浙江省海宁市第二人民医院神经内科, 海宁 314400
2. Cerebral Vascular Disease Center, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
3. Department of Neurology, Second People's Hospital of Haining, Haining 314400, Zhejiang, China
结核性脊髓炎是中枢神经系统结核感染中比较少见的类型,临床表现不典型,诊断缺乏特异性。2010年1月至2015年7月第二军医大学长海医院共收治第一诊断为结核性脊髓炎的患者4例。本研究总结分析了结核性脊髓炎的临床特点、脑脊液及影像学表现,以期为其早期诊断及治疗提供依据。
1 资料和方法 1.1 一般资料2010年1月至2015年7月第二军医大学长海医院收治的第一诊断为结核性脊髓炎的患者4例,其中男性3例,女性1例,年龄33~69岁。发病至就诊的时间为8 d至1年。2例患者有其他部位结核病史,在正规抗结核治疗过程中出现症状;1例患者结核病史不明确,经诊断性抗结核治疗而确诊;1例患者依靠病理活检确诊。
1.2 临床观察及检测指标患者入院后,观察其主要临床特征及体征,并行腰椎穿刺术检查脑脊液各项指标。1例患者行外周血T-SPOT TB检测。所有患者入院后均行磁共振成像(MRI)检查,3例行颈椎MRI检查,4例行胸椎MRI检查,3例行腰椎MRI检查。
1.3 治疗方法及随访4例患者均转入上海市肺科医院进行进一步诊治,予以正规四联抗结核治疗,并加用糖皮质激素,疗程为1.5~2年。每月电话随访病例1~3次,共随访半年。病例4每半个月门诊随访一次,随访至今。
2 结果 2.1 临床表现与体格检查病例1:男,33岁,在正规抗肺结核治疗3个月后出现双下肢无力伴疼痛。神经系统检查:神清语利,脑神经未见异常,剑突平面以下深浅感觉减退,双下肢肌力4级,双侧肱二头肌反射(),双侧膝腱反射消失,双侧Hoffmann征(+),颈软,双侧Babinski征(-),Kernig’s征(+)。病例2:男,42岁,在治疗结核性脑膜炎10 d后出现双下肢无力伴二便功能障碍。神经系统检查:神清语利,脑神经未见异常,双下肢肌力3级,双侧肱二头肌反射、膝腱反射(),颈软,双侧Babinski征(+),Kernig’s征(-)。病例3:女,43岁,3年前有结核性脑膜炎病史,近1年来双下肢无力。神经系统检查:神清语利,脑神经未见异常,双下肢肌力2级,双侧肱二头肌反射、膝腱反射(),颈软,双侧Babinski征(+),Kernig’s征(-)。入院后在全麻下行颈胸段椎管内占位切除并行病理活检最终确诊。病例4:男,69岁,既往有类风湿关节炎病史,未服用免疫抑制类药物。首发症状为腰部疼痛,后因出现双下肢无力伴疼痛、二便困难8 d入院。神经系统检查:神清语利,脑神经未见异常,右下肢肌力4-级,左下肢肌力2级,右侧膝腱反射(+),左侧膝腱反射(-);左侧T6平面以下深浅感觉减退,右侧T8平面以下深浅感觉减退;颈软,双侧Babinski征(-),Kernig’s征(+),左侧明显,入院5 d后双侧病理征转为阳性。
2.2 腰穿脑脊液及外周血T-SPOTTB检测结果 4例患者腰穿脑脊液检测结果如表 1所示。4例患者脑脊液结核PCR结果均为阴性,脑脊液抗酸杆菌涂片也均未见抗酸杆菌,且病例2和4在未经特殊治疗情况下第2次腰穿抽取脑脊液复查结果仍为阴性。病例4脑脊液和外周血同时送检水通道蛋白4抗体结果阴性,第2次复查时外周血T-SPOT检测结果也仍为阴性;病例2第2次复查时PPD试验结果呈强阳性。
|
|
表 1 4例患者腰穿脑脊液检测结果 |
2.3 MRI检查结果
病例1:颈椎MRI示C7后缘蛛网膜下隙增宽,蛛网膜粘连,囊肿形成可能;胸椎MRI示胸段脊髓炎症并空洞形成;腰椎MRI示腰髓略增粗、肿胀。病例2:腰椎MRI示增强后脊髓圆锥及马尾神经表面强化,胸椎MRI未见明显异常。病例3:颈胸椎MRI示广泛性蛛网膜下隙炎症后改变,颈胸段脊髓前方蛛网膜间隙明显增宽,C4~5节段脊髓前方不规则异常信号影(考虑钙化可能),下颈段和上胸段脊髓明显受压变细,脊髓周边多发囊性改变。病例4:胸腰段MRI示T6~11椎体平面脊髓炎性改变,考虑炎症,见图 1;颈椎MRI未见明显异常。
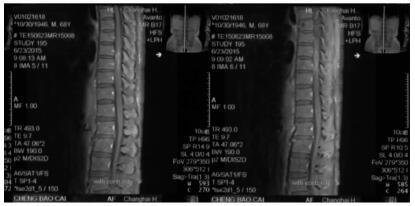
|
图 1 病例4胸腰椎磁共振成像(MRI)检查结果 |
2.4 预后
4例患者经正规四联抗结核治疗1个月后均明显好转。病例4双下肢无力明显改善,扶物可独立行走,且恢复正常排便,但小便功能恢复较慢;至正规四联抗结核治疗3个月后方可自行排尿,目前正处于抗结核疗程中,随访半年后完全恢复独立行走。其余3例患者随访至抗结核疗程结束,病例2恢复至可独立行走,病例1和3在单人搀扶下可行走。
3 讨论中枢神经系统结核占所有结核感染类型的1%,而这其中一半的感染侵犯脊柱[1-2]。在结核性脊柱脊髓炎中,大约55%的患者有椎体受累,39%发生椎管内结核性肉芽肿,仅有7%的患者发生结核性脊髓炎[3]。由于结核性脊髓炎的发病率低,目前研究主要为病例报道;本病多见于青壮年,发病部位以颈胸段最常见。在发达国家结核性脊髓炎患者多合并人类免疫缺陷病毒(HIV)阳性等免疫异常性疾病,在HIV阳性的患者中结核性脊髓炎的发病率为10%~20%[4]。结核性脊髓炎在发展中国家一直是重要的公共卫生问题,其严重的并发症是高致残率和致死率,同时其也是导致横贯性脊髓炎非常少见的原因。Garg等[5]统计分析了从1947到2015年在结核性脑(脊)膜炎方面的1 078篇报道(含个案报道),结果表明脊髓萎缩、空泡、多种并发症及形成脊髓空洞症常与其不良预后相关;但有关本病的预后尚未见系统性回顾。
结核性脊髓炎是由身体其他部位(多数为肺)的结核杆菌经血液循环或脊柱结核直接浸润而形成的脊髓损害,多同时累及脊膜,故也称为结核性脊膜脊髓炎。免疫系统非正常激活进而导致免疫攻击是结核性脊髓炎的主要病理机制[6-8],通常累及多节段脊髓,导致长节段脊髓炎。本研究中病例1、2和3均有明确的肺和结核性脑膜炎病史,病例1和2甚至在抗结核治疗过程中发病,病例3既往有结核性脑膜炎史,依靠病理活检确诊。病例4否认其他部位结核感染史,且入院3个月前及本次入院查胸部CT均未见肺内结核病灶,多次行其他相关检查也未发现其余部位结核感染灶,诊断上比较困难,后经诊断性抗结核治疗而明确诊断,考虑以原发于脊髓段的脊髓蛛网膜炎方式起病的可能性大。本研究病例病变部位基本都位于颈胸段,病例2病变部位在脊髓圆锥部,比较罕见;病例1和病例4都有神经根刺激症状,考虑同时累及脊膜导致神经根痛。Gupta等[9]回顾总结了71例新诊断为结核性脊髓炎患者的病史资料,结果表明,同时累及神经根的患者预后较差,其中脑脊液蛋白显著升高(>2.5 g/L)是重要的预测因素。
结核性脊髓炎腰穿脑脊液检查结果示细胞数轻度增高,白细胞数十至数百(×106/L)、多呈混合型,以单核细胞占优势者约占85%,该混合细胞反应为脑脊液细胞学的最显著特征[10],一般持续时间较长。病情好转后中性粒细胞消失,主要为淋巴细胞及单核细胞。蛋白含量轻、中度升高,氯化物及葡萄糖多降低。脑脊液动力学检查可发现椎管通畅或部分阻塞;外观呈毛玻璃状,放置数小时可见白色纤维薄膜形成,该膜抗酸染色直接涂片较易发现结核杆菌。目前结核性脊髓炎的诊断金标准为脑脊液中找到结核杆菌,但本研究4组病例抗酸杆菌涂片及结核PCR均未找到结核杆菌。近年来发现脑脊液腺苷脱氨酶(ADA)对中枢神经系统结核的诊断有一定的特异性。ADA广泛分布于人体的免疫系统内,参与核酸的分解代谢。结核分歧杆菌侵袭脑膜时,脑脊液内淋巴细胞数量扩增,核酸分解代谢增强,导致脑脊液ADA的浓度增加[11]。但脑脊液ADA用于结核性脑(膜)炎的诊断尚无统一的界定值,5~7 U/L不能排除也不支持结核性脑(膜)炎,>8 U/L高度怀疑,>20 U/L可以肯定[12];以10 U/L为界点,其诊断敏感性和特异性分别为82.14%和90.91%[13]。病例1和病例4腰穿脑脊液压力不高,同时有神经根刺激症状,炎性渗出物的粘连作用导致脊髓蛛网膜下隙狭窄或梗阻,病例2和病例3脑脊液压力增高,无神经根刺激症状,脑脊液动力学显示椎管通畅。本组病例脑脊液白细胞数均在数十至数百(×106/L)之间波动,且均以单核细胞占优势,蛋白明显升高,糖和氯化物浓度降低。病例2和病例4检测脑脊液ADA水平均未达到可疑水平,但笔者同时统计了同时期病毒性中枢神经系统感染、细菌性中枢神经系统感染以及其他非中枢神经系统感染性疾病如多发性硬化、中枢神经系统血管炎等共200余例患者的脑脊液ADA水平,结果发现均在1~2 U/L间波动;本研究2例患者脑脊液ADA水平已明显高于非结核性中枢神经系统感染患者,且二次复查时ADA水平较前次上升,动态复查更具临床意义。本研究2例患者脑脊液ADA水平不高,可能是因为目前结核性脊髓炎以个案报道居多,大部分文献集中于结核性脑(膜)炎,而且结核性脊髓炎导致脑脊液中淋巴细胞增高相对不明显或延迟,有待大量研究证实。综上所述,若临床上怀疑中枢神经系统结核感染,即使脑脊液ADA <5 U/L也应注意复查,以防漏诊。
T-SPOT TB检测技术是使用结核分枝杆菌特异性抗原刺激外周血单个核细胞,通过γ-干扰素(IFN-γ)的分泌检测抗原特异性T淋巴细胞的应答反应,从而判断结核感染状态,具有较高的敏感性和特异性[14]。研究表明,T-SPOT TB在粟粒性结核中的强阳性率高,而机体免疫功能低下或高龄则会导致其阳性率降低[15]。T-SPOT TB在结核性脊髓炎中的研究比较少,本研究病例中仅有病例4行此项检测,结果为阴性;如果同时送检脑脊液行此项检测是否能提高检测的敏感性,还需大样本量数据。
脊髓MRI平扫及增强可清晰显示病变部位、大小和范围,其敏感性和特异性分别为100%和88%,同时结合脑脊液检查可提高结核性脊髓炎的诊断率。通常T1呈低信号、T2高信号,脊髓水肿、增粗,脊膜增厚,增强扫描后脊膜呈线状、斑块等不规则强化,但其影像学表现不具备特异性。结核性脊髓炎鉴别主要依靠患者病史、临床表现及脑脊液检查,其他脊髓病变的脑脊液变化与轻度结核性脑膜炎相同,但其中糖含量可以正常。
结核性脊髓炎的治疗应以全身规律抗结核治疗为主,尤其是对早期患者[16]。研究表明82%~95%的患者对药物治疗反应良好[17]。结核性脊髓炎的发病率较低,但可致畸致瘫,其预后与患者的病情轻重、营养状况、合并疾病等有关,病情迁延不愈和对抗结核化疗药物不敏感的患者预后较差。由于结核性脊髓炎的可治性,早诊断、早治疗对其预后具有决定性意义。
| [1] | CHERIAN A, THOMAS S V. Central nervous system tuberculosis. Afr Health Sci[J]. 2011, 11 :116–127 . |
| [2] | JAIN A K, DHAMMI I K. Tuberculosis of the spine: a review. Clin Orthop Relat Res[J]. 2007, 460 :39–49 . |
| [3] | MUTHUKUMAR N, VENKATESH G, SENTHILBABU S, RAJBASKAR R. Surgery for intramedullary tuberculoma of the spinal cord: report of 2 cases. Surg Neurol[J]. 2006, 66 :69–74 . |
| [4] | GARG R K. Tuberculosis of central nervous system. Postgrad Med J[J]. 1999, 75 :133–140 . |
| [5] | GARG R K, MALHOTRA H S, GUPTA R. Spinal cord involvement in tuberculous meningitis. Spinal Cord[J]. 2015, 53 :649–657 . |
| [6] | PUTRUELE A M, LEGARRETA C G, LIMONGI L, ROSSI S E. Tuberculous transverse myelitis: case report and review of the literature. Clin Pulm Med[J]. 2005, 12 :46–52 . |
| [7] | TREBST C, RAAB P, VOSS E V, ROMMER P, ABU-MUGHEISIB M, ZETTL U K, et al. Longitudinal extensive transverse myelitis-it's not all neuromyelitis optica. Nat Rev Neurol[J]. 2011, 7 :688–698 . |
| [8] | SAHU S K, GIRI S, GUPTA N. Longitudinal extensive transverse myelitis due to tuberculosis: a report of four cases. J Postgrad Med[J]. 2014, 60 :409–412 . |
| [9] | GUPTA R, GARG R K, JAIN A, MALHOTRA H S, VERMA R, SHARMA P K. Spinal cord and spinal nerve root involvement (myeloradiculopathy) in tuberculous meningitis. Medicine (Baltimore)[J]. 2015, 94 :e404. |
| [10] | SUDA S, UEDA M, KOMABA Y, YAMAZAKI M, KATSUMATA T, KATAYAMA Y. Tuberculous myelitis diagnosed by elevagted adenosine deaminase activity incerebro spinal fluid. J Clin Neurosci[J]. 2008, 15 :1068–1069 . |
| [11] | HECKENBERG S G, BROUWER M C, VAN DER ENDE A, VAN DE BEEK D. Adjunctive dexamethasone in adults with meningococcal meningitis. Neurology[J]. 2012, 79 :1563–1569 . |
| [12] | TUON F F, HIGASHINO H R, LOPES M I, LITVOC M N, ATOMIYA A N, ANTONANGELO L, et al. Adenosine deminase and tuberculous meningitis-a systematic review with meta-analysis. Scand J Infect Dis[J]. 2010, 42 :198–207 . |
| [13] | CHANDER A, SHRESTHA C D. Cerebrospinal fluid adenosine deaminase levels as a diagnostic marker in tuberculous meningitis in adult Nepalese patients. Asian Pac J Trop Dis[J]. 2013, 3 :16–19 . |
| [14] | LALVANI A, PAREEK M. Interferon gamma release assays: principles and practice. Enferm Infecc Microbiol Clin[J]. 2010, 28 :245–252 . |
| [15] | LEE Y M, KIM S M, PARK S J, LEE S O, CHOI S H, KIM Y S, et al. Factors associated with a strong response to the T-SPOT.TB in patients with extrapulmonary tuberculosis. Infect Chemother[J]. 2014, 46 :248–252 . |
| [16] | JIANG T, ZHAO J, HE M, WANG K, FOWDUR M, WU Y. Outcomes and treatment of lumbosacral spinal tuberculosis: a retrospective study of 53 patients. PLoS One[J]. 2015, 10 :e0130185. |
| [17] | GARG R K, SOMVANSHI D S. Spinal tuberculosis: a review. J Spinal Cord Med[J]. 2011, 34 :440–454 . |
 2016, Vol. 37
2016, Vol. 37


