2. 中央军委机关事务管理总局保健处, 北京 100034;
3. 第二军医大学长海医院神经外科, 上海 200433;
4. 第二军医大学基础部生理学教研室, 上海 200433
2. Health Office of the Administration Organization Affairs, Central Military Commission of People's Liberation Army, Beijing 100034, China;
3. Department of Neurosurgery, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;;
4. Department of Physiology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
心血管疾病已成为对人类健康威胁最大的一类疾病。世界卫生组织"全球疾病负担研究"的统计数字显示,2010年缺血性心脏疾病造成近740万人死亡,占全球死亡人数的13.2%,高居全球主要死亡原因榜首[1]。与之相应的,近几十年来我国心血管疾病的发病率和死亡率均呈上升趋势,心血管疾病死亡者占总死亡人数的百分比由1957年的12.07%上升到2001年的42.6% [2]。同样来自世界卫生组织的预测显示,到2020年,缺血性心脏疾病仍将是全球的首要死亡原因,而我国届时每年因心血管疾病死亡的人数将有可能达到400万[2-3]。高血脂、高盐饮食、吸烟、酗酒等因素都与心血管疾病有关,可以认为正是这多种后天损伤因素的累积最终导致了心血管疾病的发生。然而具有遗传倾向的原发性心血管疾病占所有心血管疾病发病率的比例高达75%[4],单纯的后天损伤学说无法很好地解释原发性心血管疾病的发病机制,亟待更深入地研究。
环境因素对心血管系统的影响从生命的最初阶段就已经开始。生命早期的环境因素不仅对胎儿的产前发育至关重要,对胎儿出生后机体的结构和功能也产生着持续性的影响。研究表明,妊娠期母体接触某种异常因素,如缺氧、营养不良、糖皮质激素(glucocorticoids,GCs)暴露等,对胎儿的中枢神经系统、心血管系统、免疫系统以及代谢水平都会产生一定程度的影响[3]。这种在妊娠期母体接触某种异常因素导致的某些子代基因表达的永久性改变,称为印迹效应(programming effect),其引发的子代成年疾病称为胎儿源性的成年疾病(fetus-origin adult disease)[5]。胚胎时期心血管系统的构成十分特殊[6],对各种内外环境的刺激极为敏感。研究发现,母体妊娠期的慢性缺氧可以减少心肌蛋白激酶Cε(protein kinase C epsilon,PKCε) 的表达,使得子代大鼠成年后心脏对缺血再灌注损伤的耐受性下降[7]。而母体禁食所导致的营养不良会增加子代成年大鼠左心室局部血管紧张素-Ⅱ和内皮素-Ⅰ的表达,从而产生冠状动脉血管周围纤维化、心脏扩大和心肌细胞肥大等一系列心肌重构的表现[8]。
GCs是由肾上腺皮质分泌的一种类固醇激素,对机体代谢、应激反应、神经系统发育以及下丘脑-垂体-肾上腺轴等起着重要的调节作用。作为一种典型的应激反应,母体在妊娠期间会分泌大量的GCs;同时,GCs由于具有促进胎儿器官特别是肺成熟的作用,在临床上广泛应用于具有早产风险的孕妇治疗。然而,由于GCs可以自由通过胎盘屏障,越来越多的研究表明,出生前接触过多的GCs会导致子代成年后某些疾病,如心血管疾病、2型糖尿病、神经精神疾病等的发生率明显增加[9-10]。但有关妊娠期母体GCs暴露对子代心脏功能的直接影响的研究甚少。血清和GCs调节的蛋白激酶(serum- and glucocorticoid-regulated protein kinase,SGK)是一种丝/苏氨酸蛋白激酶,当细胞受到GCs、血清以及多种其他胞内外因素刺激后,SGK的转录水平可迅速升高。SGK被认为可能是多种细胞信号转导通路和细胞磷酸化级联反应的功能性交汇点,在调节离子通道、细胞存活和凋亡的信号转导中起着重要的作用[11]。目前已发现哺乳类SGK的异构酶有3种,即SGK1、SGK2和SGK3。研究表明SGK1和SGK3在心脏组织中有表达,但后者不受GCs的基因调控[12]。SGK1在小鼠胚胎期9.5~12.5 d高表达于心室肌细胞,13.5~16.5 d在全心保持高表达状态,提示SGK1对胚胎期心脏发育有潜在的影响[13]。本研究通过明确孕鼠妊娠期GCs暴露后,是否通过调控子代心肌SGK1的表达从而发挥印迹作用,为进一步阐明子代成年后心血管疾病的病因和发病机制提供依据。
1 材料和方法 1.1 大鼠GCs印迹效应模型的建立成年SD大鼠[第二军医大学实验动物中心,动物许可证号:SYXK(沪)2012-0003]饲养于清洁卫生的动物房内,自由饮食。根据大鼠的发情周期进行合笼,次晨阴道涂片发现精子作为受孕0.5 d。孕鼠随机分为地塞米松(dexamethasone,DEX; Sigma-Aldrich公司,批号:46166)组和对照组,每组9只。为模拟GCs在临床治疗早产中的应用,在大鼠受孕后第14天开始给DEX组孕鼠皮下注射DEX 0.1 mg/(kg·d),直至分娩(21 d);对照组注射等量生理盐水。孕鼠分娩后,子代称体质量,将DEX组和对照组大鼠的子代再分别分为雄性和雌性两组,即DEX-male组(n=49)、DEX-female组(n=44)、NS-male组(n=51)和NS-female组(n=43)。处死部分新生鼠留取心肌组织,其余子代大鼠饲养至成年(12周)并定期称体质量。
1.2 大鼠心肌缺血再灌注模型建立及心肌损伤检测子代大鼠成年后,在麻醉状态下开胸,暴露心脏,用6-0号丝线在左心耳下方1~2 mm位置结扎冠状动脉左前降支,结扎深度1~2 mm。为便于进行再灌注,结扎线固定于一段PE-20动脉插管上。结扎1 h后放松结扎线使心肌再灌注2 h。再次收紧结扎线,股静脉注射2%的Evans蓝染料(Sigma-Aldrich公司,0.4 mL/100 g)以区分未受缺血再灌注影响区域。切取心脏,将心脏平行于房室沟从顶部到底部切2 mm厚切片,多聚甲醛溶液浸泡2 h。梗死血管之外的心肌呈蓝染,未蓝染区域为缺血再灌注损伤的危险区。为进一步确定梗死区域,将心肌组织切片置于1% 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)中,37℃孵育15 min。活性心肌被染成暗红色,梗死心肌呈苍白色。用Image J软件测量梗死面积和危险区面积,并计算梗死心肌面积与缺血再灌注损伤危险区(未蓝染区域)总面积的比值。
1.3 实时定量PCR检测心肌保护性因子的表达用TRIzol-酚/氯仿法抽提心肌组织总RNA,取2 g RNA用MMTV反转录酶(Promega公司)行反转录,SYBR green法 (北京天根生化科技有限公司)实时定量PCR检测成年子代大鼠心肌组织中Sgk1、促肾上腺皮质激素释放激素(CRH)受体(Crhr2)、GCs受体(Gr)、CRH家族肽Urocorthin (Ucn)、Ucn2以及Sgk1不同亚型(variant1~3)的表达。采用在线软件Primer 3 (http://bioinfo.ut.ee/primer3/)设计引物,上下游引物之间至少跨1个内含子,并进行blast以确认引物的特异性。引物序列见表 1。根据梯度PCR产物电泳后的产物得率和纯度优化退火温度为58~61℃,用熔解曲线法验证定量PCR产物的特异性。扩增管家基因GAPDH作为上样的内参和标准化,使用 2-ΔΔCt 算法对靶基因和管家基因进行相对定量[14]。
|
|
表 1 实时定量PCR所用引物序列 Tab 1 Primer sequences used for real-time PCR |
1.4 蛋白质印迹法检测SGK1蛋白的表达
向约100 mg的心肌组织中加入RIPA裂解液和蛋白酶抑制剂(Cell Signaling公司),匀浆后离心取上清,BCA法检测蛋白浓度。SDS-PAGE分离蛋白样品,转印至硝酸纤维素(NC)膜上,5%脱脂奶粉室温封闭1 h后,加入SGK1一抗(1∶500,Santa Cruz公司)或GAPDH一抗 (1∶2 000,Santa Cruz公司),4℃孵育过夜后,洗膜,加入相应HRP偶联的二抗,室温孵育1 h。将增强型HRP发光底物(ECL,Santa Cruz公司)加于NC膜上,反应2 min后,使用Tanon 5200 Multi Image System (上海天能科技有限公司)检测条带灰度值并定量。为校正上样误差,结果用SGK1条带灰度值与GAPDH条带灰度值的比值来表示。
1.5 Sgk1基因启动子CpG岛预测和甲基化检测通过在线CpG岛(CpG island,CGI)预测软件(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)对大鼠Sgk1基因(http://www.ncbi.nlm.nih.gov/gene/29517)转录起始位点上下游各1 kb的启动子区域进行检测,发现2个CpG岛(CGI1,CGI2),长度分别是393 bp和110 bp。从对照组和DEX组各取3只子代雄性大鼠心肌组织,抽提基因组DNA并进行亚硫酸氢钠处理,之后以反转录的cDNA为模板,对CpG岛区域进行PCR扩增,其中CGI1因长度较大,分为2段进行扩增(CGI1-1,CGI1-2)。将PCR产物进行TA克隆,每个产物挑选10个阳性克隆测序,进行甲基化程度分析。引物序列见表 2。
|
|
表 2 BSP-甲基化测序法所用扩增引物序列 Tab 2 Primer sequences used for methylation sequencing by BSP |
1.6 统计学处理
采用Graphpad Prism 6.1 软件进行数据汇总和统计分析。数据用x±sx来表示,并用单因素方差分析结合SNK检验进行两两比较。检验水准(α)为0.05。
2 结 果 2.1 妊娠期接触GCs对子代大鼠体质量的影响为检测妊娠期GCs暴露对子代大鼠的总体影响,本研究首先观察了DEX处理对出生乳鼠的数量和性别的影响,发现DEX组和对照组每窝出生雄性乳鼠的数量分别为(5.444 ± 0.475)只和 (5.667 ± 0.553)只 (P=0.76),雌性乳鼠的数量分别为(4.889 ± 0.484)只和(4.778 ± 0.324)只(P=0.85)。随后分别称量DEX组和对照组子代大鼠出生时与成年后的体质量,发现妊娠期GCs暴露子代新生和成年大鼠的体质量与对照组相比均降低(P<0.01,图 1)。
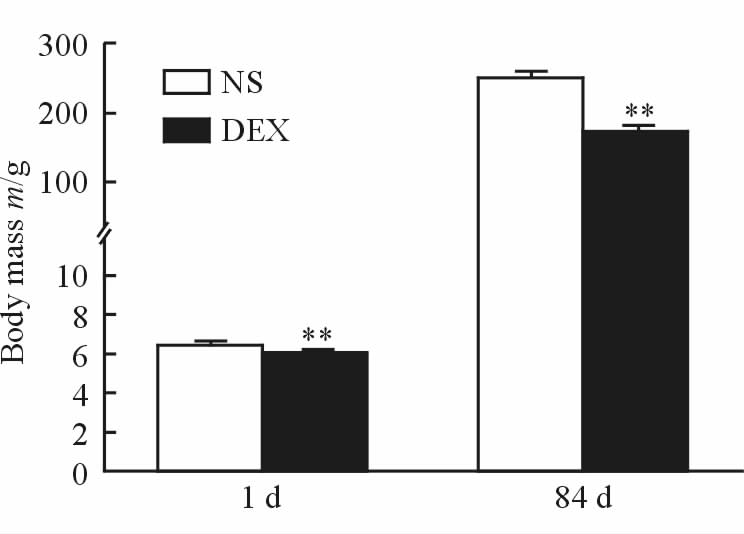
|
图 1 妊娠期GCs暴露子代大鼠出生时及成年后体质量的变化 Fig 1 The body mass of newborn (1 day) and adult (84 days) offspring rats exposed to GCs during pregnancy |
2.2 妊娠期GCs暴露对子代大鼠心肌缺血再灌注损伤的影响
不同处理组的子代大鼠成年后,对各组大鼠行冠状动脉左前降支结扎1 h,制造心肌缺血,再灌注2 h后取心脏进行TTC染色检测心脏梗死面积,结果显示妊娠期GCs暴露子代雄性大鼠的心肌梗死区与缺血区面积的比值高于对照组(P<0.01),而子代雌性大鼠的心肌梗死区与缺血区面积比值在两组之间差异无统计学意义(P>0.05,图 2)。
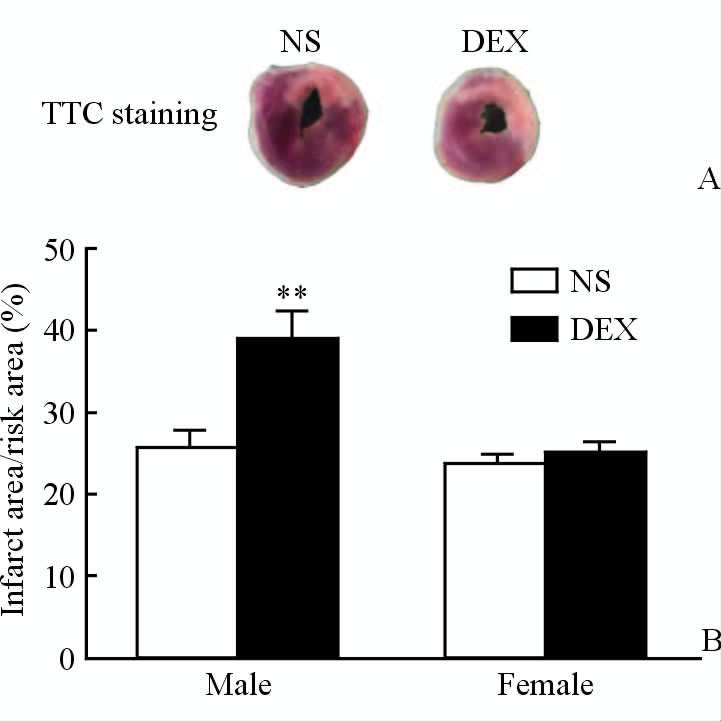
|
图 2 妊娠期GCs暴露子代成年大鼠心肌缺血再灌注后的梗死区与缺血区面积比值 Fig 2 The ratio between infarct area and risk area upon I/R injury in adult offspring rats exposed to GCs during pregnancy |
2.3 妊娠期GCs暴露的子代大鼠成年后心肌保护性因子的表达变化
实时定量PCR结果显示,与对照组相比,妊娠期GCs暴露子代雄性大鼠成年后心肌Sgk1 mRNA表达降低(P<0.01,图 3A),雌性大鼠心肌Sgk1 mRNA表达没有显著变化(图 3B); 子代雄性大鼠成年后心肌中Sgk1基因3种亚型(variant1~3)的mRNA表达均下降(P<0.01),而在子代雌性大鼠心肌中仅有variant 2和variant 3的mRNA表达下降(P<0.01,图 3C~3E),提示不同亚型的Sgk1 mRNA表达存在性别差异。蛋白质印迹分析结果显示,与对照组相比,SGK1蛋白在妊娠期GCs暴露子代雄性和雌性大鼠心肌中的表达也发生相应变化,即在子代雄性成年大鼠心肌中的表达降低(P<0.05),而在子代雌性成年大鼠心肌中的表达无明显改变(图 3F)。提示妊娠期GCs暴露可能通过改变子代雄性大鼠成年后心肌SGK1的水平影响SGK1对心肌的保护作用。

|
图 3 SGK1在妊娠期GCs暴露子代成年大鼠心肌中的表达变化 Fig 3 The expression of SGK1 mRNA and protein in myocardium of adult offspring rats exposed to GCs during pregnancy |
除了SGK1以外,我们前期的研究还发现其他一些对心肌损伤有保护作用的靶点,如促肾上腺皮质激素释放激素受体(CRHR2、CRH家族肽 urocortin (UCN和 urocortin2(UCN2等[15-16],因此本研究进一步研究了这些靶点和GCs受体(glucocorticoid receptor,GR在妊娠期GCs暴露子代大鼠心肌中的表达。结果表明,无论在雄性和雌性子代大鼠中,心肌Crhr2和Gr的mRNA水平均没有明显改变(图 4A、4B),而Ucn和Ucn2的mRNA在妊娠期GCs暴露组子代雌性大鼠心肌中的表达低于对照组(P<0.05,图 4C、4D),提示GCs暴露可能通过影响UCN和UCN2在心肌中的表达从而削弱其对缺氧损伤的保护能力。

|
图 4 Crhr2 (A)、Gr (B)、Ucn (C)和Ucn2 (D) mRNA在妊娠期GCs暴露子代成年大鼠心肌中的表达变化 Fig 4 The mRNA expression of Crhr2 (A),Gr (B),Ucn (C) and Ucn2 (D) in the myocardium of adult offspring rats exposed to GCs during pregnancy |
2.4 妊娠期GCs暴露子代大鼠心肌Sgk1
基因启动子区CpG岛甲基化水平变化 使用公认的CpG岛在线预测工具对大鼠Sgk1基因启动子区域(-1~+1 kb)的CpG岛进行了预测,发现了2个大小分别为393 bp和110 bp的CpG岛(CGI1、CGI2,图 5A)。通过亚硫酸氢盐法处理后对这2个CpG岛分别进行测序,结果发现妊娠期GCs暴露可以增加子代成年雄性大鼠心肌Sgk1启动子区域CGI2的甲基化水平(P<0.01),而对CGI1的甲基化水平没有明显影响(图 5B~5E),提示Sgk1基因启动子近端CpG岛的高甲基化可能是妊娠期GCs暴露对子代大鼠心肌SGK1反常性下调的重要机制。
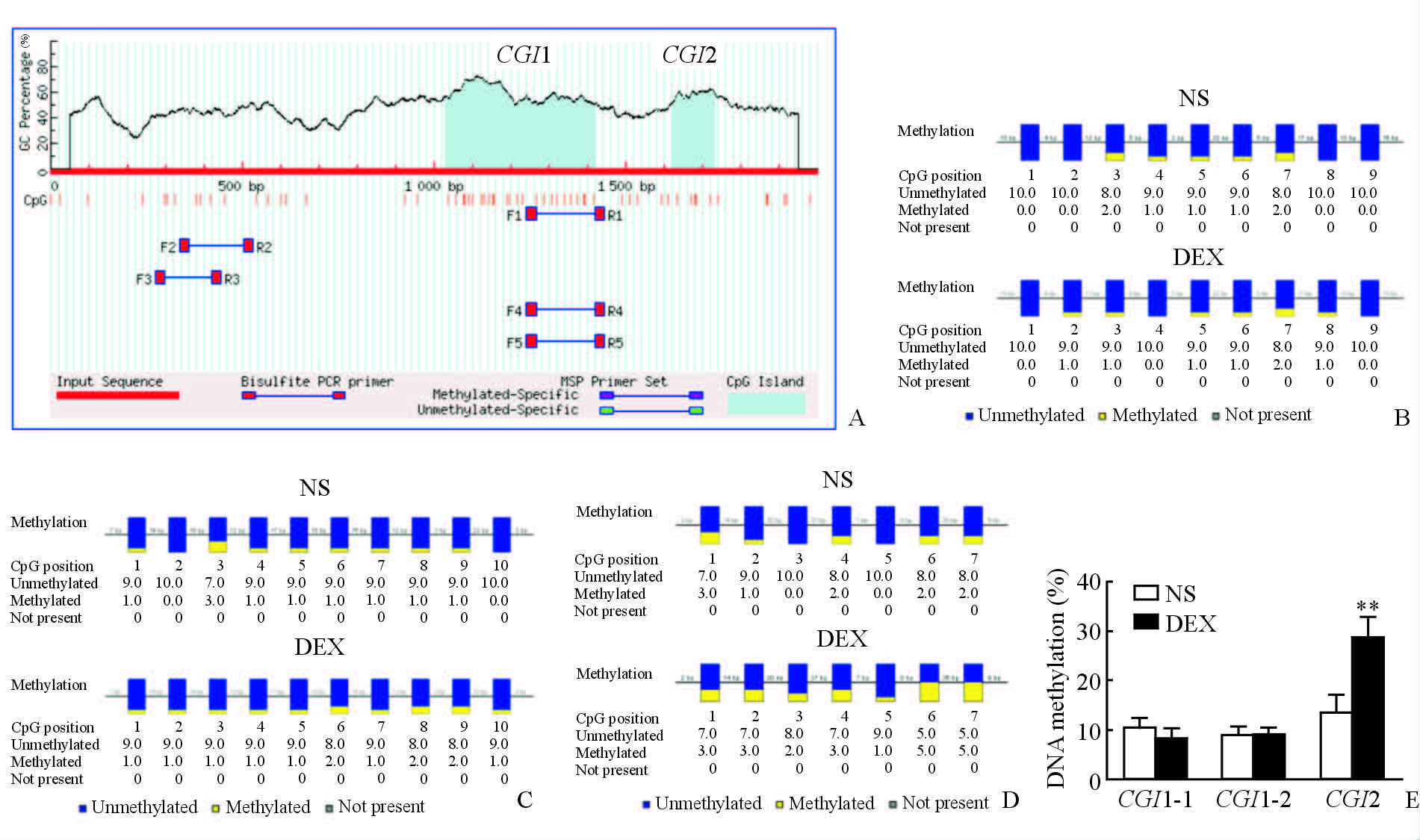
|
图 5 Sgk1基因启动子CpG岛甲基化水平变化 Fig 5 Methylation level of Sgk1 promoter |
3 讨 论
流行病学调查和动物实验研究均表明不利的宫内环境与子代成年后心血管疾病发生风险的升高有明确的关联[3, 17]。出生前过量GCs暴露致子代高血压是GCs经典的印迹效应之一[18],其机制可能是多方面的,包括肾单位发育损伤、肾素-血管紧张素系统(RAS)和交感神经系统(SNS)过度激活、血管舒缩功能障碍,伴有血管紧张素受体表达的增加、心脏去甲肾上腺能活动的改变和交感系统控制的压力反射的改变等[19-22]。与此同时,大量的流行病学研究表明,印迹效应所致的胎儿低出生体质量使子代成年后冠心病和缺血性心肌病等心脏疾病的发生率显著提高[23-26]。本研究发现,妊娠期接触GCs的子代大鼠成年后,缺血再灌注引起的心肌损伤比妊娠期未接触GCs的子代大鼠更为明显,提示了胚胎期接触GCs可能增加成年后心脏对损伤的易感性。研究发现,SGK1介导了UCN和雌激素对心肌缺氧损伤的保护机制,将Sgk1敲除可使缺氧状态下心肌细胞活力明显下降[27];胰岛素样生长因子1(IGF-1)可上调SGK1的表达,从而发挥抗心肌细胞凋亡的作用[28]。本研究观察到SGK1的mRNA和蛋白水平在妊娠期接触GCs的子代雄性大鼠心肌中的表达降低,进一步明确了Sgk1是GCs对子代心血管功能印迹效应的重要靶基因之一。
印迹效应所表现出的性别特异性在之前的研究中时有发现。如母体高脂饮食可导致雄性子代大鼠成年后血管紧张素受体2(AT2)表达升高和心肌缺血再灌注损伤加重,而对雌性子代成年大鼠没有影响,这一现象可能与雌激素调节心肌血管紧张素受体1(AT1)/AT2的表达从而发挥心肌保护作用有关[29-30]。妊娠期母体的慢性缺氧也会增加子代雄性大鼠心肌对缺血再灌注损伤的易感性,这一作用与PKCε在雄性大鼠心肌中的表达显著降低有关,而雌性大鼠心肌中较高水平的雌激素受体(ER)α/ERβ可能是阻止PKCε降低从而保护心肌的重要因素[7]。本研究发现,SGK1在妊娠期GCs暴露子代雄性大鼠心肌中的表达显著降低,而在雌性大鼠心肌中未见明显变化,这一性别差异是否也是由雌/雄大鼠中雌激素或其受体表达水平的不同所引起的,有待于进一步研究。值得注意的是,UCN和UCN2在孕期GCs暴露的子代雌性大鼠心肌中表达显著下降,二者都是CRHR2的选择性激动剂,具有一定的心肌保护作用[31-32]。我们前期的研究发现雌激素可以上调CRHR2在心肌中的表达[15],因此雌性大鼠中CRHR2的上调至少可以部分抵消UCN和UCN2降低对心肌带来的不利影响。
有趣的是,在大部分组织器官中,GCs可以诱导SGK1的表达[12],其在GCs暴露的子代大鼠心肌中的这种反常降低提示了表观调节机制的存在。研究表明,妊娠期GCs暴露可导致子代某些基因的甲基化水平发生改变,从而影响基因的表达[33-35]。然而既往研究主要集中在GCs受体Nr3c1基因上,而且对Nr3c1启动子高甲基化的意义尚有争论,如Mueller和Bale[36]的研究发现妊娠早期应激导致的海马Nr3c1启动子高甲基化可以下调NR3C1的表达;而Bockmühl 等[35]近期的研究则发现下丘脑Nr3c1启动子CpG岛的高甲基化却可上调其基因的表达,提示甲基化调节具有一定的组织特异性,并且对于不同基因可能有不同的调节机制。本研究通过最新的BSP-测序方法发现GCs暴露的子代大鼠心肌中Sgk1基因启动子近端CpG岛的甲基化水平显著升高,而远端CpG岛的甲基化水平并未发生显著改变,提示近端CpG岛的高甲基化可能导致了GCs对SGK1表达的反常调节,但其具体机制尚有待于进一步研究。
Lessi等[37]在结直肠癌的研究中发现,尽管SGK1在结直肠癌组织中表达显著降低,但并未观察到Sgk1基因启动子区域的高甲基化改变,提示SGK1的表观性调节可能还存在着其他机制。Crudo等[38]的研究发现,妊娠期GCs暴露不仅会影响子代基因的甲基化状态,也对组蛋白(如H3K9)乙酰化的水平产生调节。Yu等[39]发现,妊娠期GCs暴露后子代大鼠的脾中TNF-α的表达减少,而这一表达的减少与TNF-α启动子区域结合的组蛋白H3K4me1/3和H3K36me3等的乙酰化水平降低有关。因此,GCs暴露的子代大鼠心肌中是否还存在其他表观遗传学的改变,从而影响Sgk1等心肌保护相关基因的表达,也是一个值得深入探讨的问题。
GCs作为预防早产儿器官发育不全的药物,广泛应用于具有早产风险的孕妇。然而越来越多的研究提示过早或过量使用GCs会显著升高子代成年后包括心血管疾病在内的多种疾病的发病率。本研究对于如何进一步规范GCs的临床应用,并通过与其他药物合用以消除GCs对胎儿的印迹效应,提升早产儿的长期生存质量具有重要的临床价值和社会意义。
| [1] | LOZANO R, NAGHAVI M, FOREMAN K, LIM S, SHIBUYA K, ABOYANS V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet[J]. 2012, 380 :2095–2128 . |
| [2] | 卫生部心血管疾病防治研究中心. 中国心血管病报告2005[M]. 北京: 中国大百科全书出版社, 2006 : 11 . |
| [3] | GLUCKMAN P D, HANSON M A, COOPER C, THORNBURG K L. Effect of in utero and early-life conditions on adult health and disease. N Engl J Med[J]. 2008, 359 :61–73 . |
| [4] | INGLESJ, YEATES L, O' BRIEN L, MCGAUGHRAN J, SCUFFHAM P A, ATHERTON J, et al. Genetic testing for inherited heart diseases: longitudinal impact on health-related quality of life. Genet Med[J]. 2012, 14 :749–752 . |
| [5] | BARKER D J. The developmental origins of adult disease. J Am Coll Nutr[J]. 2004, 23 ((6 Suppl)) :588S–595S . |
| [6] | BARRINGTON K J. Hypotension and shock in the preterm infant. Semin Fetal Neonatal Med[J]. 2008, 13 :16–23 . |
| [7] | PATTERSON A J, CHEN M, XUE Q, XIAO D, ZHANG L. Chronic prenatal hypoxia induces epigenetic programming of PKCε gene repression in rat hearts. Circ Res[J]. 2010, 107 :365–373 . |
| [8] | KAWAMURA M, ITOH H, YURA S, MOGAMI H, SUGA S, MAKINO H, et al. Undernutrition in utero augments systolic blood pressure and cardiac remodeling in adult mouse offspring: possible involvement of local cardiac angiotensin system in developmental origins of cardiovascular disease. Endocrinology[J]. 2007, 148 :1218–1225 . |
| [9] | SECKL J R. Prenatal glucocorticoids and long-term programming. Eur J Endocrinol[J]. 2004, 151 ((Suppl 3)) :U49. |
| [10] | MORITZ K M, BOON W M, WINTOUR E M. Glucocorticoid programming of adult disease. Cell Tissue Res[J]. 2005, 322 :81–88 . |
| [11] | BRUNET A, PARK J, TRAN H, HU L S, HEMMINGS B A, GREENBERG M E. Protein kinase SGK mediates survival signals by phosphorylating the forkhead transcription factor FKHRL1 (FOXO3a). Mol Cell Biol[J]. 2001, 21 :952–965 . |
| [12] | LANG F, COHEN P. Regulation and physiological roles of serum- and glucocorticoid-induced protein kinase isoforms. Sci STKE[J]. 2001, 2001 . |
| [13] | LEE E, LEIN E S, FIRESTONE G L. Tissue-specific expression of the transcriptionally regulated serum- and glucocorticoid-inducible protein kinase (SGK) during mouse embryogenesis. Mech Dev[J]. 2001, 103 :177–181 . |
| [14] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods[J]. 2001, 25 :402–408 . |
| [15] | CONG B, NI X. Estrogen up-regulates CRHR2 expression via demethylation of CRHR2 gene promoter in cardiomyocytes. Int J Cardiol[J]. 2014, 172 :496–497 . |
| [16] | CONG B, ZHU X, CAO B, XIAO J, WANG Z, NI X. Estrogens protect myocardium against ischemia/reperfusion insult by up-regulation of CRH receptor type 2 in female rats. Int J Cardiol[J]. 2013, 168 :4755–4760 . |
| [17] | BATESON P, BARKER D, CLUTTON-BROCK T, DEB D, D'UDINE B, FOLEY R A, et al. Developmental plasticity and human health. Nature[J]. 2004, 430 :419–421 . |
| [18] | NUYT A M, ALEXANDER B T. Developmental programming and hypertension. Curr Opin Nephrol Hypertens[J]. 2009, 18 :144–152 . |
| [19] | DRAKE A J, TANG J I, NYIRENDA M J. Mechanisms underlying the role of glucocorticoids in the early life programming of adult disease. Clin Sci (Lond)[J]. 2007, 113 :219–232 . |
| [20] | WYRWOLL C S, MARK P J, WADDELL B J. Developmental programming of renal glucocorticoid sensitivity and the renin-angiotensin system. Hypertension[J]. 2007, 50 :579–584 . |
| [21] | DODIC M, MCALINDEN A T, JEFFERIES A J, WINTOUR E M, COCK M L, MAY C N, et al. Differential effects of prenatal exposure to dexamethasone or cortisol on circulatory control mechanisms mediated by angiotensin Ⅱ in the central nervous system of adult sheep. J Physiol[J]. 2006, 571 :651–660 . |
| [22] | BOGDARINA I, HAASE A, LANGLEY-EVANS S, CLARK A J. Glucocorticoid effects on the programming of AT1b angiotensin receptor gene methylation and expression in the rat. PLoS One[J]. 2010, 5 :e9237. |
| [23] | SECKL J R, MEANEY M J. Glucocorticoid programming. Ann N Y Acad Sci[J]. 2004, 1032 :63–84 . |
| [24] | LANGDOWN M L, SMITH N D, SUGDEN M C, HOLNESS M J. Excessive glucocorticoid exposure during late intrauterine development modulates the expression of cardiac uncoupling proteins in adult hypertensive male offspring. Pflugers Arch[J]. 2001, 442 :248–255 . |
| [25] | ARNOLD L W, HOY W E, WANG Z. Low birth weight and large adult waist circumference increase the risk of cardiovascular disease in remote indigenous Australians-an 18 year cohort study. Int J Cardiol[J]. 2015, 186 :273–275 . |
| [26] | RICH-EDWARDS J W, STAMPFER M J, MANSON J E, ROSNER B, HANKINSON S E, COLDITZ G A, et al. Birth weight and risk of cardiovascular disease in a cohort of women followed up since 1976. BMJ[J]. 1997, 315 :396–400 . |
| [27] | CONG B, WANG L, ZHU X, LI X, LIU B, NI X. SGK1 is involved in cardioprotection of urocortin-1 against hypoxia/reoxygenation in cardiomyocytes. Can J Cardiol[J]. 2014, 30 :687–695 . |
| [28] | AOYAMA T, MATSUI T, NOVIKOV M, PARK J, HEMMINGS B, ROSENZWEIG A. Serum and glucocorticoid-responsive kinase-1 regulates cardiomyocyte survival and hypertrophic response. Circulation[J]. 2005, 111 :1652–1659 . |
| [29] | XUE Q, XIAO D, ZHANG L. Estrogen regulates angiotensin Ⅱ receptor expression patterns and protects the heart from ischemic injury in female rats. Biol Reprod[J]. 2015, 93 :6. |
| [30] | XUE Q, CHEN P, LI X, ZHANG G, PATTERSON A J, LUO J. Maternal high-fat diet causes a sex-dependent increase in AGTR2 expression and cardiac dysfunction in adult male rat offspring. Biol Reprod[J]. 2015, 93 :49. |
| [31] | BRAR B K, JONASSEN A K, STEPHANOU A, SANTILLI G, RAILSON J, KNIGHT R A, et al. Urocortin protects against ischemic and reperfusion injury via a MAPK-dependent pathway. J Biol Chem[J]. 2000, 275 :8508–8514 . |
| [32] | EMETO T I, MOXON J V, RUSH C, WOODWARD L, GOLLEDGE J. Relevance of urocortins to cardiovascular disease. J Mol Cell Cardiol[J]. 2011, 51 :299–307 . |
| [33] | MOISIADIS V G, MATTHEWS S G. Glucocorticoids and fetal programming part 2: mechanisms. Nat Rev Endocrinol[J]. 2014, 10 :403–411 . |
| [34] | CRUDO A, PETROPOULOS S, MOISIADIS V G, IQBAL M, KOSTAKI A, MACHNES Z, et al. Prenatal synthetic glucocorticoid treatment changes DNA methylation states in male organ systems: multigenerational effects. Endocrinology[J]. 2012, 153 :3269–3283 . |
| [35] | BOCKMVHL Y, PATCHEV A V, MADEJSKA A, HOFFMANN A, SOUSA J C, SOUSA N, et al. Methylation at the CpG island shore region upregulates Nr3c1 promoter activity after early-life stress. Epigenetics[J]. 2015, 10 :247–257 . |
| [36] | MUELLER B R, BALE T L. Sex-specific programming of offspring emotionality after stress early in pregnancy. J Neurosci[J]. 2008, 28 :9055–9065 . |
| [37] | LESSI F, BEGGS A, DE PALO M, ANTI M, MACARONE PALMIERI R, FRANCESCONI S, et al. Down-regulation of serum/glucocorticoid regulated kinase 1 in colorectal tumours is largely independent of promoter hypermethylation. PLoS One[J]. 2010, 5 :e13840. |
| [38] | CRUDO A, SUDERMAN M, MOISIADIS V G, PETROPOULOS S, KOSTAKI A, HALLETT M, et al. Glucocorticoid programming of the fetal male hippocampal epigenome. Endocrinology[J]. 2013, 154 :1168–1180 . |
| [39] | YU H R, KUO H C, CHEN C C, SHEEN J M, TIAO M M, CHEN Y C, et al. Prenatal dexamethasone exposure in rats results in long-term epigenetic histone modifications and tumour necrosis factor-α production decrease. Immunology[J]. 2014, 143 :651–660 . |
 2016, Vol. 37
2016, Vol. 37


