天冬酰胺酶(asparaginase,Asp)是一种具有显著抗肿瘤作用的酶制剂[1]。Asp可通过降解天门冬酰胺产生天门冬氨酸和氨,从而抑制肿瘤细胞中蛋白质的正常合成,导致肿瘤细胞死亡[2-3]。但Asp有生物半衰期短、易被降解、稳定性差等缺点[3],一定程度上限制了Asp的临床应用。
目前,针对Asp的缺点,国内外已进行了下列研究:(1)聚乙二醇对Asp进行物理包埋[4-5];(2)制备纳米结构Asp脂肪酸生物共轭体[6];(3)将Asp共价结合固定化[7]等。而郭青龙等[8]和王弘等[9]报道的将游离Asp制备成前体脂质体,可明显降低Asp对小鼠的急性毒性和不良反应。但以上对Asp的改善方法都不能使Asp发挥其最优的催化活性,且大都存在稳定性较差及Asp易脱落等缺点。
自组装纳米囊[10-11]的空心结构可封装酶、小分子药物、基因等,它具有高度的生物膜相似性,能提高封装药物的稳定性,延长被封装药物的生物半衰期,提高封装药物的生物利用度以及降低不良反应等。本实验制备了载Asp自组装透明质酸-聚乙二醇/二甲基-β-环糊精纳米囊hyaluronic acid-graft-poly(ethylene glycol)/dimethyl-β-cyclodextrin nanocapsules loaded with Asp,AHDPs],并考察了AHDPs的透射电镜、粒径、zeta电位、包封率以及AHDPs在大鼠体内的药代动力学和生物等效性。
1 材料和方法 1.1 主要材料与试剂Asp,以色列Prospec公司;二甲基-β-环糊精(dimethyl-β-cyclodextrin,DCD),南京都莱生物技术有限公司;AHDPs,实验室自制,批号:20141013、20141017、20141022;Tris-HCl 缓冲液,50 mmol/L,pH 7.3,实验室自配;其他试剂均为分析纯。
1.2 主要仪器与动物Milli-Q超纯水系统(美国Millipore公司);pH计(上海精密科学仪器有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);85-2型恒温磁力搅拌器(上海司乐仪器有限公司); Zetasizer Nano zs90激光粒度电位仪(英国马尔文公司);UV-7504 PC紫外分光光度计(上海欣茂仪器有限公司)。
清洁级健康SD大鼠,雄性,体质量(250±20) g,由重庆医科大学实验动物中心提供,许可证号:SCXK-(渝)2014-0001。
1.3 AHDPs的制备[10-11]称取适量实验室自制的透明质酸-聚乙二醇hyaluronic acid-graft-poly(ethylene glycol),HA-g-PEG][12]和DCD,分别加Tris-HCl 缓冲液(pH 7.3)溶解并定容至100 mL。将适量的Asp溶于HA-g-PEG溶液后,于搅拌条件下缓慢加至DCD溶液中,搅拌,即得AHDPs。
1.4 AHDPs的性质考察 1.4.1 透射电镜下观察AHDPs的形态取AHDPs适量,用Tris-HCl缓冲液稀释适当倍数后在透射电镜下观察。
1.4.2 粒径和zeta电位的测定取AHDPs溶液适量,加入Tris-HCl缓冲液稀释一定的倍数后,使用粒度仪检测其粒径和zeta电位。
1.4.3 包封率的测定按照葡聚糖凝胶法[13]测定。方法如下:吸取0.5 mL的AHDPs溶液,上Sephadex G-200层析柱,Tris-HCl缓冲液(pH 8.5)以1 mL/min流速洗脱,分离AHDPs和Asp。收集AHDPs部分,取其中100 μL,加入乙醚破乳,再加入考马斯亮蓝,在595 nm波长处测定光密度(DAHDPs)值。以同法处理未过柱的AHDPs,测定光密度(D总)值。包封率(%) =(DAHDPs/D总)×100%,重复3次。
1.5 Asp活性的测定参照马斯本-利斯通法[14]测定Asp的活性。改进:实验前样品预热2 min。
1.6 AHDPs的药代动力学考察将12只雄性SD大鼠随机分为2组,分别尾静脉注射AHDPs和游离Asp,剂量均为2.0 kU/kg[15]。给药前禁食24 h。分别在给药后0.08、0.17、0.25、0.50、0.75、1、1.5、2、3、4、6、8、10、12、24、48 h眼底静脉丛取血。采血置于肝素化后的试管中,以597.7×g离心10 min 后分离血浆样品,按1.5项下方法进行活性测定,计算血浆样品中Asp的活性。根据所测结果绘制平均血药浓度-时间曲线,用DAS 2.1.1软件计算药代动力学参数。
1.7 生物等效性的评价将AHDPs和游离Asp的主要药代动力学参数AUC0-48 h、AUC0-∞及Cmax进行方差分析,再采用双向单侧t检验和90%置信区间考察;Tmax采用非参数统计Wilcoxon检验。评价AHDPs和游离Asp是否具有生物等效性。检验水准(α)为0.05。
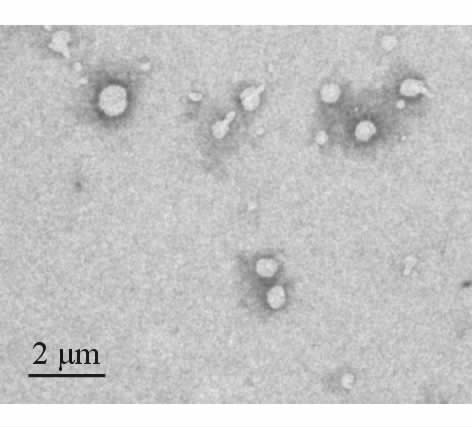
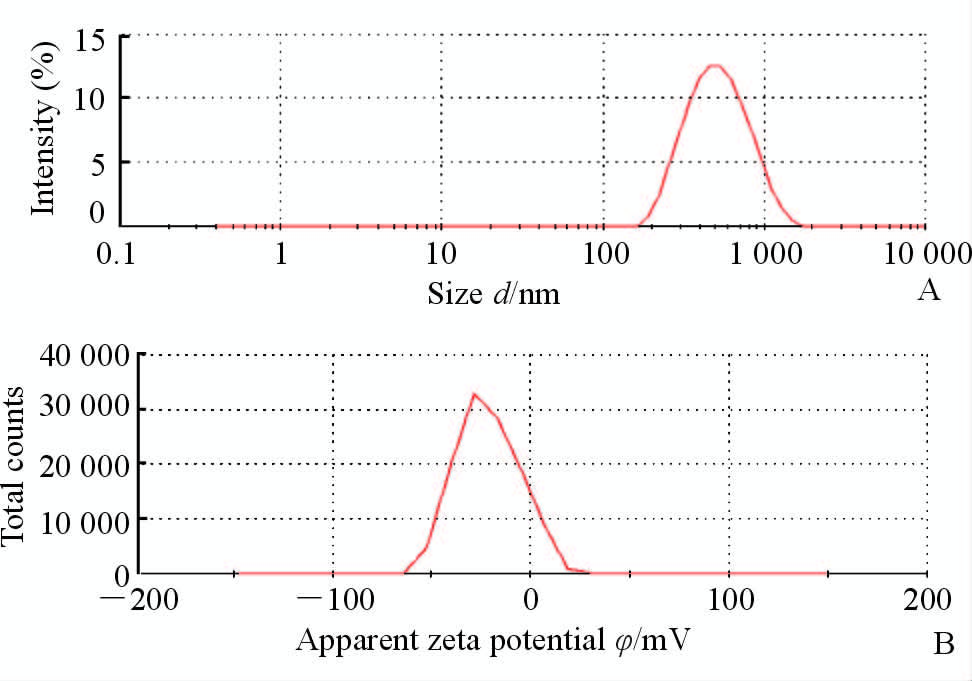
2 结 果 2.1 AHDPs的性质如图 1所示,透射电镜下观察到AHDPs呈均匀分布的圆形或椭圆形。其粒径和zeta电位测定结果见图 2,测得AHDPs的平均粒径为(439.63±8.49)nm(n=3),zeta电位为(-20.43±2.20)mV(n=3)。经计算,AHDPs的平均包封率为(55.75±4.11)%(n=3)。
|
图 1 AHDPs的透射电镜图 Fig 1 The transmission electron microscopy image of AHDPs |
|
图 2 AHDPs的粒径分布图(A)和zeta电位分布图(B) Fig 2 Size distribution profiles (A) and zeta potential profiles (B) of AHDPs |
2.2 药时曲线和药动学参数
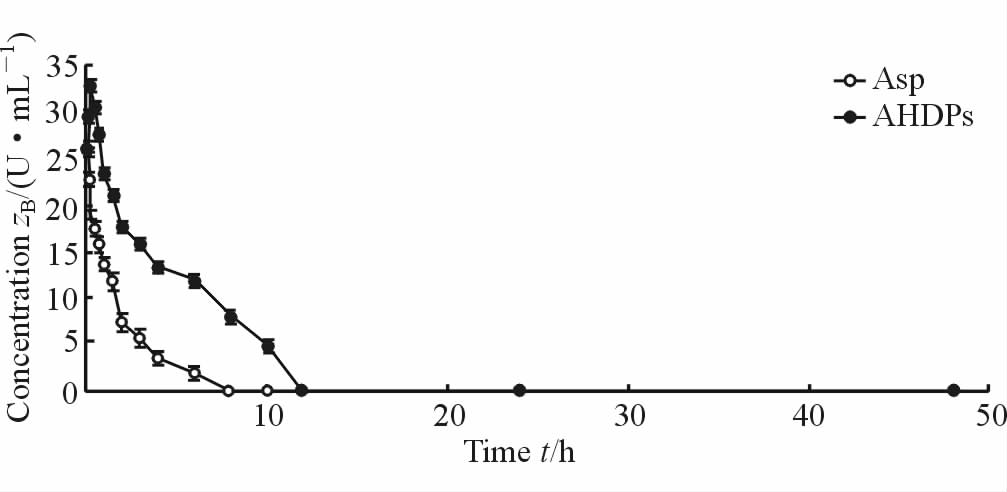
以时间为横坐标,平均血药浓度为纵坐标,分别建立静脉注射游离Asp和AHDPs后Asp在大鼠体内的药-时曲线(图 3)。游离Asp和AHDPs在SD大鼠体内的药代动力学参数见表 1。如图 3所示,大鼠静脉注射游离Asp后,Asp失活较快,6 h时几乎完全失活,8 h时完全失活。而AHDPs静注给药后,Asp失活较慢,6 h时仍有较高活性,12 h时才完全失活。结果表明,AHDPs延长了Asp在大鼠体内的滞留时间,提高了Asp在大鼠体内的稳定性。
|
图 3 大鼠静脉给予游离Asp和AHDPs后的平均血药浓度-时间曲线 Fig 3 Mean concentration-time curve of free Aspand AHDPs with intravenously administration |
|
|
表 1 SD大鼠静脉注射游离Asp和AHDPs后的主要药动学参数 Tab 1 Main pharmacoinetic parameters after injecting AHDPs and free Asp in rats |
由表 1可以看出,AHDPs的t1/2约为游离Asp的2.40倍,说明AHDPs消除较慢,能有效延长Asp在大鼠体内生物半衰期。AHDPs的AUC0-48 h约为游离Asp的3倍,说明AHDPs提高了游离Asp的生物利用度。
2.3 生物等效性评价结果经DAS 2.1.1软件处理得出AHDPs与游离Asp的AUC0-48 h的90%置信区间为76.9%~78.3%,生物等效性标准区间为80%~125%;AUC0-∞的90%置信区间为76.9%~78.3%,生物等效性标准区间为80%~125%;Cmax的90%置信区间为92.8%~94.4%,生物等效性标准区间为70%~143%。由实验结果可以看出,AHDPs与游离Asp的AUC0-48 h和AUC0-∞ 2个参数的90%置信区间均不在生物等效性标准区间范围内,因此AHDPs与游离Asp生物不等效。另外,对Tmax进行非参数法检验结果显示AHDPs和游离Asp的Tmax差异有统计学意义(P<0.05)。按照生物等效性的判定标准,AHDPs与游离Asp不具有生物等效性。
3 讨 论本实验采用自组装法成功制备了AHDPs,并对AHDPs在大鼠体内的药代动力学和生物等效性进行了研究,实验结果显示,将Asp制成AHDPs使Asp的静注生物利用度提高至约游离ASP的3.00倍,半衰期t1/2延长至约游离ASP的2.40倍。说明AHDPs提高了Asp在体内的生物利用度和稳定性,并延长了Asp在体内的生物半衰期。可能的原因是:(1) AHDPs具有生物相似性,能有效增加Asp的生物利用度;(2) AHDPs的空心纳米囊结构能阻挡抗蛋白水解酶及抗原与Asp的接触,在一定程度上能增强Asp的稳定性。AHDPs与游离Asp不具生物等效性,即AHDPs与Asp吸收速度的差别具有临床意义。
相对于Asp的其他制剂,AHDPs具有很大优势:(1)新颖性好。HA-g-PEG/DCD作为酶或药物的递送体系在国内外尚未见报道,用AHDPs作为Asp的递送体系具有明显的新颖性。(2)包封率高。AHDPs的包封率可达到(55.75±4.11)%(n=3)。(3)活性高。用AHDPs对Asp进行包封后,活性高于游离Asp。(4)生物半衰期长,生物利用度高。AHDPs延长了Asp在大鼠体内的生物半衰期,提高了Asp在大鼠体内的生物利用度,且AHDPs与游离Asp不具有生物等效性。
| [1] | VAN DEN BERG H. Asparaginase revisited. Leuk Lymphoma[J]. 2011, 52 :168–178 . |
| [2] | NARTA U K, KANWAR S S, AZMI W. Pharmacological and clinical evaluation of L-asparaginase in the treatment of leukemia. Crit Rev Oncol Hematol[J]. 2007, 61 :208–221 . |
| [3] | MOHAN-KUMARI H P, DHALE M A, AKHILENDER NAIDU K, VIJAYALAKSHMI G. Antioxidant effect of red mould rice in hypercholesterolemic Wistar male rats. Cell Biochem Funct[J]. 2011, 29 :597–602 . |
| [4] | 霍红光, 方波, 江体乾. 聚乙二醇改性壳聚糖固定化L-天门冬酰胺酶的工艺研究. 华东理工大学学报(自然科学版)[J]. 2005,31 :13–17. |
| [5] | 钱国强, 周菊岩, 马建标, 王道宾, 何炳林. 壳聚糖微球固定化L-天门冬酰胺酶研究. 高等学校化学学报[J]. 1996,17 :1147–1150. |
| [6] | ASHRAFI H, AMINI M, MOHAMMADI-SAMANI S, GHASEMI Y, AZADI A, TABANDEH M R, et al. Nanostructure L-asparaginase-fatty acid bioconjugate: synthesis, preformulation study and biological assessment. Int J Biol Macromol[J]. 2013, 62 :180–187 . |
| [7] | 张雨青, 相入丽, 阎海波, 陈晓晓. 丝素纳米颗粒的制备及应用于L-天冬酰胺酶的固定化. 高等学校化学学报[J]. 2008,29 :25–36. |
| [8] | 郭青龙, 陈真, 丁启龙. L-门冬酰胺酶前体脂质体对小鼠毒性及对实验性肿瘤作用. 中国药科大学学报[J]. 2001,32 :67–69. |
| [9] | 王弘, 吴梧桐, 顾学裘, 郭青龙. 重组L-门冬酰胺酶前体脂质体对急性淋巴白血病小鼠的治疗作用和毒性考察. 中国医院药学杂志[J]. 2001,21 :216–218. |
| [10] | HA W, MENG X W, LI Q, FAN M M, PENG S L, DING L S, et al. Self-assembly hollow nanosphere for enzyme encapsulation. Soft Matter[J]. 2010, 6 :1405–1408 . |
| [11] | LI Q, XIA B, BRANHAM M, HA W, WU H, PENG S L, et al. Self-assembly of carboxymethyl konjac glucomannan-g-poly(ethylene glycol) and α-cyclodextrin) to biocompatible hollow nanospheres for glucose oxidase encapsulation. Carbohyd Polym[J]. 2011, 86 :120–126 . |
| [12] | 谢江川, 何丹, 晏子俊, 周云莉, 张景勍. 载门冬酰胺酶的自组装聚乙二醇-透明质酸/二甲基-β-环糊精纳米粒体外稳定性的初步考察. 中国医药工业杂志[J]. 2015,46 :716–721. |
| [13] | TAN Q, ZHANG J, WANG N, LI X, XIONG H, TENG Y, et al. Uricase from Bacillus fastidious loaded in alkaline enzymosomes: enhanced biochemical and pharmacological characteristics in hypouricemic rats. Eur J Pharm Biopharm[J]. 2012, 82 :43–48 . |
| [14] | 施特尔马赫B.酶的测定方法[M].钱嘉渊 译.北京:中国轻工业出版社,1992:85-88. |
| [15] | KONECNA P, KLEJDUS B, HRSTKOVA H. Monitoring the asparaginase activity and asparagine levels in children with acute lymphoblastic leukaemia treated with different asparaginase preparations. Scripta Medica[J]. 2004, 77 :55–62 . |
 2016, Vol. 37
2016, Vol. 37


