2. 第二军医大学东方肝胆外科医院特殊二科, 上海 200438;
3. 第二军医大学东方肝胆外科医院肝外三科, 上海 200438
2. Department of Special Treatment Ⅱ, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
3. Department of Hepatic Surgery Ⅲ, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
原发性肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的致死性恶性肿瘤之一。2012年我国新增肝癌患者约40万例,死亡37万例,约占全球肝癌新发和死亡病例的50%以上[1],防治形势十分严峻。早期肝癌最常用的治疗方法为手术切除[1]。随着医疗技术水平的提高,肝癌切除患者的围术期死亡率已经大幅降低,但是术后肝功能不全(liver dysfunction,LD) 、肝衰竭(liver failure,LF)仍然是围术期最主要的死亡原因,围术期实行肝保护是降低LD和LF发生的重要措施[2-4]。然而目前肝保护的措施均非特异性,在保护肝细胞的同时也可能会保护残存在患者体内的肿瘤细胞,促进肝癌切除术后复发[5]。而术后复发是肝癌切除患者术后远期最主要的死亡原因[6],因此在使用肝保护措施时,不得不考虑其对患者术后远期预后的影响。
肝再生是肝保护的重要措施之一,是肝损伤和肝切除术后肝功能恢复的基础[7]。抑制术后肝再生,将导致患者肝功能恢复缓慢,LD、LF发生率增高,死亡率增加[3]。目前有多项研究表明血小板(platelet,PLT)和PLT源性5-羟色胺(5-hydroxytryptamine,5-HT)是促进小鼠以及人肝再生的重要影响因素[3, 7-8]。抗PLT、5-HT治疗及PLT的改变均可影响肝再生[4, 8]。然而PLT及5-HT不但可促进肝细胞生长,也有研究表明其还可促进肝癌细胞生长,而抗肝癌细胞凋亡是HCC存活的重要因素[9]。由于PLT和PLT源性5-HT促进肝再生的同时也会促进肝癌细胞生长,而[BP)]目前关于PLT及5-HT是否影响肝癌切除患者术后肝功能以及术后复发尚不清楚,本研究采用不对患者的PLT、5-HT进行实验性干预的前瞻性队列研究,观察了术前PLT及5-HT水平对肝癌切除患者术后肝功能、无瘤生存(recurrence-free survival,RFS) 时间、总生存 (overall survival,OS) 时间等预后指标的影响。
1 资料和方法 1.1 研究对象采用前瞻性队列研究设计,连续入组第二军医大学东方肝胆外科医院2009年1月至12月行手术切除的HCC患者。入选标准:(1)符合Milan标准[10]的原发性肝癌患者,患者单个肿瘤直径≤5 cm,或多发的肿瘤<3个且最大直径≤3 cm,无大血管侵犯现象,无淋巴结或肝外转移现象;(2) T1-2N0M0期;(3)肝功能Child-Pugh评分A级;(4)手术切除标本肉眼及病理切缘阴性。排除标准:(1)术前肝功能异常;(2)合并梗阻性黄疸;(3)术前合并导致凝血功能异常的疾病;(4)合并其他恶性肿瘤;(5)年龄超过75岁。本研究取得第二军医大学东方肝胆外科医院医学伦理委员会批准。
1.2 一般资料采集根据文献[11]将17个可能影响预后的因素纳入本研究,包括性别、年龄、肝硬化、HBsAg(阳性或阴性)、血清甲胎蛋白(AFP,>20或≤20 ng/mL)、PLT、肿瘤数量、肿瘤侵入微血管、肿瘤分化、肿瘤包膜、手术部位边缘长度(>1或≤1 cm)、TNM分期、术中失血量、术中输血、手术切除范围、脾切除、术前血清5-HT浓度。从第二军医大学东方肝胆外科医院信息库和病案室获取患者住院信息,负责收集整理资料的研究者不参与患者的各项检查治疗。血清5-HT的检测:术前抽取患者血液样本于普通试管中,常温下放置30 min,离心收集上清液-80℃保存。按ELISA试剂盒(Sigma)说明书进行操作,测定血清5-HT浓度。根据Starlinger等[3]的研究将73.0 ng/mL作为血清5-HT高、低浓度的分界值,将患者分为低5-HT组和5-HT正常组。
1.3 术后随访患者术后第1年每2~3个月复查随访1次,后每3~6个月复查随访1次。每次复查AFP定量和肝脏超声,检查皆由与本研究无关的医生独立完成。如果怀疑复发,立即行CT或MRI以进一步明确。复发患者将进行相关治疗。随访截止时间为术后60个月。
1.4 相关定义肝切除范围:肝切除范围<3段定义为局部切除,切除范围≥3段为大部切除[12]。术后LD:术后1周内出现凝血酶原活动度<50%和血清胆红素(serum bilirubin,SB)>50 μmol/L视为LD或术后肝功能恢复延迟[12]。LF是指由多种因素引起的严重肝脏损害,导致肝脏合成、解毒、排泄和生物转化等功能发生严重障碍或失代偿,出现以凝血机制障碍和黄疸、肝性脑病、腹水等为主要表现的一组临床症候群[13]。OS时间:从手术当天到患者发生疾病相关死亡或者失访的时间;疾病相关死亡:患者死于肿瘤复发、复发治疗过程的并发症。其他原因的死亡记为删失病例。RFS时间:指患者手术当天到证实肿瘤复发,或非复发肿瘤患者从手术当天到失访之间的时间。
1.5 统计学处理采用SPSS 19.0统计软件进行统计分析。定性资料以百分率表示,采用χ2检验比较组间差异;计量资料以x±s或中位数与95%可信区间(confidence interval,CI)表示,相关参数比较用t检验、方差分析或Wilcoxon秩和检验。用Kaplan-Meier法绘制OS和RFS时间生存曲线,log-rank法比较组间差异。用Cox比例风险回归模型分析影响术后生存的相关危险因素。LD相关因素分析采用单因素和多因素logistic回归分析,首先将影响预后的各因素进行单因素分析,P<0.5的因素纳入多因素分析中进行逐步回归分析,将P<0.05的因素纳入下一步回归分析。检验水准(α)为0.05。
2 结 果 2.1 患者基本情况符合纳入标准的患者共297例,其中男性259例(87.21%),女性38例(12.79%)。年龄25~75岁,中位年龄55岁。发生术后LD的患者 28例(9.43%);围术期死亡3例(1.01%),死亡原因均为术后LF。术后5年内复发126例(42.42%),死于肝癌79例(26.60%),失访或死于其他原因13例(4.28%)。术后1、3、5年OS率分别为94.61%(281/297)、75.08%(223/297)、69.02%(205/297);1、3、5年RFS率分别为84.13%(249/297)、63.49%(189/297)、53.57%(159/297)。
术前患者血清5-HT浓度与术前PLT计数呈正相关(r=0.712,P<0.001)。根据术前PLT计数将患者分为低PLT组(<100×109/L)和PLT 正常组(≥100×109/L),两组间基线资料比较见表 1。低PLT组患者的肝硬化比例(P<0.001)、HbsAg阳性率(P=0.021)、脾切除率(P<0.001)均高于PLT正常组,血清5-HT浓度(P<0.001)低于PLT 正常组,其他因素差异无统计学意义。
|
|
表 1 患者一般资料及两组组间基线资料比较 Tab 1 Comparison of the base line data of participants between the two groups |
2.2 术前和术后LD对患者PLT的影响
术后未发生LD患者PLT与术前相比下降,第5天时有所恢复;且患者术前、术后PLT差异无统计学意义。术后发生LD患者术后PLT与术前比较降低(P<0.01),第5天仍未恢复正常;且术前、术后PLT均低于肝功能正常患者(P<0.01)。见图 1。

|
图 1 术前和术后LD对PLT的影响 Fig 1 Influence of pre-operation and post-operation LD on the level of PLT |
2.3 术后LD相关危险因素分析
经单因素和多因素分析后发现,肝硬化、手术切缘、术前PLT计数和术前5-HT浓度是术后发生LD的独立危险因素(表 2)。
|
|
表 2 LD相关因素的单因素分析和多因素分析 Tab 2 Univariate analysis and multivariate analysis of risk factors for LD |
2.4 RFS和OS相关危险因素
单因素分析(表 3)和多因素分析(表 4)结果示,RFS的独立危险因素为肿瘤分化、肿瘤TNM分期、肿瘤侵犯微血管和HBsAg阳性或阴性;OS时间的独立危险因素有肝硬化、肿瘤分化、肿瘤TNM分期、肿瘤侵犯微血管、术前PLT计数和术前5-HT浓度。可见术前PLT计数和术前5-HT浓度是OS时间的独立危险因素,但不是RFS时间的独立危险因素。
|
|
表 3 RFS和OS相关因素的单因素分析 Tab 3 Univariate analysis of risk factors for OS time and RFS time |
|
|
表 4 RFS和OS相关因素的多因素分析 Tab 4 Multivariate analysis of risk factors for OS time and RFS time |
2.5 术前PLT计数、5-HT浓度对RFS和OS的影响
由图 2可见,低PLT组1、3、5年OS率分别为86.30%、61.64%、50.68%,PLT 正常组分别为95.98%、81.69%、75.00%;低PLT组1、3、5年RFS率分别为72.60%、53.42%、47.95%,PLT正常组分别为78.57%、63.39%、56.70%。术前低PLT计数的患者的OS率低于术前PLT正常患者(P=0.012),但术前PLT水平对RFS率的影响无统计学意义(P=0.687)。

|
图 2 PLT 对RFS和OS的影响 Fig 2 The influence of PLT on RFS and OS |
由图 3可见,术前低5-HT组1、3、5年OS率分别为88.54%、72.92%、58.33%,5-HT 正常组分别为96.02%、80.10%、74.13%;低5-HT组1、3、5年RFS率分别为76.04%、59.37%、50.00%,5-HT正常组分别为74.40%、60.70%、56.72%。术前血清5-HT浓度低的患者的OS率低于术前血清5-HT正常患者(P=0.004),但术前5-HT浓度对RFS的影响组间差异无统计学意义(P=0.562)。
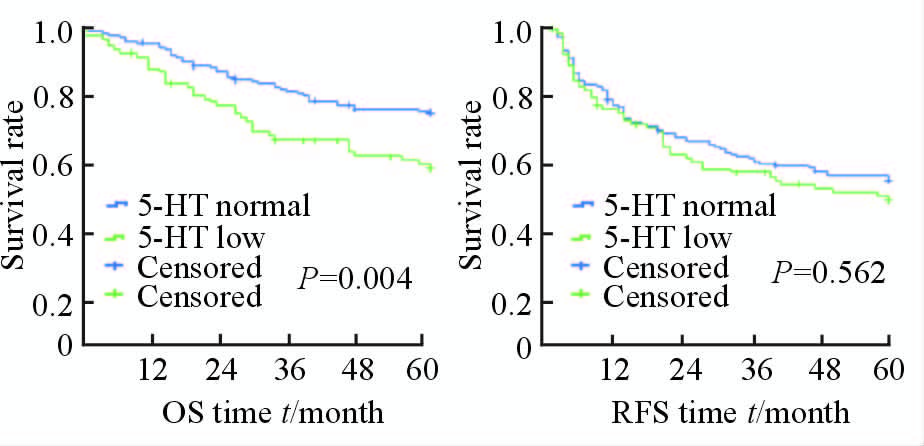
|
图 3 5-HT对RFS和OS的影响 Fig 3 The influence of 5-HT on RFS and OS |
3 讨 论
PLT是储存和运输5-HT的重要物质,其中PLT储存转运的5-HT占体内5-HT总和的8%(体内大部分5-HT作为神经递质存在于神经系统),占外周性5-HT的95%,但PLT并不能合成5-HT[7]。外周性5-HT由小肠嗜铬细胞合成,PLT摄取血液循环中的5-HT并储存于α颗粒中。在PLT被激活时,其释放α颗粒中的5-HT和其他物质,从而发挥作用[7]。本研究中5-HT与PLT呈正相关,说明患者的PLT变化可间接反映5-HT浓度变化。多项研究表明肝细胞、肝癌细胞均表达5-HT2B受体,5-HT是促进肝细胞和肝癌细胞生长的重要因子,抑制5-HT2B受体、改变PLT计数、抗PLT治疗等都能影响肝细胞和肝癌细胞生长[7, 9]。本研究也证实术前PLT、5-HT是术后LD的独立危险因素,术前低PLT、低5-HT预示术后发生LD风险较高;且围术期死亡的3例患者皆因LF而发生死亡,这3例患者术前PLT计数和5-HT浓度均低于正常值,表明术前低PLT、5-HT患者围术期的预后较差。以上进一步证实了PLT、5-HT对肝癌切除术后肝再生具有重要作用。
恶性肿瘤切除术后患者体内可能存在微小残留病灶(minimal residual disease,MRD),而MRD是肿瘤复发的基础,促进MRD生长能促使肿瘤复发[5]。由于PLT和5-HT能促进肝癌细胞生长,故PLT和5-HT可能会促进肝癌切除术后患者体内残余的肝癌细胞生长,导致肝癌的复发。然而本研究发现PLT和5-HT不是肝癌切除术后RFS的危险因素,不影响肝癌切除术后复发;反而低PLT和5-HT患者术后5年OS率较低,是OS的独立危险因素。PLT和5-HT对肝癌患者RFS无影响可能与肝癌恶性程度较高有关,而RFS主要受肿瘤分化、TNM分期以及微血管侵犯等因素的影响,且目前广泛认为肝癌术后抗复发治疗手段依然缺乏[6]。
综上所述,术前低PLT、5-HT是肝癌切除术后LD发生的独立危险因素,但PLT和5-HT不影响术后复发。提高PLT和PLT源性5-HT水平有可能改善术前低PLT和PLT源性5-HT肝癌切除患者的预后。但本研究为前瞻性队列研究,病例数不够多,也未检测患者术后5-HT浓度以检验术后5-HT浓度的变化对肝癌切除术患者预后的影响,相关结论仍需随机对照研究进一步验证。
| [1] | SIEGEL R, MA J, ZOU Z, JEMAL A. Cancer statistics, 2014. CA Cancer J Clin[J]. 2014, 64 :9–29 . |
| [2] | KAUFFMANN R, FONG Y. Post-hepatectomy liver failure. Hepatobiliary Surg Nutr[J]. 2014, 3 :238–246 . |
| [3] | STARLINGER P, ASSINGER A, HAEGELE S, WANEK D, ZIKELI S, SCHAUER D, et al. Evidence for serotonin as a relevant inducer of liver regeneration after liver resection in humans. Hepatology[J]. 2014, 6 :257–266 . |
| [4] | BALZAN S, BELGHITI J, FARGES O, OGATA S, SAUVANET A, DELEFOSSE D, et al. The "50-50 criteria" on postoperative day 5: an accurate predictor of liver failure and death after hepatectomy. Ann Surg[J]. 2005, 242 :824–829 . |
| [5] | SNYDER G L, GREENBERG S. Effect of anaesthetic technique and other perioperative factors on cancer recurrence. Br J Anaesth[J]. 2010, 105 :106–115 . |
| [6] | BRUIX J, GORES G J, MAZZAFERRO V. Hepatocellular carcinoma: clinical frontiers and perspectives. Gut[J]. 2014, 63 :844–855 . |
| [7] | LESURTEL M, GRAF R, ALEIL B, WALTHER D J, TIAN Y, JOCHUM W, et al. Platelet-derived serotonin mediates liver regeneration. Science[J]. 2006, 312 :104–107 . |
| [8] | NOCITO A, GEORGIEV P, DAHM F, JOCHUM W, BADER M, GRAF R, et al. Platelets and platelet-derived serotonin promote tissue repair after normothermic hepatic ischemia in mice. Hepatology[J]. 2007, 45 :369–376 . |
| [9] | SOLL C, JANG J H, RIENER M O, MORITZ W, WILD P J, GRAF R, et al. Serotonin promotes tumor growth in human hepatocellular cancer. Hepatology[J]. 2010, 51 :1244–1254 . |
| [10] | MAZZAFERRO V, LLOVET J M, MICELI R, BHOORI S, SCHIAVO M, MARIANI L, et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: a retrospective, exploratory analysis. Lancet Oncol[J]. 2009, 10 :35–43 . |
| [11] | YANG T, LU J H, ZHAI J, LIN C, YANG G S, ZHAO R H, et al. High viral load is associated with poor overall and recurrence-free survival of hepatitis B virus-related hepatocellular carcinoma after curative resection: a prospective cohort study. Eur J Surg Oncol[J]. 2012, 38 :683–691 . |
| [12] | STRASBERG S M. Nomenclature of hepatic anatomy and resections: a review of the Brisbane 2000 system. J Hepatobiliary Pancreat Surg[J]. 2005, 12 :351–355 . |
| [13] | SCHRECKENBACH T, LIESE J, BECHSTEIN W O, MOENCH C. Posthepatectomy liver failure. Dig Surg[J]. 2012, 29 :79–85 . |
 2016, Vol. 37
2016, Vol. 37


