2. 贵州省人民医院心内科, 贵阳 550002
2. Department of Cardiology, Guizhou Provincial People's Hospital, Guiyang 550002, Guizhou, China
近年来,国外一些临床试验已经证实在透视指导下以导管为基础的去肾交感神经术能有效降低难治性高血压患者的血压[1-5]。然而,仍有10%接受去肾交感神经术的患者没有反应,更多患者仅有部分血压下降[3]。传统的二维透视法指导去肾交感神经术需要应用对比剂以识别肾动脉在腹主动脉内的位置,并在每次消融前确认导管头端的位置,但由于存在对比剂肾病的潜在风险,导致肾小球滤过率≤45 mL/min的患者被排除在所有主要的临床试验之外。高血压与肾脏疾病存在伴发关系,高血压病可引起肾脏损害,后者又使血压进一步升高,并难以控制[6]。此外,新近研究结果公布,Symplicity消融导管系统治疗难治性高血压患者的安全性良好,但未达到预期的主要临床终点[7]。该结果遭到质疑,而支持者认为消融方法不当导致未能完全去除肾交感神经可能是产生阴性结果的原因之一[8-9]。为此,有必要寻求新的治疗方法来指导去肾交感神经术。国外研究用EnSite-NavX建立肾动脉三维立体模型,并指导去肾交感神经术治疗难治性高血压,结果显示该方法安全有效,且可显著减少X线曝光时间及造影剂用量[10-11];目前国内未见相关报道。本研究拟探索在EnSite-NavX系统指导下去肾交感神经术的安全性及有效性。
1 材料和方法 1.1 实验动物健康广西巴马小型猪6只,体质量(24.90±1.79) kg,雌雄不限,由海军动物医学研究所提供(许可证号:2002-044)。
1.2 实验药品及器械氯胺酮注射液(江苏恒瑞医药股份有限公司),丙泊酚注射液(阿斯利康制药有限公司),肝素钠注射液(上海先锋药业公司),猪去甲肾上腺素(NE)ELISA试剂盒(上海泛柯生物科技有限公司)。介入手术包(第二军医大学长海医院消毒供应室),0.032 英寸(0.81 mm)导引钢丝(圣犹达公司),7F动脉鞘、6F猪尾巴导管、Lasso环状标测导管、7F心脏电生理射频消融导管(Cordis公司),碘海醇注射液对比剂[通用电气药业(上海)有限公司],数字减影血管造影(DSA)机(Philips公司),心电图机(上海光电医用电子仪器有限公司),EnSite电生理标测仪(圣犹达公司),BiosenseWebster射频消融仪(Cordis公司)。
1.3 EnSite-NavX指导下重建腹主动脉、双肾动脉的三维立体模型及一侧肾动脉的消融先用氯胺酮10 mg/kg诱导麻醉,称体质量,备皮,以特制的V型固定架将实验猪仰卧固定后置于DSA机手术操作台上,消毒、铺巾。术中给予丙泊酚0.2 mg/(kg·min)维持麻醉并持续行心电监护和氧饱合度监测。左、右腹股沟中点外下方切开皮肤、钝性分离皮下组织及肌肉,暴露右侧股动脉及左股静脉,直视下应用Seldinger法分别穿刺右股动脉及左股静脉。穿刺成功后于股动脉置入8F Mullin鞘,股静脉置入6F防漏鞘管,经鞘管注射普通肝素(100 U/kg)及生理盐水。经股动脉鞘管插入6F猪尾巴导管至腹主动脉约第一腰椎水平,外接高压注射器于后前位造影(造影剂为碘海醇注射液15 mL,压力5 516 kPa,速度15 mL/s),然后拔出造影导管。将3对NavX电极片贴于实验猪体表前胸(胸前贴片右侧的缺口对应胸导联V1的位置)、后背、左腋、右腋、后颈、左右两侧大腿的中间。连接普通电生理消融导管和NavX体表电极。同时将EnSite系统与射频消融仪相并联。插入6F环状标测电极至腹主动脉,上下来回移动电极导管,重建腹主动脉三维解剖图像。然后经Mullin鞘导入7F消融电极导管至肾动脉,改变消融导管头端的方向,来回移动电极导管,构建一侧肾动脉的三维几何模型。经股静脉鞘插入环状标测电极至下腔静脉近肾静脉口处作为参考电极,在Ensite系统导航下引导7F消融导管在随机选择的一侧肾动脉主干内由远及近行螺旋状消融6个点[12],最靠近肾动脉开口的消融点位于肾动脉上缘。术中能量设置:预设温度45℃,能量输出12 W,消融时间120 s。采用相同的方法构建对侧肾动脉的三维几何模型,并取点标记但不消融做对照。拔出射频消融导管重复肾动脉造影。术后拔除鞘管,结扎股动静脉以止血,缝合皮下组织及皮肤。具体操作流程如下:放置体表电极—导入电极导管—建立血管立体模型—消融一侧肾动脉。
1.4 术后随访及肾组织NE含量的测定术后所有实验猪饲养6个月后,重复肾动脉造影,观察肾动脉有无狭窄。随后处死动物,取出双侧肾脏,经匀浆离心后,ELISA法测定双侧肾组织中的NE含量。
1.5 肾交感神经毁损情况观察将实验猪处死后,取出消融侧肾动脉,切片H-E染色,光镜下观察肾交感神经的组织病理变化。
1.6 统计学处理采用SPSS 17.0软件完成统计学分析,计量资料用x±s表示,消融侧和对照侧数据的比较采用配对t检验。检验水准(α)为0.05。
2 结果6只实验小型猪均顺利完成手术,其中1只右侧股动脉穿刺处出现皮下血肿,经常规处理后恢复。术后即刻肾动脉造影未见肾动脉血栓形成、血管破裂及夹层。术后6个月肾动脉造影未见迟发性肾动脉狭窄。
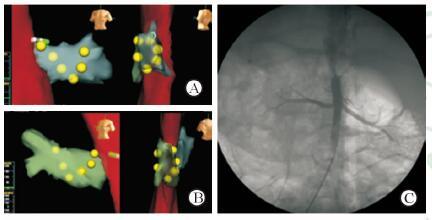
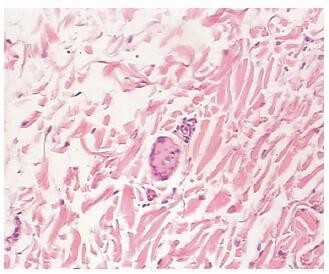
EnSite-NavX 三维标测系统可构建出腹主动脉及肾动脉的三维立体几何图像,无需X线透视或造影指导进行导管在肾动脉主干内壁的定位、导航和标记(图 1)。消融侧肾组织NE含量为(170.13±52.60) ng/g,低于对照侧(429.86±131.43) ng/g,差异有统计学意义(P<0.05)。消融侧肾动脉H-E染色结果显示肾交感神经未见完整的神经外膜,轴突减少,见图 2。
|
图 1 腹主动脉及肾动脉三维立体几何图(A、B)和肾动脉造影图(C) Fig 1 3D model of abdominal aorta and renal artery registered with EnSite-NavX three-dimensional mapping system (A,B) and renal artery angiogram (C) |
|
图 2 H-E染色示消融侧肾交感神经 Fig 2 Haematoxylin-Eosin staining showed the renal sympathetic nerve of the ablation side |
3 讨论
EnSite-NavX三维标测系统是由多个电极形成的三维立体空间,在这个电场内能够保证连续不间断的采点,每秒定位达93次,精确度在0.6 mm之内[13]。通过在腹主动脉内上下来回移动导管,可快速地构建腹主动脉的三维立体模型。当电生理射频消融导管插入肾动脉后,通过调整导管头端的位置缓慢后撤导管和来回移动导管建立肾动脉的三维立体模型。所构模型相似,但重构模型还有些变形。由于消融导管从腹主动脉进入肾动脉建模时,往往是紧贴肾动脉开口上缘进入肾动脉,导致肾动脉开口处上缘部分结构显示清楚,且与腹主动脉的连续性较好;而下缘部分显示较差,甚至靠近开口部分出现结构缺失。对部分开口向下起源于腹主动脉的肾动脉,由于受到硬质导管头端弯曲后张力的影响,可能导致血管上翘,使重建的肾动脉与腹主动脉的夹角变小。正常肾动脉横切面多为圆形,但本研究重建的肾动脉切面呈椭圆形,可能与单极心脏电生理射频消融导管易在上下方向弯曲调整、张力过大导致血管发生过度牵拉有关;还可能与操作者缺乏经验、在肾动脉内采点不够均匀、未完全覆盖肾动脉腔有关。此外,呼吸运动也可能有影响。
肾动脉三维立体模型重建完成后,一旦肾动脉开口和分叉点被标记在NavX上,两点之间的消融位点将易于定位,每一个消融点都可被标记在NavX系统上,当导管回撤、旋转时,允许消融点沿着肾动脉呈螺旋形分布。这样既可保证各消融点不在肾动脉的同一横截面上,降低肾动脉狭窄发生的可能;又可保证对肾动脉周围交感神经损伤的圆周性,从而更完全地阻断肾交感神经。有研究证实肾实质NE水平可反映去肾交感神经术的效果,肾交感神经毁损越重,肾实质NE水平下降越明显[14]。本研究显示消融侧肾实质NE水平低于未消融侧,且病理检查发现消融侧肾交感神经未见完整的神经外膜、轴突减少,提示去肾交感神经术有效。
已有研究证实经NavX建立肾动脉三维立体模型指导去肾交感神经术的安全性,在去肾交感神经术中应用NavX可显著降低造影剂用量和辐射剂量[11]。由于本研究是以同一对象的对称部位作为对照,无法比较造影剂用量及辐射剂量。但本研究发现,大多数造影剂通常用于手术的开始阶段,为了识别肾动脉在腹腔内的位置,需要进行主动脉造影;随后引导和确认导管进入肾动脉时需局部注射造影剂;最后为明确有无肾动脉血管急性并发症,消融完成后需即刻重复主动脉造影。而本研究在肾动脉建模完成后,电生理射频消融导管的定位及消融均可在EnSite-NavX三维标测系统的指导下完成,无需通过透视或推注造影剂来确认导管头端的位置。Hering等[15]对15例伴有3~4期慢性肾脏病的高血压患者进行去肾交感神经术的研究结果显示,应用二氧化碳造影,造影剂用量显著减少。然而,在HTN-1和HTN-2试验[2-3]中并未报道造影剂的用量,也未使用三维系统指导肾动脉去肾交感神经术。Lewalter和Brodherr[10]首先报道用三维非透视系统指导冷盐水灌注导管进行去肾交感神经术,仅用15 mL造影剂即完成了1例伴有肾功能不全患者的去肾交感神经术,术后肾功能没有恶化,该方法对伴有肾功能不全的药物难治性高血压患者可能特别有益。本研究术后即刻及术后6个月肾动脉造影均未见肾动脉狭窄等并发症。
本研究存在以下局限性:首先只做了肾动脉的单侧消融,没有监测动脉血压的变化;其次仅观察了肾组织NE含量变化,还不足以说明会引起明显的血压下降,需要进一步临床研究加以验证。
总之,EnSite-NavX三维标测系统指导下能清楚建立腹主动脉及肾动脉的三维立体模型,并且在NavX导航下,无需透视或肾动脉造影即可完成肾动脉去交感神经术,能安全、有效去肾交感神经。
| [1] | KRUM H, SCHLAICH M P, SOBOTKA P A, BÖHM M, MAHFOUD F, ROCHA-SINGH K, et al. Percutaneous renal denervation in patients with treatment-resistant hypertension: final 3-year report of the Symplicity HTN-1 Study. Lancet[J]. 2014, 383 :622–629 . |
| [2] | KRUM H, SCHLAICH M P, WHITBOURN R, SOBOTKA P A, SADOWSKI J, BARTUS K, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study. Lancet[J]. 2009, 373 :1275–1281 . |
| [3] | Symplicity HTN-2 Investigators; ESLER M D, KRUM H, SOBOTKA P A, SCHLAICH M P, SCHMIEDER R E, BÖHM M, et al. Renal sympathetic denervation in patients with treatment-resistant hypertension (the Symplicity HTN-2 Trial): a randomised controlled trial. Lancet[J]. 2010, 376 :1903–1909 . |
| [4] | TSIOUFIS C, DIMITRIADIS K, TSIACHRIS D, THOMOPOULOS C, KASIAKOGIAS A, KORDALIS A, et al. Catheter-based renal sympathetic denervation for the treatment of resistant hypertension: first experience in Greece with significant ambulatory blood pressure reduction. Hellenic J Cardiol[J]. 2012, 53 :237–241 . |
| [5] | VOSKUIL M, VERLOOP W L, BLANKESTIJN P J, AGOSTONI P, STELLA P R, DOEVENDANS P A. Percutaneous renal denervation for the treatment of resistant essential hypertension; the first Dutch experience. Neth Heart J[J]. 2011, 19 :319–323 . |
| [6] | 中国高血压防治指南修订委员会. 中国高血压防治指南2010. 中华心血管病杂志[J]. 2011,39 :579–615. |
| [7] | BHATT D L, KANDZARI D E, O'NEILL W W, D'AGOSTINO R, FLACK J M, KATZEN B T, et al. Symplicity HTN-3 Investigators. A controlled trial of renal denervation for resistant hypertension. N Engl J Med[J]. 2014, 370 :1393–1401 . |
| [8] | ESLER M. Illusions of truths in the Symplicity HTN-3 Trial: generic design strengths but neuroscience failings. J Am Soc Hypertens[J]. 2014, 8 :593–598 . |
| [9] | EPSTEIN M, DE MARCHENA E. Is the failure of Symplicity HTN-3 trial to meet its efficacy endpoint the "end of the road" for renal denervation?. J Am Soc Hypertens[J]. 2015, 9 :140–149 . |
| [10] | LEWALTER T, BRODHERR T. Three-dimensional guided renal denervation to treat drug-resistant arterial hypertension in a patient with renal insufficiency. Hypertension[J]. 2012, 60 :e33. |
| [11] | ZAMAN S, POULIOPOULOS J, AL RAISI S, SULLIVAN J, THIAGALINGAM A, SWINNEN J, et al. Novel use of NavX three-dimensional mapping to guide renal artery denervation. EuroIntervention[J]. 2013, 9 :687–693 . |
| [12] | RIPPY M K, ZARINS D, BARMAN N C, WU A, DUNCAN K L, ZARINS C K. Catheter-based renal sympathetic denervation: chronic preclinical evidence for renal artery safety. Clin Res Cardiol[J]. 2011, 100 :1095–1101 . |
| [13] | 陈红武, 杨兵, 陈明龙. EnSite-NavX三维标测系统及临床应用. 中国心脏起搏与心电生理杂志[J]. 2008,22 :301–304. |
| [14] | FISCHELL T A, VEGA F, RAJU N, JOHNSON E T, KENT D J, RAGLAND R R, et al. Ethanol-mediated perivascular renal sympathetic denervation: preclinical validation of safety and efficacy in a porcine model. EuroIntervention[J]. 2013, 9 :140–147 . |
| [15] | HERING D, MAHFOUD F, WALTON A S, KRUM H, LAMBERT G W, LAMBERT E A, et al. Renal denervation in moderate to severe CKD. J Am Soc Nephrol[J]. 2012, 23 :1250–1257 . |
 2016, Vol. 37
2016, Vol. 37


