2. 新疆维吾尔自治区塔城地区额敏县人民医院, 塔城 834700
2. Department of Obstetrics and Gynecology, Emin County People's Hospital, Tacheng 834700, Xinjiang Uygur Autonomous Region, China
卵巢上皮性癌(简称卵巢癌)是一种常见的妇科恶性肿瘤,其恶性程度高,极易发生远处转移,约70%的患者发现时已为晚期[1]。卵巢癌占卵巢恶性肿瘤的85%~90%,早期发现、早期治疗的卵巢癌患者的5年生存率高于晚期患者[2-4]。因此,对卵巢癌患者进行早期诊断及治疗并有效控制卵巢癌的增殖和转移一直是临床的重中之重。现已证实趋化因子及其受体参与了多种恶性肿瘤的发生与发展[5]。多项研究表明,作为趋化因子受体的一种,CXC趋化因子受体7型(CXCR7)对卵巢癌的发生与发展存在促进作用[6-8],但多为细胞实验,关于CXCR7在卵巢癌组织中的表达情况及其与患者临床预后的关系鲜有报道。本研究通过检测CXCR7蛋白在正常卵巢组织、良性卵巢肿瘤及卵巢癌组织中的表达情况,分析CXCR7蛋白表达与卵巢癌患者临床病理特征及预后的关系,进一步明确CXCR7在卵巢癌患者中的临床意义。
1 资料和方法 1.1 研究对象选取2007年1月至2010年6月在第二军医大学长海医院妇产科行手术治疗的卵巢癌患者的卵巢癌组织57例,同期因卵巢良性上皮性肿瘤行手术治疗患者的良性上皮性肿瘤组织15例。另取因宫颈癌行双侧附件切除患者的正常卵巢组织15例作为对照。收集所有卵巢癌患者的临床及病理资料。参照2003年WHO推荐的组织学分级标准[9]及2014年国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)制定的FIGO临床分期[10]进行病理学分级和临床分期。
1.2 一般情况卵巢癌患者共57例,均为女性,平均年龄为(64.01±10.64)岁。肿瘤直径 <5 cm 13例,≥5 cm 44例。所有患者术前均检查肿瘤指标CA125,其中CA125正常(<35 U/mL)者11例,异常(≥35 U/mL)者46例。按肿瘤分化程度分级,低分化18例,中分化22例,高分化17例。FIGO分期Ⅰ期5例,Ⅱ期12例,Ⅲ期37例,Ⅳ期3例。
1.3 术后随访对所有卵巢癌患者进行随访。随访截止时间为2015年6月30日,其中失访病例2例(3.5%),平均随访时间为(43.0±19.8)个月。中位生存期为42个月,最短生存时间为6个月,最长生存时间为74个月。无瘤生存时间定义为手术日期至转移、复发或死亡日期之间的间隔时间。
1.4 免疫组化SP法检测CXCR7蛋白的表达免疫组化SP试剂盒购自福州迈新生物技术开发有限公司。所获标本均经10%甲醛溶液固定,常规石蜡包埋,连续切片,厚度为4 μm。切片经二甲苯脱蜡、梯度乙醇水化、PBS清洗后,置于免疫组化盒中,加入60%体积的0.01 mol/L柠檬酸盐缓冲液,微波修复抗原。PBS洗3次,每次3 min;室温下过氧化物阻断酶阻断20 min(湿盒)。PBS洗3次,每次3 min;加入血清封闭20 min;甩掉血清,滴加小鼠抗人CXCR7单克隆抗体(1∶100稀释,Abcam公司),4℃过夜;PBS洗3次,每次2 min;增强剂室温湿盒孵育20 min;PBS洗3次,每次3 min;加入二抗孵育60 min;PBS洗3次,每次3 min;DAB染色孵育切片5 min;水洗,PBS洗3次,每次3 min;苏木素染核5 min;水洗,盐酸乙醇分化,PBS返蓝,脱水、透明后用中性树胶封片剂封片。用已知的阳性切片作为阳性对照,PBS代替一抗作为阴性对照。
1.5 结果判定由2位病理科技术人员双盲独立阅片,每例选取10个不同视野根据IRS系统结合染色强度和染色细胞百分比进行评分,结果判定如下:CXCR7蛋白阳性细胞表达定位于细胞质,偶见细胞膜阳性表达,以肿瘤细胞的细胞质和(或)细胞膜出现棕黄色颗粒为阳性细胞。按切片中着色强度和阳性细胞比例分别进行记分。染色强度:基本不着色为0分,着色呈淡黄色为1分,着色呈黄色为2分,着色呈棕褐色为3分;染色阳性细胞百分比:无着色阳性细胞为0分,着色阳性细胞占计数细胞百分比≤10%为1分,11%~49%为2分,≥50%为3分。将胞质染色强度分级与染色细胞百分比分级相乘,乘积≥4者为表达阳性,0~3为表达阴性[11]。
1.6 统计学处理采用SPSS 18.0统计学软件分析临床资料,并采用χ2检验统计CXCR7蛋白阳性表达与临床病理特征之间的相关性。采取Kaplan-Meier法和Log-rank检验法进行生存分析。多因素Cox回归分析评判危险因素。检验水准(α)为0.05。
2 结 果 2.1 CXCR7蛋白在不同卵巢组织中的表达情况免疫组化结果显示,CXCR7阳性表达于细胞膜和细胞质中,其在正常卵巢生发上皮组织和良性卵巢肿瘤组织中不表达或局部低表达,而在卵巢癌组织中表达明显增多(图 1)。卵巢癌组织中CXCR7的阳性表达率为68.42%(39/57),良性卵巢肿瘤组织中CXCR7的阳性表达率为26.67%(4/15),正常卵巢生发上皮组织中CXCR7的阳性表达率为13.33%(2/15)。CXCR7在3组卵巢组织中的表达差异有统计学意义(χ2=19.97,P=0.000 1),其中CXCR7在卵巢癌组织中的表达与其他两组相比差异有统计学意义(P<0.01)。
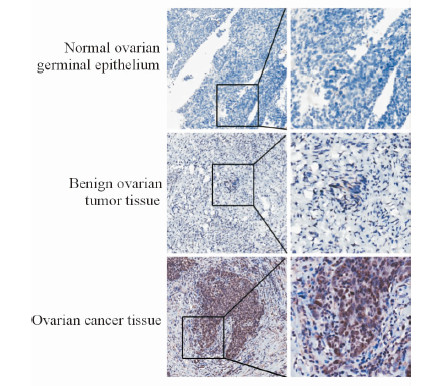
|
图 1 CXCR7蛋白在不同卵巢组织中的表达情况 Fig 1 CXCR7 protein expression in different ovarian tissues Original magnification: ×100 (left), ×200 (right) |
2.2 卵巢癌组织中CXCR7蛋白表达与临床病理资料的关系
结果表明,卵巢癌组织中CXCR7蛋白的阳性表达与患者的年龄、术前CA125水平、卵巢癌肿瘤病理类型、残余肿瘤直径、腹水的含量及肿瘤的大小无明显关联 (P>0.05),而与患者FIGO分期、肿瘤的组织学分级、有无淋巴结转移及腹腔转移有关(P<0.05)。见表 1。
|
|
表 1 卵巢癌组织中CXCR7蛋白表达与临床病理资料的关系 Tab 1 Relationship between the expression of CXCR7 protein and clinicopathological characteristics in ovarian cancer patients |
2.3 卵巢癌预后的影响因素分析
单因素及多因素分析发现,CXCR7蛋白表达水平、患者FIGO分期、肿瘤的组织学分级、有无淋巴结转移及腹腔转移与卵巢癌患者的总生存率和无瘤生存率存在统计学意义上的关联(P<0.05)。见表 2。
|
|
表 2 单因素及多因素分析卵巢癌预后的影响因素 Tab 2 Univariate and multivariate analysis of ovarian cancer prognosis |
2.4 CXCR7蛋白的阳性表达对卵巢癌患者预后生存期的影响
Kaplan-Meier曲线显示,卵巢癌患者中CXCR7蛋白阳性患者的总生存率(P=0.025)和无瘤生存率(P=0.043)均较CXCR7蛋白阴性患者降低,差异有统计学意义(图 2)。
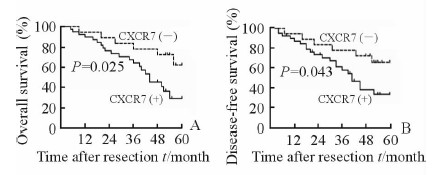
|
图 2 CXCR7蛋白表达与卵巢癌患者术后总生存期(A)及无瘤生存期(B)之间的关系 Fig 2 Relationship between the expression of CXCR7 protein and overall survival (A) and disease-free survival (B) in ovarian cancer patients after surgery |
3 讨 论
卵巢癌死亡率相当高,早期即可发生远处转移,5年生存率约为30%~40%[12]。积极控制卵巢癌转移一直是临床的研究重点。由肿瘤细胞、间质组织和细胞外间质等构成的肿瘤生长所处的微环境与多种肿瘤的复发及转移存在相关性。作为肿瘤微环境成分之一的趋化因子及其受体已证实与肝癌、胃癌、结直肠癌等复发及转移相关[13-15]。趋化因子12(CXCL12)为CXC趋化因子家族成员,也称作基质细胞衍生因子1 (stromal cell derived factor 1,SDF-1)。既往认为,CXCL12与其唯一受体CXCR4结合参与了肿瘤的发生及发展[16]。2006年,Burns等[17]通过研究发现,除了CXCR4,CXCL12还与受体CXCR7相结合,后者与CXCR4在肿瘤的发生、发展及转移中具有相似的生物学功能。目前,多项基础及临床研究表明CXCR4与卵巢癌的发生、发展及转移存在正相关[18-21]。2015年,Yu等[7]通过细胞实验得出,CXCR7可以促进卵巢癌细胞的侵袭及转移。而郭晶等[22]发现CXCR7的表达水平与食管磷癌患者复发转移及预后密切相关。Iwakiri等[23]通过研究CXCR7与非小细胞肺癌之间的关系得出,高表达CXCR7的非小细胞肺癌患者的预后较差。
为了明确CXCR7在卵巢癌中的临床意义,我们做了以下分析:(1)采用免疫组化方法检测CXCR7蛋白在正常卵巢组织、良性卵巢肿瘤组织和卵巢癌组织中的表达情况。结果表明,CXCR7蛋白的阳性表达率在卵巢癌组织中最高,且与其他2组相比差异有统计学意义,初步验证了卵巢癌患者中的CXCR7蛋白阳性表达的临床意义。(2)回顾性总结了卵巢癌患者的临床资料并进行随访,发现CXCR7蛋白的阳性表达与卵巢癌患者的FIGO分期、肿瘤的组织学分级、有无淋巴结转移及腹腔转移存在关联。单因素及多因素分析发现CXCR7蛋白表达水平、患者FIGO分期、肿瘤的组织学分级、有无淋巴结转移及腹腔转移与卵巢癌患者的总生存率和无瘤生存率亦存在相关性。(3)分析了CXCR7蛋白的阳性表达与卵巢癌患者的预后生存期之间关系,发现CXCR7蛋白阳性表达的卵巢癌患者的无瘤生存期及总生存期低于CXCR7蛋白阴性表达的卵巢癌患者。
综上所述,卵巢癌组织中CXCR7蛋白的阳性表达与患者的临床病理特征和预后存在一定的相关性,提示卵巢癌组织中CXCR7蛋白的阳性表达可能是预测卵巢癌预后及治疗的一项重要指标。有关其具体的转移机制仍需要大量的研究进一步阐明。
| [1] | Ozols R F. Treatment goals in ovarian cancer. Int J Gynecol Cancer[J]. 2005, 15 (Suppl 1) :3–11 . |
| [2] | Kong F, Sun C, Wang Z, Han L, Weng D, Lu Y, et al. miR-125b confers resistance of ovarian cancer cells to cisplatin by targeting pro-apoptotic Bcl-2 antagonist killer 1. J Huazhong Univ Sci Technol[Med Sci][J]. 2011, 31 :543–549 . |
| [3] | Zheng H, Gao Y N. Primary debulking surgery or neoadjuvant chemotherapy followed by interval debulking surgery for patients with advanced ovarian cancer. Chin J Cancer Res[J]. 2012, 24 :304–309 . |
| [4] | Chen Q, Gao G, Luo S. Hedgehog signaling pathway and ovarian cancer. Chin J Cancer Res[J]. 2013, 25 :346–353 . |
| [5] | Gerber P A, Hippe A, Buhren B A, Müller A, Homey B. Chemokines in tumor-associated angiogenesis. Biol Chem[J]. 2009, 390 :1213–1223 . |
| [6] | 何腾龙.CXCR7及其配体CXCL12对人卵巢癌HO8910细胞增殖、粘附和侵袭能力的影响[D].重庆:重庆大学,2013. |
| [7] | Yu H, Zhang L, Liu P. CXCR7 signaling induced epithelial-mesenchymal transition by AKT and ERK pathways in epithelial ovarian carcinomas. Tumour Biol[J]. 2015, 3 :1679–1683 . |
| [8] | Yu Y, Li H, Xue B, Jiang X, Huang K, Ge J, et al. SDF-1/CXCR7 axis enhances ovarian cancer cell invasion by MMP-9 expression through p38 MAPK pathway. DNA Cell Biol[J]. 2014, 33 :543–549 . |
| [9] | 陈晓端.卵巢肿瘤WHO组织学分类(2003年)及病理诊断进展[C].第八次全国妇产科学病理学术会议,2005. |
| [10] | Mutch D G, Prat J. 2014 FIGO staging for ovarian, fallopian tube and peritoneal cancer. Gynecol Oncol[J]. 2014, 133 :401–404 . |
| [11] | Remmele W, Stegner H E. [Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue]. Pathologe[J]. 1987, 8 :138–140 . |
| [12] | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun M J. Cancer statistics, 2009. CA Cancer J Clin[J]. 2009, 59 :225–249 . |
| [13] | Lin K Y, Su H W. Progress in understanding role of chemokine receptors in liver metastases of colorectal cancer. World Chin J Digestol[J]. 2013, 21 :2403. |
| [14] | Miyazaki H, Takabe K, Yeudall W A. Chemokines, chemokine receptors and the gastrointestinal system. World J Gastroenterol[J]. 2013, 19 :2847–2863 . |
| [15] | Zheng K, Li H Y, Su X L, Wang X Y, Tian T, Li F, et al. Chemokine receptor CXCR7 regulates the invasion, angiogenesis and tumor growth of human hepatocellular carcinoma cells. J Exp Clin Cancer Res[J]. 2010, 29 :31–45 . |
| [16] | Balkwill F. The significance of cancer cell expression of the chemokine receptor CXCR4. Semin Cancer Biol[J]. 2004, 14 :171–179 . |
| [17] | Burns J M, Summers B C, Wang Y, Melikian A, Berahovich R, Miao Z, et al. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med[J]. 2006, 203 :2201–2213 . |
| [18] | Guo L, Cui Z M, Zhang J, Huang Y. Chemokine axes CXCL12/CXCR4 and CXCL16/CXCR6 correlate with lymph node metastasis in epithelial ovarian carcinoma. Chin J Cancer[J]. 2011, 30 :336–343 . |
| [19] | Li J, Jiang K, Qiu X, Li M, Hao Q, Wei L, et al. Overexpression of CXCR4 is significantly associated with cisplatin-based chemotherapy resistance and can be a prognostic factor in epithelial ovarian cancer. BMB Rep[J]. 2014, 47 :33–38 . |
| [20] | Popple A, Durrant L G, Spendlove I, Rolland P, Scott I V, Deen S, et al. The chemokine, CXCL12, is an independent predictor of poor survival in ovarian cancer. Br J Cancer[J]. 2012, 106 :1306–1313 . |
| [21] | Yu Y, Shi X, Shu Z, Xie T, Huang K, Wei L, et al. Stromal cell-derived factor-1(SDF-1)/CXCR4 axis enhances cellular invasion in ovarian carcinoma cells via integrin β1 and β3 expressions. Oncol Res[J]. 2013, 21 :217–225 . |
| [22] | 郭晶, 卢春来, 古杰, 葛棣. 趋化因子受体7(CXCR7)在食管鳞形细胞癌组织中的表达及其临床意义. 复旦学报(医学版)[J]. 2013,40 :26–30. |
| [23] | Iwakiri S, Mino N, Takahashi T, Sonobe M, Nagai S, Okubo K, et al. Higher expression of chemokine receptor CXCR7 is linked to early and metastatic recurrence in pathological stage Ⅰ nonsmall cell lung cancer. Cancer[J]. 2009, 115 :2580–2593 . |
 2016, Vol. 37
2016, Vol. 37


